
- •1 Предмет і завдання хімі. Основні етапи розвитку хімії. Зв*язок хімії з іншими природничими ауками.
- •2 Роль хімії в народному господарстві, медицині. Хімія та екологія.
- •3 Основні поняття і закони в хімії. Хімічні та фізичні явища. Атомна і молекулярна маса.
- •Основні поняття і закони в хімії
- •7 Періодичний закон та періодична система елементів д.І. Мендєлєєва, структура періодичного хімічних елементів. Значення періодичного закону.
- •Значення періодичного закону:
- •8 Будова атома: ядро, енергетичні рівні. Електронні конфігурації атомів елементів в основному та збудженому стані.
- •Типи хімічних зв’язків:
- •11 Типи хімічних реакцій. Типи кристалічних граток.
- •Кристалічні гратки:
- •12 Оксиди.
- •Застосування
- •20 Сильні і слабкі електроліти. Дисоціація кислот, основ. Солей на іони.
- •21 Галогени. Хлор. Якісна реакція на хлорид – іон.
- •22 Сульфур. Алотропні модифікації сульфуру. Застосування.
- •23 Оксинен. Алотропні модифікації оксисену. Застосування.
- •24 Оксид Сульфуру (IV).
- •Хімічні властивості
- •25 Сульфур(VI) оксид
- •26 Сульфатна кислота.
- •27 Нітроген. Будова молекул
- •Якісна реакція
- •31 Фосфор. Алотропні модифікації.
- •Поширення в природі
- •32 Сполуки фосфору. Якісна реакція. Біологічне значення. Фосфатні добрива.
- •33 Карбон. Алотропні модифікації. Поняття про адсорбцію, застосування.
- •Фізичні властивості Алотропні модифікації
- •34 Оксиди карбону. Карбонатна кислота та її солі. Якісна реакція. Твердість води та способи її усунення. Кругообіг Карбону в природі.
- •36 Силіцій (4) оксид. Силікатна кислота. Силікати. Поняття про будівельні матеріали.
- •Хімічні властивості силіцій(IV) оксиду
- •37 Загальна характеристика металів.
- •Залежність швидкості реакцій від різних чинників
- •Хімічна рівновага
- •2 Теорія хімічної будови органічних сполук о. М. Бутлерова
- •3 Класифікація органічних сполук. Поняття про функціональні групи. Ізомерія
- •Класифікація
- •Найважливіші класи органічних сполук
- •4 Електронна будова атома Карбону. Основний і збуджений стан атома Карбону.
- •5 Алкани.
- •6 Фізичні і хімічні властивості насичених вуглеводнів. Добування, застосування
- •16 Одноатомні спирти
- •17 Фізичні та хімічні властивості одноатомних спиртів. Застосування. Отруйність спиртів та їх згубна дія на організм людини.
- •18 Багатоатомні спирти. Етиленгліколь і гліцерин
- •24 Одноосновні карбонові кислоти
- •Значення жирів
- •28 Мила
- •Класифікація
- •Добування:
- •30 Амінокислоти
- •Класифікація
- •Класифікація
- •Хімічні властивості
- •Рибосомний синтез
- •Нерибосомний синтез
- •33 Вуглеводи. Глюкоза. Сахароза
- •Класифікація
- •34 Полісахариди
- •35 Крохмаль і целюлоза
- •36 Синтетичні високомолекулярні речовини. Полімерні матеріали. Синтетичні волокна і синтетичні каучуки, утворення гуми. Застосування полімерних матеріалів
- •37 Генетичний зв*язок між органічними і неорганічними речовинами.
- •40 Хімія і екологія.
12 Оксиди.
Окси́д — бінарна сполука, до складу якої входить Оксиген.
Класифікація:
-Основні оксиди - це оксиди, яким відповідають основи
- До кислотних оксидів відносять такі оксиди, які взаємодіють з основними та амфотерними оксидами, а також з їх гідроксидами з утворенням солей.
- Амфотерними називають такі оксиди, які взаємодіють як з кислотами, так і з основами, утворюючи сіль і воду.
- Несолетвірні називають такі оксиди, які не взаємодіють ні з кислотами, ні з основами і солей не утворюють.
Номенклатура:
Назви оксидів утворюються так:
СО – карбону (ІІ) оксид;
СО2 – карбону (IV) оксид;
FeO – феруму (ІІ) оксид;
Al2O3 – алюмінію оксид.
Якщо елемент утрвоює кілька оксидів, то в їх назвах зазначається ступінь окислення елемента римською цифрою в дужках.
Існують сполуки елементів з оксигеном, які лише формально належать до класу оксидів. До них належать пероксиди. Їх розглядають як солі пероксиду гідрогену Н2О2-1.
Способи добування оксидів.
Горіння простих і складних речовин:
- СН4 + 2О2=СО2 + 2Н2О
Розклад під час нагрівання складних оксигеновмісних сполук: солей, гідроксидів, кислот:
-СаСО3=CaO + CO2
Взаємодія металів з кислотами – окисниками:
- 3Сu + 8HNO3= 3Cu (NO3)2 + 2NO2 + 4H2O
Окислення нищих оксидів і розкладання вищих оксидів:
- 2NO + O2=2NO2
Фізичні властивості
Всі основні і амфотерні властивості речовини, без запаху. Вони можуть мати різне забарвлення. ZnO, MgO – білий, CuO – чорний, Cr2O3 – зелений, Al2O3 – червоний або синій (рубін і сапфір) і ін.Твердими є деякі кислотні оксиди: P2O5 SiO2 і ін.Газоподібними кислотними оксидами є CO2 SO2 і ін.
Хімічні властивості
Основні оксиди
1.Взаємодіють (реагують) з водою: тільки оксиди активних металів (Na, K, Ca, Ba і т.д.) При цьому утворюються розчинні основи (луги).
СаО + Н2О = Са (ОН)2 Na2O + H2O =2NaOH
2.Взаємодіють з кислотами
СuO + H2SO4 =CuSO4 + H2O
3.Взаємодіють між собою
СaO + SiO2 =CaSiO3 CaO + CO2 = CaCO3
Кислотні оксиди
1.Не всі кислотні оксиди взаємодіють з водою. SiO2 і деякі інші з водою не реагують.
SO3 + H2O =H2SO4 P2O5 + 3H2O = 2H3PO4
2. Взаємодіють з основами
CO2 + Ca (OH)2 = CaCO3 + H2O
Амфотерні оксиди
1. Взаємодіють з кислотами:
ZnO + 2HCl = ZnCl2 + H2O
2.Взаємодіють з лугами:
ZnO + 2NaOH +H2O = Na2 [Zn (OH)4] Zn + 2NaOH =Na2ZnO2 + H2O
Застосування
13 Основи.
Основи — складні речовини, до складу яких входять атом металу й одна або кілька гідроксильних груп.
Класифікація
Основи класифікуються за розчинністю у воді:
- на розчинні, або луги, — добуті лужними або лужноземельними металами:
Li, Na, K, Rb, Cs, Ba, Sr, Ca;
- нерозчинні — всі інші основи.
Номенклатура
Назви основ утворюються від назви відповідного металу в називному відмінку і слова «гідроксид»:
NaOH — натрій гідроксид;
Fe2O2 — ферум(ІІ) гідроксид;
Fe2O3 — ферум(ІІІ) гідроксид.
Застосовуються й інші традиційні назви:
NaOH — їдкий натр;
Ca(OH)2 — гашене вапно.
Способи добування основ
1) Луги добувають:
— взаємодією води з лужними або лужноземельними металами:
![]()
— взаємодією води з оксидами лужних і лужноземельних металів:
BaO + 2H2O = Ba(OH)2
2) Нерозчинні основи добувають унаслідок взаємодії розчинних солей з лугами:
![]()
Фізичні властивості
За нормальних умов усі луги — тверді речовини білого кольору, милкі на дотик, їдкі, роз’їдають шкіру, тканини, папір. Нерозчинні основи — тверді речовини різного кольору.
Хімічні властивості
1) Луги мають такі хімічні властивості:
— змінюють забарвлення індикаторів: фенолфталеїну без кольору на малинове, метилового оранжевого на жовте, фіолетового лакмусу на синє, універсального індикаторного паперу на синє;
взаємодіють із кислотними оксидами:
![]()
— взаємодіють із кислотами:
![]()
— реагують із солями:
![]()
2) Нерозчинні основи мають такі хімічні властивості:
— не змінюють забарвлення індикаторів;
— практично не взаємодіють із кислотними оксидами;
— взаємодіють із кислотами:
![]()
— розкладаються при нагріванні:
![]()
Реакція взаємодії кислот з основами називається реакцією нейтралізації і належить до реакцій обміну.
Застосування
Використовують здебільшого NaOH, CaOH. Здебільшого використовують СаОН – гашене вапно. Використовується в виготовлені будівельних сумішей. Вапняним молоком навесні підбілюють дерева. КОН – в цукровій промисловості для виготовлення зубних паст. NaOH – в виробництві ліків, мила.
14 Кислоти.
Кислоти — це складні речовини, що складаються з одного чи декількох атомів Гідрогену та кислотного залишку.
Класифікація
за силою ( сильні, слабкі, середні);
за основністю
За наявністю атомів Оксигену кислоти поділяють на оксигеновмісні (H2SO3, H2SiO3) та безоксигенові (HCl, H2S)
За основністю кислоти поділяють на одноосновні (HCl, HNO3), двоосновні (H2SO4, H2CO3) та триосновні (H3PO4).
Номенклатура
· хлоридна кислота HCl;
· сульфатна кислота H2SO4;
· сульфітна кислота H2SO3;
· сульфідна кислота H2S;
· нітратна кислота HNO3;
· ортофосфатна кислота H3PO4;
· карбонатна кислота H2CO3;
· силікатна кислота H2SiO3.
Способи добування
Оксигеновмісні розчинні у воді кислоти можна добути взаємодією оксидів з водою:
![]()
Оксигеновмисні нерозчинні у воді кислоти добувають взаємодією відповідної солі з більш сильною кислотою:
![]()
Безкисневі кислоти добувають взаємодією водню з неметалом:
![]()
з наступним розчиненням продукту реакції у воді.
Фізичні властивості
Більшість кислот — рідини, але є і тверді кислоти, наприклад ортофосфатна і метафосфатна, силікатна. Усі кислоти важчі за воду й у більшості випадків добре в ній розчиняються. Деякі леткі кислоти (хлоридна, нітратна) мають характерний запах. Майже всі кислоти безбарвні.
Хімічні властивості
Дія на індикатори. Речовини, які змінюють своє забарвлення під дією кислот або лугів, називаються індикаторами.
2) Взаємодія з металами.
Метали, що стоять у ряді напруг до Гідрогену, витісняють його з розведених кислот (крім нітратної кислоти):
![]()
Кислоти реагують з оксидами, що утворені металами:
![]()
Кислоти реагують з основами:
![]()
Застосування
Кислоти є одними з найважливіших речовин. Найбільшу увагу приділяють сульфатній. Нітратній, хлорид ній, фосфатній. Сульфатну кислоту використовують у всіх галузях народного господарства. Без кислот неможливо виготовляти папір, тканини, метали. мінеральні добрива. Сульфатну кислоту використовують у пробці нафти і виробництві кольорових металів. Хімічних засобів. Також використовують у харчовій промисловості.
15 Солі.
Солі — це складні речовини, утворені атомами металів і кислотними залишками.
Класифікація
Назви солей складаються з назви металу і назви кислотного залишку.
Добування
Реакція нейтралізації:
КОН + HNО3 = KNО3 + Н2О
Взаємодія кислот з основними оксидами:
CuO + H2SО4 = CuSO4 + Н2О
Взаємодія кислот із солями:
ВаСl2 + H2S04 = BaS04↓ + 2НСl
Взаємодія кислот з металами:
Mg + 2HCl = MgCl2 + H2↑
Взаємодія двох різних солей:
AgNО3 + КСl = AgCl↓ + KNО3
Взаємодія солей з металами:
Fe + CuSO4 = FeSО4 + Cu
Взаємодія солей з лугами:
ЗКОН + FeCl3 = Fe(OH)3↓ + ЗКСl
Взаємодія лугів з кислотними оксидами:
Са(ОН)2 + СО2 = СаСО3 + Н2О
Взаємодія основних оксидів з кислотними:
СаО + SiО2 = CaSiО3
Взаємодія металів із неметалами:
Fe + S = FeS
Номенклатура
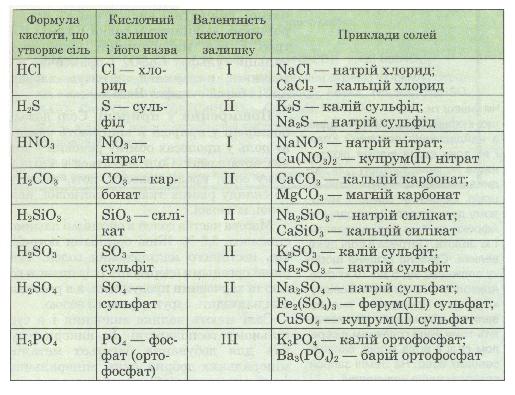
Фізичні властивості солей
За нормальних умов усі солі — тверді кристалічні речовини різного кольору. Розчинність їх у воді різна.
Хімічні властивості
Солі можуть взаємодіяти з кислотами лише в тому випадку, коли реагуюча кислота сильніша за ту, від якої походить дана сіль:
FeS + 2HCl = FeCl2 + H2S ↑ Na2SiO3 + Н2SO4 = Na2SO4 + H2SiO3 ↓
2. Солі можуть взаємодіяти з лугами, коли внаслідок реакції утворюється нерозчинна основа або нерозчинна сіль:
FeCl3 + 3NaOH = 2NaCl + Fe(OH)3 ↓ K2CO3 + Ba(OH)2 = 2KOH + BaCO3 ↓
3. Розчини солей можуть взаємодіяти з металами, коли даний метал в електрохімічному ряду напруги стоїть лівіше від металу солі:
CuSO4 + Fe = FeSO4 + Cu HgCl2 + Cu = CuCl2 + Hg
4. Багато солей у розчинах можуть взаємодіяти одна з одною, коли одна із солей, що утворюється внаслідок реакції, є нерозчинною:
Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓ FeSO4 + BaCl2 = FeCl2 + BaSO4 ↓
