
- •1 Предмет і завдання хімі. Основні етапи розвитку хімії. Зв*язок хімії з іншими природничими ауками.
- •2 Роль хімії в народному господарстві, медицині. Хімія та екологія.
- •3 Основні поняття і закони в хімії. Хімічні та фізичні явища. Атомна і молекулярна маса.
- •Основні поняття і закони в хімії
- •7 Періодичний закон та періодична система елементів д.І. Мендєлєєва, структура періодичного хімічних елементів. Значення періодичного закону.
- •Значення періодичного закону:
- •8 Будова атома: ядро, енергетичні рівні. Електронні конфігурації атомів елементів в основному та збудженому стані.
- •Типи хімічних зв’язків:
- •11 Типи хімічних реакцій. Типи кристалічних граток.
- •Кристалічні гратки:
- •12 Оксиди.
- •Застосування
- •20 Сильні і слабкі електроліти. Дисоціація кислот, основ. Солей на іони.
- •21 Галогени. Хлор. Якісна реакція на хлорид – іон.
- •22 Сульфур. Алотропні модифікації сульфуру. Застосування.
- •23 Оксинен. Алотропні модифікації оксисену. Застосування.
- •24 Оксид Сульфуру (IV).
- •Хімічні властивості
- •25 Сульфур(VI) оксид
- •26 Сульфатна кислота.
- •27 Нітроген. Будова молекул
- •Якісна реакція
- •31 Фосфор. Алотропні модифікації.
- •Поширення в природі
- •32 Сполуки фосфору. Якісна реакція. Біологічне значення. Фосфатні добрива.
- •33 Карбон. Алотропні модифікації. Поняття про адсорбцію, застосування.
- •Фізичні властивості Алотропні модифікації
- •34 Оксиди карбону. Карбонатна кислота та її солі. Якісна реакція. Твердість води та способи її усунення. Кругообіг Карбону в природі.
- •36 Силіцій (4) оксид. Силікатна кислота. Силікати. Поняття про будівельні матеріали.
- •Хімічні властивості силіцій(IV) оксиду
- •37 Загальна характеристика металів.
- •Залежність швидкості реакцій від різних чинників
- •Хімічна рівновага
- •2 Теорія хімічної будови органічних сполук о. М. Бутлерова
- •3 Класифікація органічних сполук. Поняття про функціональні групи. Ізомерія
- •Класифікація
- •Найважливіші класи органічних сполук
- •4 Електронна будова атома Карбону. Основний і збуджений стан атома Карбону.
- •5 Алкани.
- •6 Фізичні і хімічні властивості насичених вуглеводнів. Добування, застосування
- •16 Одноатомні спирти
- •17 Фізичні та хімічні властивості одноатомних спиртів. Застосування. Отруйність спиртів та їх згубна дія на організм людини.
- •18 Багатоатомні спирти. Етиленгліколь і гліцерин
- •24 Одноосновні карбонові кислоти
- •Значення жирів
- •28 Мила
- •Класифікація
- •Добування:
- •30 Амінокислоти
- •Класифікація
- •Класифікація
- •Хімічні властивості
- •Рибосомний синтез
- •Нерибосомний синтез
- •33 Вуглеводи. Глюкоза. Сахароза
- •Класифікація
- •34 Полісахариди
- •35 Крохмаль і целюлоза
- •36 Синтетичні високомолекулярні речовини. Полімерні матеріали. Синтетичні волокна і синтетичні каучуки, утворення гуми. Застосування полімерних матеріалів
- •37 Генетичний зв*язок між органічними і неорганічними речовинами.
- •40 Хімія і екологія.
24 Одноосновні карбонові кислоти
Карбонові кислоти — це органічні сполуки, до складу молекул яких входить карбоксильна функціональна група:
Застосування карбонових кислот.
Мурашина кислота застосовується як протрава для фарбування шерсті, консервант фруктових соків і силосу, використовується для дезінфекції місткостей у харчовій промисловості, у хімічних синтезах.
Оцтова кислота застосовується для добування пластмас, барвників, ліків, штучних волокон, кіноплівки в хімічних синтезах. Вона використовується як приправа до їжі, для консервації овочів. Солі оцтової кислоти використовують для фарбування тканин, а також для боротьби зі шкідниками сільського господарства.
Класифікація карбонових кислот
• класифікація за кількістю карбоксильних груп
монокарбонові кислоти, наприклад: мурашина кислота, оцтова кислота,
полікарбоннові кислоти, наприклад: щавлева кислота, янтарна кислота
• класифікація за будовою вуглеводневого радикалу
насичені карбонові кислоти, наприклад: мурашина кислота, оцтова кислота.
ненасичені карбонові кислоти, наприклад: акрилова кислота
ароматичні карбонові кислоти, наприклад: бензойна кислота
Гомлогічний ряд
Метанова кислота - Мурашина кислота
Етанова кислота - Оцтова кислота
Пропанова кислота - Пропіонова кислота
Бутанова кислота - Масляна кислота
Пентанова кислота - Валеріанова кислота
Будова
У молекулах карбонових кислот, як і в молекулах спиртів, містяться гідроксильні групи, унаслідок чого кислоти виявляють деяку схожість із спиртами. Але в кислотах гідроксильна група знаходиться під впливом групи атомів карбоксилу, в той час як в спиртах на неї впливає вуглеводневий радикал. Вплив карбонільної групи на гідроксил проявляється, зокрема, в тому, що атом водню гідроксильної групи в кислотах значно більш «кислотний», ніж у спиртах: легше заміщується металом і може відщеплюватися у вигляді катіона
За систематичною номенклатурою, назву кислот утворюють із назв відповідних насичених вуглеводнів, додаючи до них суфікс і закінчення -ова і слово кислота.
25 Хімічні та сфізичні властивості одноосновних карбонових кислот
Фізичні властивості
Мурашина кислота
— безбарвна рідина з різким запахом,
температура плавлення
![]() ,
кипіння
,
кипіння
![]() . Розчиняється у воді в будь-яких
кількостях.
. Розчиняється у воді в будь-яких
кількостях.
Оцтова кислота
— за кімнатної температури безбарвна
рідина з різким характерним запахом.
За температури нижчої за
![]() (температура
плавлення) кристалізується і стає схожою
на лід, тому її називають«крижаною»
оцтовою кислотою. Температура кипіння
(температура
плавлення) кристалізується і стає схожою
на лід, тому її називають«крижаною»
оцтовою кислотою. Температура кипіння
![]() . Розчиняється у воді в будь-яких
кількостях: 3—9%-й розчин називається
оцтом, 70—80%-й розчин — оцтовою есенцією.
. Розчиняється у воді в будь-яких
кількостях: 3—9%-й розчин називається
оцтом, 70—80%-й розчин — оцтовою есенцією.
Хімічні властивості
карбонові кислоти проявляють всі властивості характерні для неорганічних кислот і є слабкими електролітами:
2СH3COOH + 2Na → 2CH3COONa + H2;
2СH3COOH + Na2O → 2CH3COONa + H2O;
СH3COOH + NaOH → CH3COONa + H2O;
2СH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2;
СH3COOH + NaHCO3 → CH3COONa + H2O + CO2
СH3COONa + H2SO4 → CH3COOH + NaHSO4
утворення складних ефірів (реакція етерифікації) у присутності каталізатора –
сульфатної кислоти:
![]()
Зворотна реакція називається омиленням або гідролізом складного ефіру.
Добування
1. окислення спиртів або альдегідів
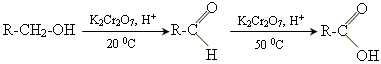
Отримання мурашиної кислоти
1. каталітичне окислення метану
2CH4 + 3O2 → 2H-COOH + 2H2O
Взаємодія оксиду Карбогену(ІІ) з гідроксидом Натрію при нагріванні
CO + NaOH → H-COONa;
H-COONa + H2SO4 → H-COOH + NaHSO4
Отримання оцтової кислоти
1. каталітичне окислення бутану
2CH3–CH2–CH2–CH3 + 5O2 → 4CH3COOH + 2H2O
2. Взаємодія оксиду Карбогену(ІІ) з метанолом
CH3OH + CO → CH3COOH
Отримання ароматичних кислот
окислення гомологів бензолу
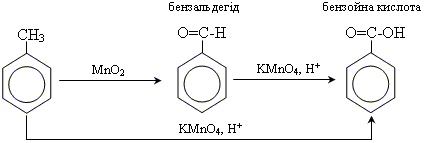
26 Естери
Естери можна розглядати як похідні кислот, у яких Гідроген гідроксильної групи заміщений на вуглеводневий радикал спирту.
Назви естерів утворюються від назв відповідних кислот і спиртів з додаванням слова естер. Наприклад, естер

можна назвати етиловий естер оцтової кислоти, за міжнародною систематичною номенклатурою — етилацетат (суфікс -ат).
Загальна формула естерів:
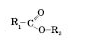
де R1 — вуглеводневий радикал кислоти (у мурашиній кислоті це атом Гідрогену), R2 — вуглеводневий радикал спирту.
Фізичні властивості естерів. Естери нижчих карбонових кислот і спиртів — леткі рідини, малорозчинні або нерозчинні у воді, добре розчинні у спирті та інших органічних розчинниках. Багато естерів мають приємний запах.
Естери вищих кислот і спиртів — воскоподібні речовини, без запаху, нерозчинні у воді, добре розчинні в органічних розчинниках.
Реакція утворення естеру з карбонової кислоти і спирту називається реакцією естерифікації. Наприклад:
CH3–![]() + CH3OH = CH3–
+ CH3OH = CH3–![]() ++ H2O
++ H2O
метилацетат
Хімічні властивості естерів. Взаємодія естеру з водою, що призводить до утворення вихідних спирту і кислоти, називається реакцією гідролізу, або омилення.
1) Кислотний гідроліз (каталізатор — іони Гідрогену) оборотний:
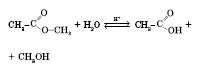
2) Лужний гідроліз (каталізатор — іони гідроксигрупи) необоротний, оскільки утворюється сіль карбонової кислоти:
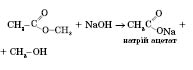
Застосування естерів. Складні естери застосовуються як розчинники та розріджувачі для лаків і фарб, як ароматизатори в харчовій промисловості.
27 Жири
Жири — це естери, утворені вищими одноосновними карбоновими кислотами й триатомним спиртом гліцерином. Загальна назва таких сполук — тригліцериди. Природні жири — суміш різних тригліцеридів.
Загальна формула тригліцеридів:
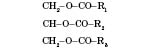
де
![]() ,
,![]() ,
,
![]() — вуглеводневі радикали кислот.
— вуглеводневі радикали кислот.
Назви жирів визначаються назвами кислот, які входять до їхнього складу. Наприклад, жир
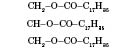
називається тригліцерид стеаринової кислоти,або тристеарин.
Фізичні властивості жирів. За кімнатної температури жири бувають рідкими й твердими. Агрегатний стан жирів визначається жирними кислотами, які входять до їхнього складу. Тверді жири утворені насиченими кислотами, рідкі жири (олії) — ненасиченими. Температура плавлення жиру тим вища, чим більше в ньому насичених кислот і чим довший кислотний радикал. Тваринні жири частіше тверді, рослинні частіше рідкі.
Жири розчинні в органічних розчинниках і нерозчинні у воді.
Біологічне значення жирів. Жири входять до складу клітин рослинних і тваринних організмів, є джерелом енергії в клітині, будівельним матеріалом, беруть участь в обміні речовин, відкладаються в тканинах організму як запасна поживна речовина.
Хімічні властивості жирів.
Рідкі жири можна перетворити на тверді шляхом їх гідрування:
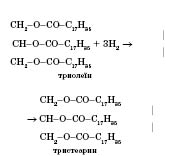
Ця реакція лежить в основі виробництва маргарину, мила, стеарину й гліцерину.
Кислотний гідроліз жирів (оборотний):
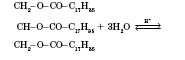
→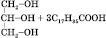
Лужний гідроліз жирів (необоротний):
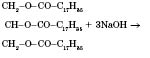
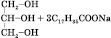
натрій стеарат (мило)
У результаті утворюються солі жирних кислот — мила.
Застосування жирів. Жири застосовуються в харчовій промисловості, в косметології, для добування гліцерину і вищих карбонових кислот.
