
- •1 Предмет і завдання хімі. Основні етапи розвитку хімії. Зв*язок хімії з іншими природничими ауками.
- •2 Роль хімії в народному господарстві, медицині. Хімія та екологія.
- •3 Основні поняття і закони в хімії. Хімічні та фізичні явища. Атомна і молекулярна маса.
- •Основні поняття і закони в хімії
- •7 Періодичний закон та періодична система елементів д.І. Мендєлєєва, структура періодичного хімічних елементів. Значення періодичного закону.
- •Значення періодичного закону:
- •8 Будова атома: ядро, енергетичні рівні. Електронні конфігурації атомів елементів в основному та збудженому стані.
- •Типи хімічних зв’язків:
- •11 Типи хімічних реакцій. Типи кристалічних граток.
- •Кристалічні гратки:
- •12 Оксиди.
- •Застосування
- •20 Сильні і слабкі електроліти. Дисоціація кислот, основ. Солей на іони.
- •21 Галогени. Хлор. Якісна реакція на хлорид – іон.
- •22 Сульфур. Алотропні модифікації сульфуру. Застосування.
- •23 Оксинен. Алотропні модифікації оксисену. Застосування.
- •24 Оксид Сульфуру (IV).
- •Хімічні властивості
- •25 Сульфур(VI) оксид
- •26 Сульфатна кислота.
- •27 Нітроген. Будова молекул
- •Якісна реакція
- •31 Фосфор. Алотропні модифікації.
- •Поширення в природі
- •32 Сполуки фосфору. Якісна реакція. Біологічне значення. Фосфатні добрива.
- •33 Карбон. Алотропні модифікації. Поняття про адсорбцію, застосування.
- •Фізичні властивості Алотропні модифікації
- •34 Оксиди карбону. Карбонатна кислота та її солі. Якісна реакція. Твердість води та способи її усунення. Кругообіг Карбону в природі.
- •36 Силіцій (4) оксид. Силікатна кислота. Силікати. Поняття про будівельні матеріали.
- •Хімічні властивості силіцій(IV) оксиду
- •37 Загальна характеристика металів.
- •Залежність швидкості реакцій від різних чинників
- •Хімічна рівновага
- •2 Теорія хімічної будови органічних сполук о. М. Бутлерова
- •3 Класифікація органічних сполук. Поняття про функціональні групи. Ізомерія
- •Класифікація
- •Найважливіші класи органічних сполук
- •4 Електронна будова атома Карбону. Основний і збуджений стан атома Карбону.
- •5 Алкани.
- •6 Фізичні і хімічні властивості насичених вуглеводнів. Добування, застосування
- •16 Одноатомні спирти
- •17 Фізичні та хімічні властивості одноатомних спиртів. Застосування. Отруйність спиртів та їх згубна дія на організм людини.
- •18 Багатоатомні спирти. Етиленгліколь і гліцерин
- •24 Одноосновні карбонові кислоти
- •Значення жирів
- •28 Мила
- •Класифікація
- •Добування:
- •30 Амінокислоти
- •Класифікація
- •Класифікація
- •Хімічні властивості
- •Рибосомний синтез
- •Нерибосомний синтез
- •33 Вуглеводи. Глюкоза. Сахароза
- •Класифікація
- •34 Полісахариди
- •35 Крохмаль і целюлоза
- •36 Синтетичні високомолекулярні речовини. Полімерні матеріали. Синтетичні волокна і синтетичні каучуки, утворення гуми. Застосування полімерних матеріалів
- •37 Генетичний зв*язок між органічними і неорганічними речовинами.
- •40 Хімія і екологія.
Найважливіші класи органічних сполук
Алкани Алкени Алкіни Альдегіди Аміни Амінокислоти Ароматичні вуглеводні Вуглеводні
Естери Жири Карбонові кислоти Протеїни Органічні полімери Спирти Феноли
Ізомері́я — існування сполук, однакових за хімічним складом, але різних за будовою і властивостями. Такі сполуки називають ізомерами. Є структурна (конституційна), просторова (конформаційна) та оптична (конфігураційна) ізомерія. Ізомерія — одна з причин різноманітності та численності органічних сполук.
4 Електронна будова атома Карбону. Основний і збуджений стан атома Карбону.
Особливості хімії Карбону обумовлені, перш за все, значеннями величин електроненгативності, енергії іонізації і будовою валентних електронних підрівнів. Досить високі значення енегрії іонізації (I1=11,26 еВ) і невелике порівняно з іншими неметалами значення електроненгативності (за шкалою Полінга ЕН=2,5) обумовлюють схильність атому Карбону до утворення ковалентного хімічного зв’язку зі значною кількістю інших елементів.
У нормальному стані електронна конфігурація атому Карбону має формулу [He]2s22p2, що відповідає валентності рівної двом. Завдяки невеликій різниці в енергії 2s і 2p підрівнів атом Карбону може переходити у збуджений велентний стан 2s12p3, що відповідає чотирьохвалентному стану. Чотирьохвалентний стан для атому Карбону є найбільш харатерним. У чотирьохвалентному стані атом Карбону може мати координаційне число рівне двом (sp-гібридизація), трьом (sp2-гібридизація) і чотирьом (sp3-гібридизація).
На відміну від всіх інших елементів (за винятком водню) у атомі Кабону число валетних електронів співпадає з числом валентних орбіталей. Вказана особливість будови електронних підрівнів обумовлює, в основному, значну стійкість зв’язку C-C і схильність Кабону до утворення вуглецевих ланцюгів.
У хімічних сполуках Карбон часто проявляє ступені окислення -4, +2, +4. В переважній більшості органічних сполук Карбон утворює малополярний ковалентний зв’язок і тому використовувати поняття ступінь окислення у даному випадку недоцільно.
5 Алкани.
Алкани, насичені вуглеводні насичені ациклічні вуглеводні, що мають загальну формулу CnH2n+2, їх також називають парафінами.
Мета́н— найпростіша органічна сполука вуглецю з воднем, природний безбарвний газ без запаху, хімічна формула — CH4.
Зустрічається в осадовому чохлі земної кори у вигляді вільних скупчень (покладів), в розчиненому (в нафті, пластових і поверхневих водах), розсіяному, сорбованому (породами і органіч. речовиною) і твердому (газогідратному) станах.
При використанні в побуті, до метану звичайно додають одоранти зі специфічним «запахом газу».
Сігма-зв'язок або σ-зв'язок — різновид ковалентного зв'язку, для якого характерна осьова симетрія. Сігма-зв'язки — найміцніші із ковалентних зв'язків. Прикладами є зв'язки у двоатомних молекулах на зразок H2, N2, O2. Сігма-зв'язки утворюються також між атомами Карбону в хребтах полімерів, причому в насичених полімерах — це єдиний тип зв'язку, у ненасичених полімерах існують ще додаткові пі-зв'язки.
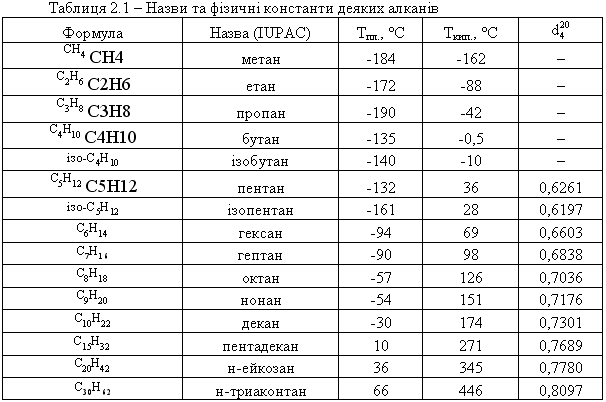
Ізомерія. Для алканів характерна структурна ізомерія, яка зумовлена можливістью розгалуження вуглецевого ланцюга молекули. Вуглеводень з прямим, нерозгалуженим ланцюгом назівається нормальним ізомером. У алканах з розгалуженим ланцюгом замісники (бічні ланцюги) можуть займати різне положення відносно головного ланцюга. Речовини, що мають однаковий склад,але різняться будовою вуглецевого ланцюга, називаються структурними ізомерами.
Номенклатура.Для того щоб дати розгалуженому вуглеводню назву згідно з цією номенклатурою, необхідно виконувати такі правила. Вибирають найдовших ланцюг атомів вуглецю в молекулі, Нумерують атоми вуглецю в головному вуглеводневому ланцюгу, починаючи з того кінця, до якого ближче розміщені розгалуження (пр. а). Якщо замісники знаходяться на рівних віддалях від кінця ланцюга, то нумерацію починають з того кінця.
Склад молекул усіх алканів відповідає загальній формулі СnН2n+2, де п = 1, 2, 3, 4…
