
- •Основы кинематики.
- •1.2. Основы динамики.
- •1.3. Законы сохранения в механике.
- •1.4. Механика твердого тела.
- •1.5. Релятивистская динамика.
- •2. Замедление времени. ,
- •1.6. Механические колебания
- •Свободные гармонические незатухающие колебания.
- •2. Свободные затухающие колебания
- •3. Вынужденные колебания. Резонанс.
- •Механические волны.
- •1.8. Основы молекулярно-кинетической теории вещества
- •1.9. Функции распределения максвелла и больцмана.
- •1.10. Основы термодинамики
- •2.1. Электрическое поле в вакууме
- •2.2. Электрическое поле в веществе.
- •Электрический ток.
- •2.4. Магнитное поле в вакууме.
- •Магнитное поле в веществе
- •2.6. Основы теории электромагнитного поля.
- •Ток смещения
- •2. Всякое изменяющееся во времени электрическое поле порождает вихревое магнитное поле.
- •Электромагнитные колебания
- •2.8. Электромагнитные волны.
- •Интерференция и дифракция света .
- •3.2. Поляризация и дисперсия света.
- •3.3. Тепловое излучение.
- •3.4. Фотоэффект. Эффект комптона. Давление света.
- •3.5. Основные положения квантовой механики.
- •3.6. Квантовая теория атома.
- •3.7. Элементы физики твердого тела.
- •3.8. Ядро атома.
- •3.9. Элементарные частицы.
1.9. Функции распределения максвелла и больцмана.
Распределение молекул по скоростям.
Среднюю
квадратичную скорость молекул газа при
температуре Т
можно оценить по (2 ) и (6):
![]() (12).
(12).
О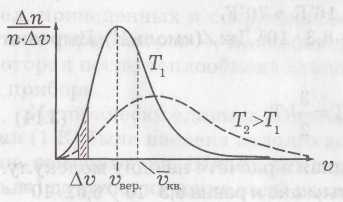 днако,
отдельные молекулы даже в случае одного
типа газа имеют
разные
скорости. Разброс по скоростям может
быть весьма велик. Это отражено на
рисунке,
на котором по вертикали
отложена
доля от общего числа
молекул в единице объема Δn/n,
имеющих
скорости
в некотором интервале от υ
до
υ+
Δ
υ,
в
расчете на единицу
этого интервала, т. е. Δn/(n·Δυ).
днако,
отдельные молекулы даже в случае одного
типа газа имеют
разные
скорости. Разброс по скоростям может
быть весьма велик. Это отражено на
рисунке,
на котором по вертикали
отложена
доля от общего числа
молекул в единице объема Δn/n,
имеющих
скорости
в некотором интервале от υ
до
υ+
Δ
υ,
в
расчете на единицу
этого интервала, т. е. Δn/(n·Δυ).
Кривая
на рисунке имеет максимум, т. е. молекул
со скоростью
![]() больше всего (
больше всего (![]() –
наиболее
вероятная скорость). Видно,
что есть молекулы с υ,
близкими
к нулю, и есть молекулы с очень
большими υ.
Максвелл
теоретически вывел формулу для этой
функции
распределения
f(υ):
–
наиболее
вероятная скорость). Видно,
что есть молекулы с υ,
близкими
к нулю, и есть молекулы с очень
большими υ.
Максвелл
теоретически вывел формулу для этой
функции
распределения
f(υ):
![]() (13).
(13).
Для
нахождения положения максимума, т. е.
наиболее вероятной скорости
,
надо это выражение продифференцировать
и
приравнять производную нулю. Получится
![]() (14).
(14).
При повышении температуры кривая деформируется, смещается в сторону больших скоростей (более вероятны большие скорости). Это показано на рисунке пунктиром.
Распределение Больцмана
 Молекулы
газа, находящиеся в поле тяготения,
участвуют в тепловом движении и
испытывают действие силы тяжести. Это
приводит к стационарному состоянию,
при котором наблюдается уменьшение
концентрации n
и давления p
газа с возрастанием высоты над Землей.
Молекулы
газа, находящиеся в поле тяготения,
участвуют в тепловом движении и
испытывают действие силы тяжести. Это
приводит к стационарному состоянию,
при котором наблюдается уменьшение
концентрации n
и давления p
газа с возрастанием высоты над Землей.
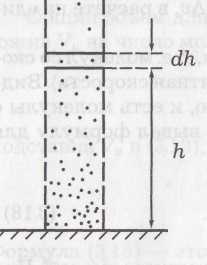
К этому выводу можно прийти путем таких рассуждений. На рисунке показан столб газа. На высоте h выделим слой толщиной dh. Слой dh давит своей тяжестью dm·g = ρ·S·dh·g на нижний слой. В результате давление (сила на единицу площади) над слоем будет на dp = ρ·g·dh меньше и связь между ρ и h будет такой: –dp= ρ·g·dh. Перед dp поставлен знак «минус», так как с увеличением h давление р не возрастает, а убывает, приращения dh и dp имеют разные знаки. Если заменим, использовав (8), dp на k·T·dn и ρ на m0·n, то получим:
![]() (15).
Вычислив
определенный интеграл от (15) ,
(15).
Вычислив
определенный интеграл от (15) ,
 (16)
получим выражение
(16)
получим выражение
![]() (17),
(17),
где εП – потенциальная энергия молекулы (в общем случае не только в поле силы тяжести). Оно справедливо, если Т с высотой не меняется, что не всегда так. Это очень важное не только для этого раздела выражение – формула Больцмана – распределение числа частиц по энергии.
1.10. Основы термодинамики
Термодинамика – учение о превращениях одного вида энергии в другой, о передаче энергии от тела к телу. Термодинамика изучает свойства макроскопических тел без рассмотрения их молекулярной структуры. Термодинамическая система (ТС) –макроскопические тела, которые могут обмениваться энергией как друг с другом, так и с внешней средой. Равновесное состояние ТС - состояние, при котором термодинамические параметры (давление, температура и объем) остаются постоянными сколь угодно долго при неизменных внешних условиях. Термодинамический процесс – изменение состояния ТС, характеризующееся изменением ее параметров. Состояние ТС характеризуют также внутренней энергией, которая равна сумме кинетических энергий беспорядочного движения всех молекул и потенциальных энергий взаимодействия молекул друг с другом.
Система тел называется изолированной, или замкнутой, если нет обмена работой или теплом с окружающей средой.
Первое начало термодинамики
Тела и системы могут обмениваться энергией друг с другом. Существует два вида обмена энергией. Это может быть работа, произведенная одним телом (системой) над другим телом (системой). Примером может служить перемещение тела или его частей под действием упругих, электрических или других сил.
Другой способ обмена энергией – путем передачи энергии неупорядоченного, хаотического движения молекул. Тогда говорят о передаче тепла. Например, передача энергии от нагретого тела к холодному происходит за счет передачи кинетической энергии хаотически движущихся молекул одного тела хаотическому движению молекул другого тела. В обоих этих случаях изменяется внутренняя энергия U.
Сказанное выше можно записать как: ΔU = Q +А’, где Q – энергия,
поступающая в систему при теплообмене, а А’– работа, совершаемая внешними
телами над системой. Исторически принято это соотношение записывать как:
Q = ΔU + А (18),
где А = – А’ – работа, совершаемая самой системой.
Это соотношение, представляющее собой закон сохранения энергии, получило название первого начала термодинамики: «Подведенное к телу количество теплоты идет на увеличение внутренней энергии тела и на работу, которую тело производит».
Очень важно отметить различие между величинами U с одной стороны, и А и Q – с другой. Внутренняя энергия U – это функция состояния системы. Если в состоянии 1 внутренняя энергия равна U1 , то что бы ни происходило с системой, какую бы работу она ни совершала, какие бы количества теплоты к ней ни подводились, если система вернулась в то же состояние 1 (т. е. процесс оказался круговым, совершен цикл), ее внутренняя энергия будет снова U1 (ΔU=0) .
В то же время Q и А – это только передаваемые телу или получаемые от тела порции энергии. Они связаны с передачей энергии, а не с каким-то запасом их в теле. Бессмысленно говорить о запасе работы в теле. И так же бессмысленно говорить о запасе теплоты в теле. Работа и теплота не являются функциями состояния тела.
Переходя к бесконечно малым порциям энергии, запишем первое начало в дифференциальной форме : δQ = dU + δA. (19).
Здесь специально даны разные обозначения бесконечно малых («d...» и «δ…»), чтобы отразить то обстоятельство, что U – функция состояния, a Q и А – нет.
Работа расширения идеального газа при различных процессах
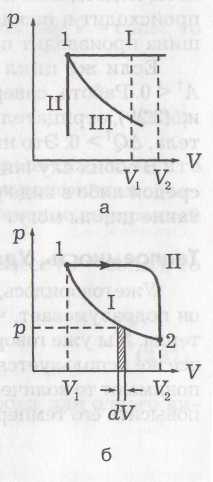
На рисунке а приведена зависимость давления газа от его объема. Точка 1 означает состояние газа, так как указывает его давление и объем в данный момент. Температуру при этом можно найти из (4). Линии означают процессы, так как показывают, через какие состояния система переходит из одного состояния в другое. Процесс может быть без изменения давления (прямая I на рисунке а). Такой процесс называется изобарическим. Изохорический процесс (прямая II) – это процесс без изменения объема. Процесс без изменения температуры (изотермический) будет примерно таким, как показано кривой III. Это гипербола, так как при Т = const давление обратно пропорционально объему: p~1/V (см. уравнение (4)).
δA = F·dx = p·S·dx = p·dV (20).
Если
F
изменяется,
то:
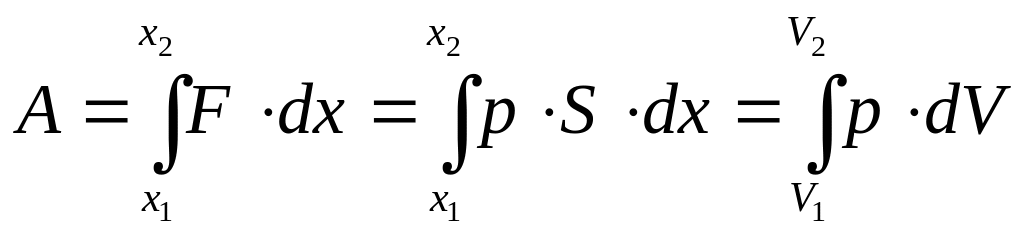 (21).
(21).
На
рисунке б
p·dV
–
это площадь полоски, a
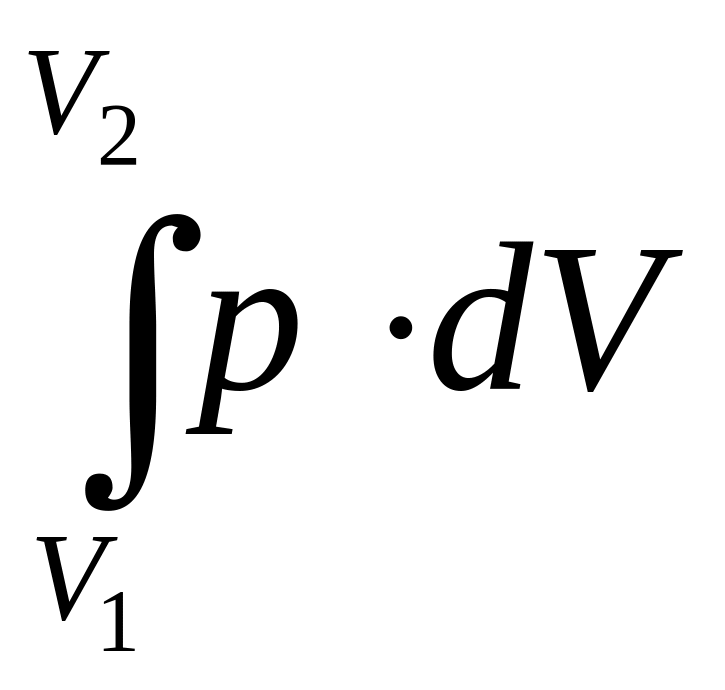 –
это
сумма площадей
всех
полосок от V1
до V2.
To
есть работа газа измеряется
площадью под кривой на диаграмме p–V.
Видно,
что работа
зависит от процесса, т. е. от того,
происходит ли расширение
газа по кривой I
или по кривой II
(видно, что
на
рис. б
под кривой II
площадь больше, чем под
кривой I).
–
это
сумма площадей
всех
полосок от V1
до V2.
To
есть работа газа измеряется
площадью под кривой на диаграмме p–V.
Видно,
что работа
зависит от процесса, т. е. от того,
происходит ли расширение
газа по кривой I
или по кривой II
(видно, что
на
рис. б
под кривой II
площадь больше, чем под
кривой I).
При изобарическом процессе ( рис. а, кривая I) работа газа:
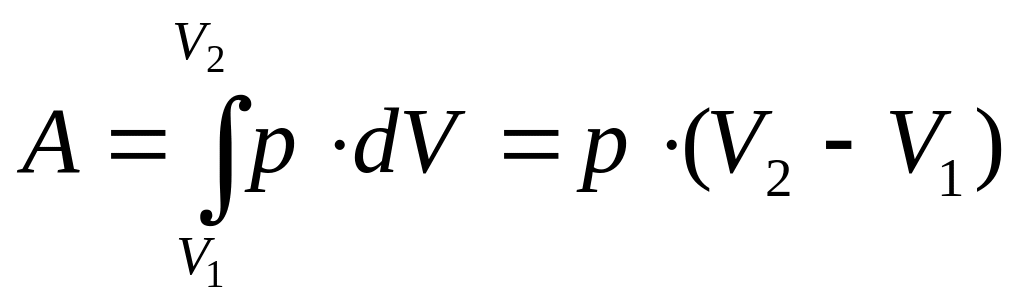 (22).
(22).
При изохорическом процессе ( рис. а, кривая II) объем не меняется, т. е. dV = 0 и, следовательно, А = 0. При изотермическом процессе меняются и р, и V ( рис. б). Заменив давление через объем и температуру согласно уравнению Клапейрона (4), получим работу газа при T=const :
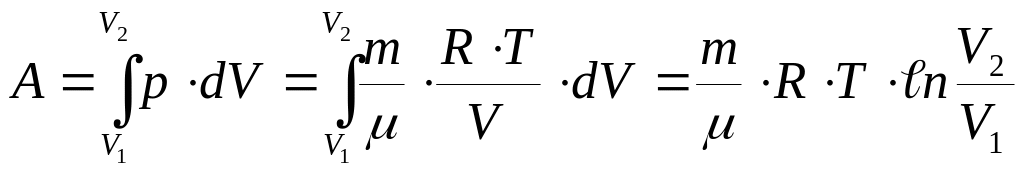 (23).
(23).
Проведем процесс расширения газа из состояния 1 (рис. б) в состояние 2 по кривой II, а сжатие обратно в состояние 1 – по кривой I. Процесс с возвращением в ту же точку называется циклом. Тогда общая работа будет равна разности площадей под кривыми II и I, т. е. площади цикла.
Если цикл на диаграммах p–V совершается по часовой стрелке (см. рис. б), то работа при расширении больше, чем при сжатии и полная работа А > 0. Поскольку мы возвращаемся в ту же точку, ΔU = 0. Из (18) следует, что при таком процессе и теплота, подводимая к телу, должна быть больше нуля (Q > 0). Так происходит в тепловой машине, когда тепло подводится, а машина производит положительную работу.
Если же цикл совершается против часовой стрелки, то А < 0. Соответственно и Q < 0, т. е. энергия не подводится к телу, а отводится от него. Это имеет место в холодильнике.
В обоих случаях происходит обмен энергией с окружающей средой либо в виде работы, либо в виде обмена теплотой.
Теплоемкость. Молярная теплоемкость газа. Степени свободы.
Под теплоемкостью С понимают то количество тепла, которое надо сообщить телу, чтобы повысить его температуру на один градус Кельвина:
![]() (
Дж/К
) (24)
(
Дж/К
) (24)
Если
передается энергия теплоты не всему
телу, а одному килограмму,
то говорят об удельной
теплоемкости
с =
С/m
(
Дж/(кг·К)). Если речь идет об одном моле,
то говорят
о
молярной
теплоемкости
![]() ,
измеряемой в Дж/(моль·К). О ней мы и будем
говорить далее.
,
измеряемой в Дж/(моль·К). О ней мы и будем
говорить далее.
Поскольку при переходе тела из одного состояния в другое δQ зависит от процесса, по которому производится этот переход, теплоемкость тоже зависит от процесса. Если процесс изохорический (V = const), то теплоемкость обозначается СV. Если процесс изобарический, то – Ср. При изотермическом процессе dT = 0, a δQ не равно нулю и соответствующая теплоемкость устремляется к бесконечности СТ → ∞.
Определим СV (теплоемкость 1 моля при постоянном объеме), использовав первое начало термодинамики в дифференциальной форме (19).
Поскольку V = const, то dV = 0 и δA = 0 и для СV получаем:
![]() (25)
.
(25)
.
Значок вне скобок указывает на тип процесса, т. е. что V = const. Соотношение (25) означает, что при постоянном объеме все подводимое тепло идет только на изменение внутренней энергии U.
При изобарическом процессе (р = const), для теплоемкости Ср получаем:
![]() (26).
(26).
Найдем (dV/dT)p из уравнения Клапейрона (4):
![]() (27)
(27)
и
подставив в (26), получим уравнение
Майера:
![]() (28).
(28).
Cp больше, чем СV , так как подведенная теплота идет не только на увеличение внутренней энергии, но и на работу по расширению газа.
Определим
dU/dT,
так
как эта производная входит
в (25) и (26). Для идеального газа внутренняя
энергия равна сумме средних кинетических
энергий всех N
молекул :
![]() (29).
Тогда
(29).
Тогда
![]() и
и
![]() ;
;
![]() (30). В выражении для
(30). В выражении для
![]() принимается
во внимание только кинетическая
энергия поступательного движения в
трехмерном пространстве.
Число независимых координат, необходимых,
чтобы
полностью определить положение тела
в
пространстве, называется числом
степеней свободы
i.
Таким
образом, на каждую степень свободы
приходится энергия по (1/2)kТ.
Будем
считать атомы, из которых состоит
молекула,
материальными точками, тогда одноатомная
молекула имеет
три степени
свободы поступательного движения i
=
3.
принимается
во внимание только кинетическая
энергия поступательного движения в
трехмерном пространстве.
Число независимых координат, необходимых,
чтобы
полностью определить положение тела
в
пространстве, называется числом
степеней свободы
i.
Таким
образом, на каждую степень свободы
приходится энергия по (1/2)kТ.
Будем
считать атомы, из которых состоит
молекула,
материальными точками, тогда одноатомная
молекула имеет
три степени
свободы поступательного движения i
=
3.
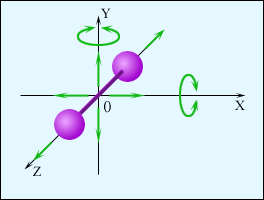 Если
молекула двухатомная
(рис.), то, кроме поступательного
движения, она может еще вращаться вокруг
осей
x
и
y.
Если
молекула двухатомная
(рис.), то, кроме поступательного
движения, она может еще вращаться вокруг
осей
x
и
y.
Вращение вокруг оси z не дает вклада в энергию, так как энергия вращательного движения равна J·ω2/2 = m·r2·ω2/2, а двухатомная молекула не имеет пространственной протяженности вдоль осей x и y.
Надо не только задать три координаты, чтобы определить положение центра масс молекулы в пространстве, но и задать еще две (вращательные) координаты, чтобы определить ее ориентацию в пространстве. Т.о., число степеней свободы для двухатомной молекулы i = 5.
Для трех- и более атомной молекулы вклад в энергию даст и вращение вокруг оси z . Для них i = 6 .
Молекулы мы считали жесткими; колебательные степени свободы не учитывались. Если их учесть, результат будет немного иной, но колебательные степени свободы становятся существенными только при высоких температурах.
Итак,
для жестких молекул внутренняя энергия
и молярные теплоемкости равны:
![]() ;
;
![]() (31).
(31).
Все это сильно упрощенные рассуждения, непригодные, например, при очень низких или высоких температурах. Более последовательная теория теплоемкости строится на основе квантовой механики.
Адиабатический процесс
Процесс без обмена теплотой с окружающей средой называется адиабатическим. Он может происходить, если газ (или другое тело) окружен абсолютно не проводящей тепло оболочкой или процесс происходит очень быстро, так что газ не успевает обменяться теплом с другими телами.
При таких процессах первое начало термодинамики упрощается:
δQ = 0; dU = – δА. (32) .
Это означает, что если над газом производить работу (δА < 0), то dU > 0. Внутренняя энергия газа возрастает, он нагревается. Если же газ расширяется, то он сам производит работу δА > 0 за счет собственной внутренней энергии (так как тепло не подводится) и dU < 0. В результате он охлаждается.
Согласно (25), : dU =ν ·CV · dT. Для δА используем соотношение (20). Тогда (32) для адиабатического процесса можно записать так:
![]() (33).
(33).
Подставим сюда р из уравнения Клапейрона-Менделеева (4) и получим:
![]() ;
;
![]() (34) .
(34) .
Проинтегрируем
последнее выражение для пределов
изменения переменных от T1
до T2
и от V1
до
V2
и введя обозначение
![]() (35) . получим:
(35) . получим:
![]() (36),
(36),
а
используя Т
= p·V/(ν·R)
,
получаем
![]() (37).
(37).
С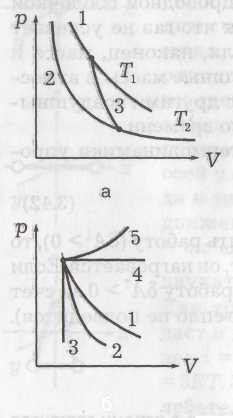 оотношения
(36-37) носят название уравнений
Пуассона или адиабаты.
γ – показатель
адиабаты.
оотношения
(36-37) носят название уравнений
Пуассона или адиабаты.
γ – показатель
адиабаты.
Поскольку γ > 1, давление обратно пропорционально не V, как было при изотермическом процессе, а Vγ, т, е. давление убывает с увеличением объема быстрее. На рисунке a кривые 1 и 2 – изотермы (Т2 < T1), а кривая 3 – адиабата.
При любых других процессах (неизотермических и неадиабатических) всегда можно связь между р и V написать в виде (37), но γ уже не будет равна Ср/СV .
В этих случаях процесс называется политропическим, а γ – показателем политропы.
Можно сказать, что для изотермического (T=const) процесса γ = 1, для изобарического (р = const) γ = 0, для изохорического (V = const) γ = ∞. На рисунке б показаны различные процессы расширения газа: 1 – изотерма, 2 – адиабата, 3 – изохора, 4 – изобара, 5 – политропа. Процессы 2, 3 идут с охлаждением, а 4, 5 – с нагреванием газа.
Круговые процессы (циклы). Цикл Карно
Газ, получая тепло и расширяясь, производит работу. Для непрерывного получения работы нужно, чтобы рабочее тело все время возвращалось в исходное состояние и снова повторялся тот же процесс, т. е. чтобы процесс был круговым, циклическим. При этом какую-то работу надо совершать над газом, сжимая его и возвращая в исходное состояние. Для того, чтобы тепловая машина совершала положительную работу необходимо, чтобы расширение газа происходило при более высоком давлении, чем при сжатии. Это возможно, если при расширении в систему будет поступать энергия Q1 извне, например, от нагревателя , а при сжатии энергия Q2 должна быть отдана внешней среде – холодильнику.
После
совершения цикла мы возвращаемся в
исходное состояние
с той же внутренней энергией. Следовательно,
ΔU
= 0, а подведенное
тепло Q1,
за вычетом отдаваемого холодильнику
Q2,
переходит в полезную работу A=
Q1
–
Q2
.
Для оценки эффективности работы вводят
коэффициент
полезного действия (кпд) тепловой
машины:
![]() (38) .
(38) .
Работа машины тем эффективнее, чем больше можно получить от нее работы A и чем меньше надо подводить тепла от нагревателя Q1.
Простейшим является цикл Карно, состоящий из двух изотерм и двух адиабат. Газ расширяется из точки 1 (рис. ) в точку 2 по изотерме при температуре Т1 . При этом в уравнении (19) ΔU = 0, работа расширения газа A > 0, т.е., к газу должна подводиться энергия от нагревателя Q1 > 0.
П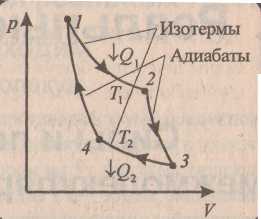 ри
расширении по адиабате из точки 2 в
точку 3 обмен теплотой
равен нулю и работа расширения
А
производится
за счет изменения
внутренней энергии ΔU
(газ охлаждается).
Далее, внешние силы сжимают газ по
изотерме 3 → 4 при температуре
Т2.
Здесь
опять ΔU
=
0, и из (19) следует,
что
А
<
0, Q2
<
0. Чтобы произвести изотермическое
сжатие, надо отводить
тепло, отдавать его более холодному
телу –
холодильнику. Далее
внешние силы сжимают
газ по адиабате 4 → 1, возвращая газ в
первоначальное состояние.
ри
расширении по адиабате из точки 2 в
точку 3 обмен теплотой
равен нулю и работа расширения
А
производится
за счет изменения
внутренней энергии ΔU
(газ охлаждается).
Далее, внешние силы сжимают газ по
изотерме 3 → 4 при температуре
Т2.
Здесь
опять ΔU
=
0, и из (19) следует,
что
А
<
0, Q2
<
0. Чтобы произвести изотермическое
сжатие, надо отводить
тепло, отдавать его более холодному
телу –
холодильнику. Далее
внешние силы сжимают
газ по адиабате 4 → 1, возвращая газ в
первоначальное состояние.
Пользуясь
формулами (23), (36) и (38), можно получить
для
рассматриваемого цикла Карно :
![]() (39).
(39).
Из (39) следует, что кпд η тем больше, чем выше температура нагревателя Т1 и чем ниже температура холодильника Т2 .
Необратимые процессы
 Рассмотрим
процесс расширения газа. Пусть имеется
сосуд с перегородкой (рис. а)
в левой части
которого есть газ, а в правой – нет.
Уберем перегородку.
Газ расширится и займет обе части. Если
молекулы друг с другом не взаимодействуют
(идеальный
газ), то общая внутренняя энергия при
таком
процессе не изменится (UI
=UII).
Однако состояние
II
отличается от состояния I
тем, что тело из состояния II
самопроизвольно, без вмешательства
извне не вернется в состояние I.
Если молекул мало,
например 2 или 3, то, двигаясь хаотически,
случайно,
они все могут в какой-то момент оказаться
в левой части, но если молекул много,
то это крайне
маловероятно.
Поэтому процесс расширения газа в
пустоту
называют необратимым.
Рассмотрим
процесс расширения газа. Пусть имеется
сосуд с перегородкой (рис. а)
в левой части
которого есть газ, а в правой – нет.
Уберем перегородку.
Газ расширится и займет обе части. Если
молекулы друг с другом не взаимодействуют
(идеальный
газ), то общая внутренняя энергия при
таком
процессе не изменится (UI
=UII).
Однако состояние
II
отличается от состояния I
тем, что тело из состояния II
самопроизвольно, без вмешательства
извне не вернется в состояние I.
Если молекул мало,
например 2 или 3, то, двигаясь хаотически,
случайно,
они все могут в какой-то момент оказаться
в левой части, но если молекул много,
то это крайне
маловероятно.
Поэтому процесс расширения газа в
пустоту
называют необратимым.
Другой пример: пусть газ находится и слева и справа от перегородки, но температура слева выше, чем температура справа (рис. б). Пусть перегородка теплопроводна. Молекулы обмениваются с ней кинетической энергией, и постепенно температуры обеих частей выравниваются. Такой процесс передачи тепла всегда необратим. Самопроизвольно средняя кинетическая энергия молекул (т. е. температура) слева сама не поднимется за счет кинетической энергии молекул справа.
Любой процесс, сопровождающийся трением, также необратим, так как при этом энергия упорядоченного движения переходит в энергию беспорядочного движения молекул, т. е. в теплоту.
Энтропия
Пусть с рабочим веществом совершаются циклы, при каждом из которых подводится от нагревателя Q1 , отдается холодильнику Q2 и производится работа
А = Q1 – Q2 . Из (38) и (39) можно получить:
![]() (40).
(40).
Величина
Qi
/Ti
называется
приведенной теплотой. Обозначим ее
ΔSi
. Из
(40) следует, что сумма приведенных теплот
при циклическом процессе равна нулю.
Это означает,
что, какой бы циклический процесс мы
ни совершали, если
мы вернулись в исходное состояние,
некоторая величина S
не
меняется (ΔS
= 0).
Следовательно, S
–
функция
состояния.
Она
получила название энтропии.
Таким
образом, состояние определяется не
только внутренней энергией U,
но и энтропией S.
Если
процесс не циклический и тело переходит
из состояния 1
в
другое состояние 2, то![]() .
Когда тело получает теплоту (Q
>
0), его энтропия возрастает, когда теряет
(Q
<
0) –
энтропия
уменьшается. При адиабатическом процессе
(Q
=
0) ΔS
= 0
и S=const,
поэтому адиабатический процесс называют
еще изоэнтропийным.
.
Когда тело получает теплоту (Q
>
0), его энтропия возрастает, когда теряет
(Q
<
0) –
энтропия
уменьшается. При адиабатическом процессе
(Q
=
0) ΔS
= 0
и S=const,
поэтому адиабатический процесс называют
еще изоэнтропийным.
Рассмотрим
теплопередачу при контакте двух тел
при температурах
Т1
и Т2
(Т1
>
Т2)
в теплоизолированной системе. Теплота
Q,
передаваемая
телом 1, равна теплоте
Q,
полученной телом 2.
Однако,
тело 1 отдает ее при температуре
Т1
и
![]() ,
а тело 2 получает ее при температуре Т2
и
,
а тело 2 получает ее при температуре Т2
и
![]() Так как Т1
>
T2
, следовательно, │ΔS2│>│ΔS1│,
так
что в целом при таком процессе энтропия
возрастает.
Т.о.,
при
необратимых процессах энтропия
увеличивается.
Так как Т1
>
T2
, следовательно, │ΔS2│>│ΔS1│,
так
что в целом при таком процессе энтропия
возрастает.
Т.о.,
при
необратимых процессах энтропия
увеличивается.
В тепловой машине часть теплоты, взятой от нагревателя, преобразуется в работу, а другая часть должна быть передана холодильнику. Нагреватель охлаждается, а холодильник нагревается.
С
одной стороны, мы знаем, что при этом
энтропия возрастает.
С другой стороны, к.п.д. такой тепловой
машины будет
постепенно
падать, так как
![]() и при Т1
→
T2
к.п.д. η → 0.
Общая
энергия системы, включающей нагреватель,
холодильник, рабочее
вещество и тело, над которым производится
работа, остается неизменной, но
работы получается все меньше и меньше.
В
пределе, когда Т1
=
T2
,
теплота от нагревателя не может быть
использована
вовсе. Тогда внутренняя энергия
нагревателя становится
бесполезной. Таким образом, возрастание
энтропии соответствует обесцениванию
энергии.
и при Т1
→
T2
к.п.д. η → 0.
Общая
энергия системы, включающей нагреватель,
холодильник, рабочее
вещество и тело, над которым производится
работа, остается неизменной, но
работы получается все меньше и меньше.
В
пределе, когда Т1
=
T2
,
теплота от нагревателя не может быть
использована
вовсе. Тогда внутренняя энергия
нагревателя становится
бесполезной. Таким образом, возрастание
энтропии соответствует обесцениванию
энергии.
Энтропию можно связать со степенью упорядоченности системы. Увеличение энтропии соответствует увеличению беспорядка. Энтропия – это мера беспорядка. В наших примерах (рис.) система переходила из менее вероятного, упорядоченного, неравновесного состояния в более вероятное, неупорядоченное, равновесное .
Вычислим изменение энтропии для идеального газа, исходя из дифференциальных выражений для изменения энтропии и I начала термодинамики:
dS=δQ
/ T
;
![]() (41)
(41)
Учитывая,
согласно уравнению Клапейрона , что
![]() ,
и подставив p
в δQ,
а
δQ
в выражение для dS,
получим :
,
и подставив p
в δQ,
а
δQ
в выражение для dS,
получим :
![]() ,
которое после интегрирования определяет
изменение
энтропии идеального газа при
переходе от состояния 1 с Т1
и V1
к
состоянию 2 с Т2
и V2
:
,
которое после интегрирования определяет
изменение
энтропии идеального газа при
переходе от состояния 1 с Т1
и V1
к
состоянию 2 с Т2
и V2
:
![]() (42).
(42).
Второе начало термодинамики
Первое начало термодинамики (19, 41), т. е. закон сохранения энергии, справедливо при любом процессе обмена энергией. Оно не указывает направление процесса, для него неважно, будет ли тепло передаваться от горячего тела к холодному или наоборот, будет ли газ самопроизвольно расширяться или сжиматься и т. д..
Однако из рассмотренного выше вытекает, что:
1. Любая система, выведенная из состояния равновесия и предоставленная самой себе, возвращается в равновесное состояние. Таковы, например, необратимые процессы переноса: вещества (диффузия), энергии (теплопроводность), импульса упорядоченного движения (внутреннее трение или вязкость).
2. Механическая работа может быть полностью превращена в теплоту, т. е. энергия упорядоченного движения может полностью перейти в энергию неупорядоченного движения. Однако, энергия неупорядоченного движения (теплота) может быть преобразована в энергию упорядоченного движения (работу) лишь частично. Невозможен процесс, единственным результатом которого было бы полное превращение теплоты в работу.
Коэффициент
такого преобразования (коэффициент
полезного
действия тепловой машины) не может быть
больше:
![]() .
.
3. Предоставленная самой себе система всегда переходит из менее вероятного в более вероятное состояние. Больцман получил соотношение, связывающее изменение энтропии при необратимых процессах с термодинамическими вероятностями (числом способов реализации того или иного состояния) начального W1 и конечного W2 состояний : ΔS=k·ℓn(W2/W1) . Из этого соотношения вытекает, что процессы с уменьшением энтропии не невозможны, а настолько маловероятны, что практически никогда не реализуются.
Используя понятие энтропии, можно сформулировать еще одно равносильное утверждение: «В замкнутой, изолированной системе (системе с постоянной энергией) при любых процессах энтропия не может убывать , т.е. ΔS≥0 ».
Все эти формулировки эквивалентны. Все они указывают направление процессов в изолированной или что то же самое в предоставленной самой себе системе. Это и есть второе начало термодинамики – важнейший закон природы.
Не следует думать, что этот закон вообще запрещает передачу тепла от холодного тела к нагретому. Это возможно, но только в незамкнутой (открытой) системе. Например, это осуществляется в холодильнике. Можно также уменьшить энтропию системы, например поршнем сжать газ и снова собрать его в одной половине сосуда . Можно увеличить порядок в системе (т. е. уменьшить энтропию), но для этого необходимо вмешательство внешних сил.
ФИЗИКА. Часть 2.
