
- •Физическая химия. Спец. 320700. Тест № 2
- •Физическая химия. Спец. 320700. Тест № 3
- •Физическая химия. Спец. 320700. Тест № 4
- •Физическая химия. Спец. 320700. Тест № 5
- •Физическая химия. Спец. 320700. Тест № 6
- •Физическая химия. Спец. 320700. Тест № 7
- •Физическая химия. Спец. 320700. Тест № 8
- •Физическая химия. Спец. 320700. Тест № 9
- •Физическая химия. Спец. 320700. Тест № 9
- •Физическая химия. Спец. 320700. Тест № 10
- •Физическая химия. Спец. 320700. Тест № 11
- •Физическая химия. Спец. 320700. Тест № 12
- •Физическая химия. Спец. 320700. Тест № 13
- •Физическая химия. Спец. 320700. Тест № 14
- •Физическая химия. Спец. 320700. Тест № 15
- •Физическая химия. Спец. 320700. Тест № 16
- •Физическая химия. Спец. 320700. Тест № 17
- •Физическая химия. Спец. 320700. Тест № 18
- •Физическая химия. Спец. 320700. Тест № 19
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
КАМСКИЙ ГОСУДАРСТВЕННЫЙ ПОЛИТЕХНИЧЕСКИЙ ИНСТИТУТ
ТЕСТОВЫЕ МАТЕРИАЛЫ ДЛЯ ИТОГОВОГО КОНТРОЛЯ ЗНАНИЙ СТУДЕНТОВ
специальности 320700
«Охрана окружающей среды и рациональное использование природных ресурсов»
(дневное отделение)
Кафедра Химии и Экологии
Дисциплина: ФИЗИЧЕСКАЯ ХИМИЯ
2004 г
ФИЗИЧЕСКАЯ ХИМИЯ. Спец. 320700. ТЕСТ № 1
1. Уравнение со вторым вириальным коэффициентом состояния реального газа:
1![]()
![]()
![]() )
2)
3)
)
2)
3)
4) рV = RT 5) р1V1 = р2V2
2. Экстенсивными (не зависящими от количества вещества) являются свойства: 1)плотность, температура 2)объем, давление 3)внутренняя энергия, объем 4)масса, температура 5)давление, плотность
3. Критерием вероятного протекания самопроизвольного процесса при Р,Т = Сonst является: 1)G<0 2) G>0 3)U<0 4)F<0 5)H<0
4. Химический потенциал компонента i реальной газовой смеси равен (fi - фугитивность, pi - давление, сi - концентрация, Vi - объем, mi - масса компонента) :
1) i = i + RTln fi 2) i = i + RTlnpi 3) i = i + RTlnсi
4) i = i + RTlnVi 5) i = i + RTlnmi
5. Состояние равновесия в гомогенной химической реакции с участием реальных газов
aА + bB сС + dD
характеризуется константой химического равновесия:
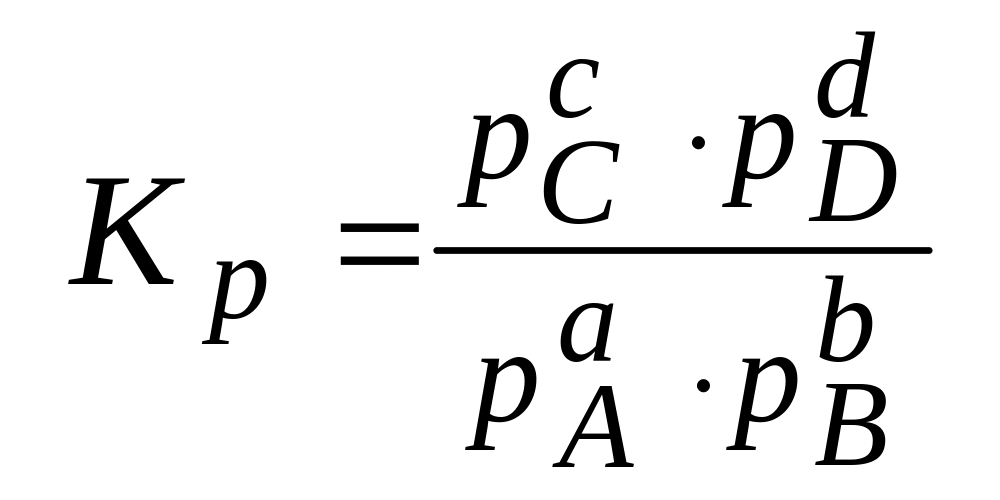


![]()
1) 2) 3) 4)
![]()
5)
6. Правило фаз Гиббса:
1) G = Н + Т(дG/дT)p 2) G = Н - ТS 3) F = U - ТS
4)
![]() 5)
C = K – Ф
+ n
5)
C = K – Ф
+ n
7. Электропроводность раствора электролита измеряется методом:
1) потенциометрии 2)фотометрии 3)хроматографии
4) кондуктометрии 5) полярографии
8. Уравнение изотермы адсорбции Лангмюра:
1)
![]() 2)
A = Amax
P1/n
,
3)
2)
A = Amax
P1/n
,
3)
![]() 4)
G
= s,
4)
G
= s,
5) s = nd
9. Стандартным электродным потенциалом называется:
1) потенциал электрода, погруженного в предельно разбавленный раствор электролита;
2) разность потенциалов катода и анода соответствующей электрохимической цепи;
3) сумма потенциалов катода и анода соответствующей электрохимической цепи;
4) потенциал электрода, погруженного в раствор электролита с активностью ионов, участвующих в электродном процессе, равной единице;
5) потенциал электрода при равенстве концентраций ионов в растворах анода и катода.
10. Для реакции 1-ого порядка основной кинетический закон в дифференциальной форме имеет вид:
1) dx/dt = k(a-x) 2) dx/dt = k(a-x) 2 3) dx/dt = k(a-x)(b-x)
4) dx/dt = k(a-x) 3 5) kt =ln a/(a-x)
Физическая химия. Спец. 320700. Тест № 2
1.Уравнение состояния идеального газа:
1 ) 2) 3)
4) рV = RT 5) р1V1 = р2V2
2. Интенсивными (зависящими от количества вещества) являются свойства:
1)объем, температура 2)объем, давление 3)внутренняя энергия, объем 4)масса, температура 5)давление, плотность
3. Критерием вероятного протекания самопроизвольного процесса при V, Т = Сonst является: 1)G<0 2) F>0 3)U<0 4)F<0 5)H<0
4. При условии постоянства естественных переменных Р и Т химический потенциал компонента смеси выражается через характеристическую функцию следующим образом:
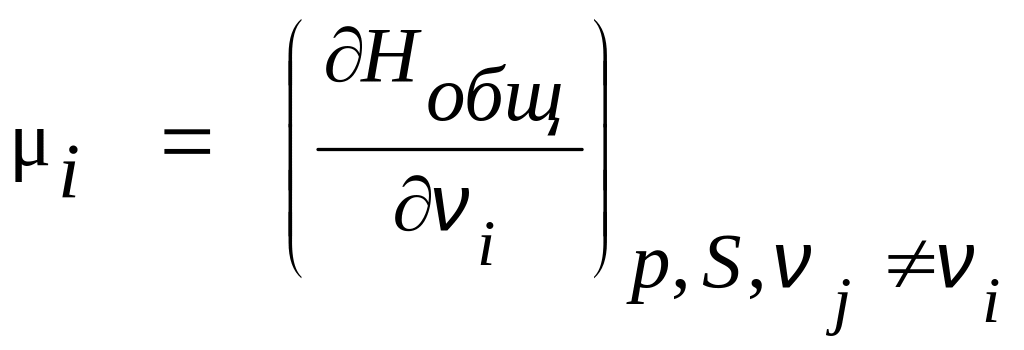
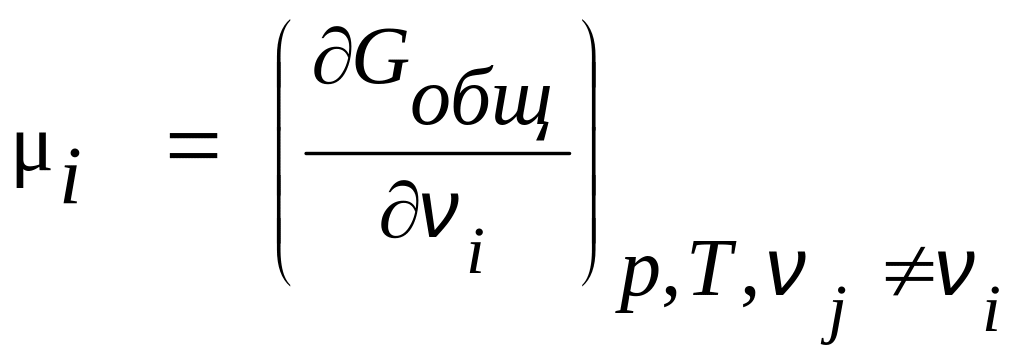
1) 2)
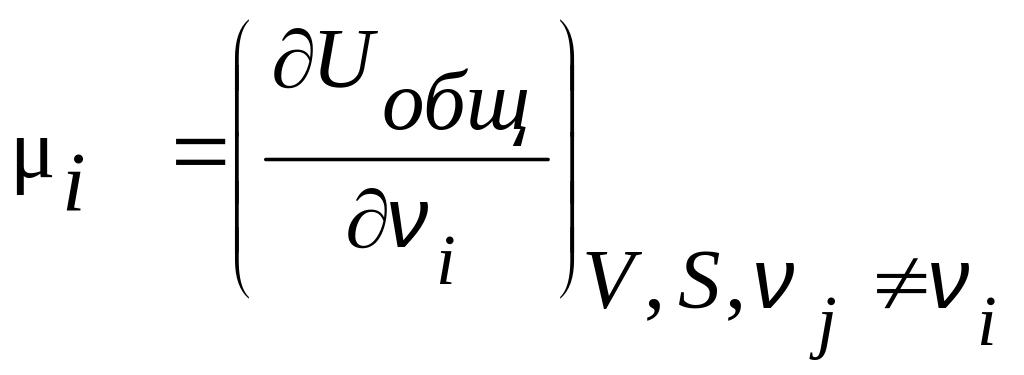
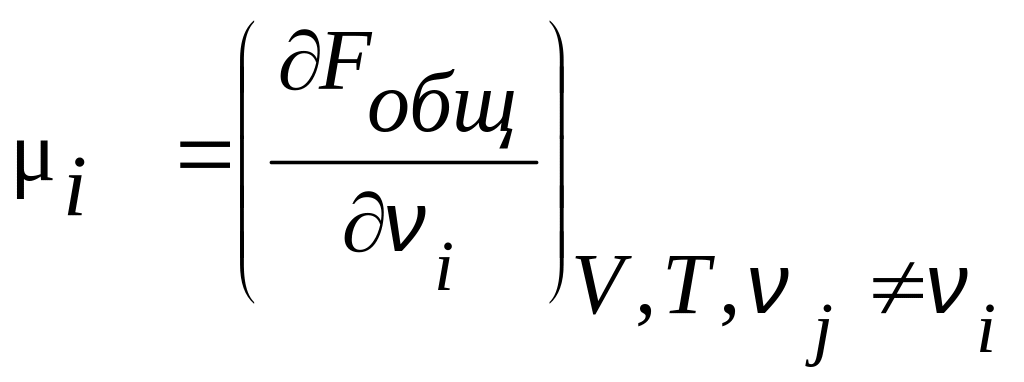
3) 4)
![]()
5)
5. Константы равновесия (с участием идеальных газов), выраженные через равновесные концентрации (сi) и равновесные мольные доли (i) компонентов, равны Кс = К, если
1) реакция протекает без изменения числа молей веществ: n = 0
2) c увеличением числа молей веществ: n > 0
3 )
c уменьшением числа молей
веществ: n
< 0
)
c уменьшением числа молей
веществ: n
< 0
4) c выделением теплоты
5) с поглощением теплоты
6. Для точки Д на диаграмме справедливо: Д
Одна жидкая фаза; число степеней свободы: с = 2
Две твердые фазы; число степеней свободы: с = 1
Две фазы – жидкая и твердая; с = 1
Две фазы – жидкая и твердая; с = 2
Две твердые фазы; число степеней свободы: с = 2
7. Удельной электрической проводимостью раствора электролита χ является:
1) электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по одному квадратному метру и расположенными на расстоянии одного метра друг от друга;
2) способность раствора электролита проводить электрический ток;
3) величина, обратная сопротивлению проводника;
4) электрическая проводимость 1 молярного раствора электролита;
5) электрическая проводимость 1 нормального раствора электролита.
8. Адсорбентом является:
вещество, которое поглощается из соседней или окружающей фазы;
вещество, на поверхности которого происходит адсорбция;
вещество, которое совершает работу, затраченную на увеличение единицы поверхности жидкости;
насыщенный пар над малыми каплями жидкости;
вещество, добавление которого приводит к увеличению поверхностного натяжения жидкости;
9. Электрохимический метод количественного определения содержания ионов в растворе называется:
1) кондуктометрия; 2) кулометрия; 3)ионометрия; 4)полярография;
5) вольтамперометрия.
10. Для реакции 2-ого порядка при условии равенства реагентов основной кинетический закон в дифференциальной форме имеет вид
1) dx/dt = k(a-x) 2) dx/dt = k(a-x) 2 3) dx/dt = k(a-x)(b-x)
4) dx/dt = k(a-x) 3 5) kt =ln a/(a-x)
