
- •Физическая химия. Спец. 320700. Тест № 2
- •Физическая химия. Спец. 320700. Тест № 3
- •Физическая химия. Спец. 320700. Тест № 4
- •Физическая химия. Спец. 320700. Тест № 5
- •Физическая химия. Спец. 320700. Тест № 6
- •Физическая химия. Спец. 320700. Тест № 7
- •Физическая химия. Спец. 320700. Тест № 8
- •Физическая химия. Спец. 320700. Тест № 9
- •Физическая химия. Спец. 320700. Тест № 9
- •Физическая химия. Спец. 320700. Тест № 10
- •Физическая химия. Спец. 320700. Тест № 11
- •Физическая химия. Спец. 320700. Тест № 12
- •Физическая химия. Спец. 320700. Тест № 13
- •Физическая химия. Спец. 320700. Тест № 14
- •Физическая химия. Спец. 320700. Тест № 15
- •Физическая химия. Спец. 320700. Тест № 16
- •Физическая химия. Спец. 320700. Тест № 17
- •Физическая химия. Спец. 320700. Тест № 18
- •Физическая химия. Спец. 320700. Тест № 19
Физическая химия. Спец. 320700. Тест № 5
1. Работа расширения идеального газа в вакуум равна:
1) А = 0 2) А = p(V2-V1) 3) А = nRT ln(V2/V1) 4) А = nRT ln(V2/V1)
5) А = Q - U
2. Изохорная теплоемкость определяется уравнением:
1![]()
![]()
![]() )
2) 3)
4) 5)
)
2) 3)
4) 5)
CV = CР = CР = CV = CV =
3. Зависимость энтальпии реакции от температуры выражается уравнением:
![]()
1![]() )
2)
)
2)
3) = 4) 5)
4. Критерием вероятного протекания самопроизвольного процесса в изолированной системе является:
1)S<0 2) S>0 3)U<0 4)G>0 5)H<0
5. Уравнение изотермы химической реакции при постоянстве давления и температуры:
1) = 2) = 3)
4) 5)

6. Для точки F на диаграмме справедливо:
Одна жидкая фаза; число степеней свободы: с = 2
Две фазы – жидкая и твердая; с = 1
Три фазы; число степеней свободы: с = 1
Три фазы; число степеней свободы: с = 0
Одна твердая фаза В; число степеней свободы: с = 1
7. Уравнение Вант-Гоффа для раствора электролитов:
1)
![]() 2) Р
= iСRT
3)Tзам
= iКm
4)Tкип
= iЕm
5) i
= i
+ RTlnсi
2) Р
= iСRT
3)Tзам
= iКm
4)Tкип
= iЕm
5) i
= i
+ RTlnсi
8. В газовой хроматографии подвижной и неподвижной фазами являются, соответственно:
1) газ и жидкая (или твердая) фаза; 2)жидкость и жидкость;
3)жидкость и твердое тело; 4) жидкость и газ;
5)твердое тело и газ.
9. Закон действующих масс для прямой химической реакции аА + bB cC + dD
в общем виде имеет вид
1) (t) = k[С]с[D]d 2) (t) = k[A]a[B]b
3) (t) = ([С]с[D]d)/([A]a[B]b) 4) (t) = ([A]a[B]b)/([ С]с[D]d)
5) (t) = k([A]a - [B]b)([B]b - [A]a)
10. Фотохимическими являются реакции:
1) протекающие под действием света; 2) воспроизводящие световые эффекты;
3) не реагирующие на действие света; 4) замедляющиеся под действием света
5) только реакции фотосинтеза в растениях.
Физическая химия. Спец. 320700. Тест № 6
1. Работа расширения идеального газа против постоянного внешнего давления p:
1) А = 0 2) А = p(V2-V1) 3) А = nRT ln(V2/V1) 4) А = FS
5) А = Q - U
2. Изменение энтальпии в химической реакции при стандартных условиях рассчитывают по уравнению
1) H298р-ции = H298(продукты) - H298(исх.реагенты)
2) H298р-ции = H298(исх.реагенты) - H298(продукты)
![]()
3)
4) H298р-ции = Hсгор.(продукты) - Hсгор.(исх.реагенты)
5) H298р-ции = H298(продукты) + H298(исх.реагенты)
3. Если энтальпия разложения твердого аддукта NH3SO2 равна 40 кДж/моль, то энтальпия его образования составляет:
1) 0 кДж/моль 2) - 40 кДж/моль 3) + 40 кДж/моль 4) – 20 кДж/моль
5) + 20 кДж/моль
4. Изменение энтропии вещества в результате нагревания при постоянном давлении (теплоемкость не зависит от температуры):
![]()
![]()
![]()
1) 2) 3)
![]()
![]()
4) 5)
5. Уравнение изобары химической реакции:
1) = 2) = 3)
4) 5)
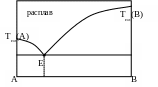
6. Для точки G на диаграмме справедливо:
Одна жидкая фаза; число степеней свободы: с = 2
Две фазы – жидкая и твердая; с = 1
Три фазы; число степеней свободы: с = 1
Т
G
ри фазы; число степеней свободы: с = 0Одна твердая фаза A; число степеней свободы: с = 1
7. Уравнение 1-ого закона Рауля (давление пара раствора) для раствора электролитов:
1) 2) Р = iСRT 3)Tзам = iКm 4)Tкип = iЕm 5) i = i + RTlnсi
8. Фазой вещества является:
1) его агрегатное состояние вещества;
2) состояние отличное от других состояний значением внутренней энергии;
3) однофазная часть системы, находящаяся в химическом равновесии с другими частями этой системы;
4) часть системы, отделенная от остальных поверхностью раздела;
5) гомогенная часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся в отсутствии внешнего поля сил одинаковыми химическими, физическими и термодинамическими свойствами во всех своих точках.
9. Уравнение Аррениуса описывается выражением:
1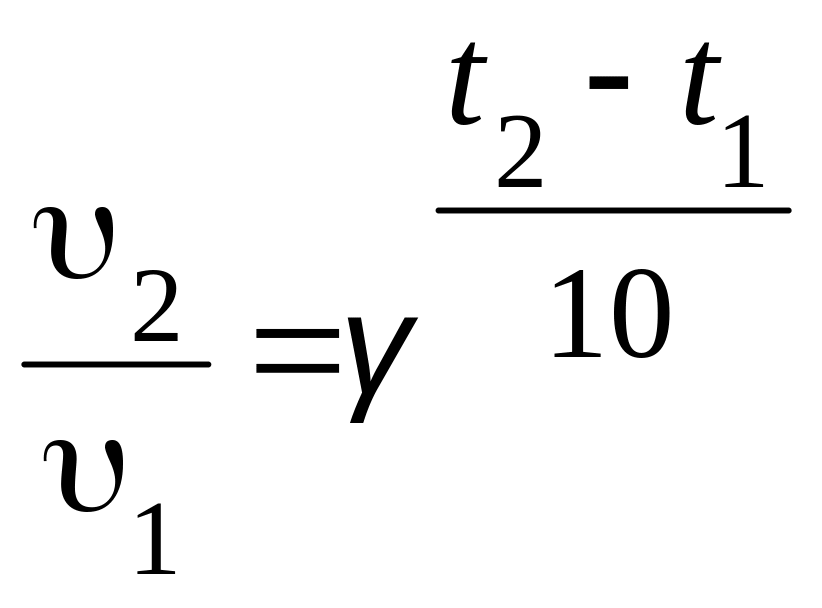 )
kt = ln
a/(a-x)
)
kt = ln
a/(a-x)
2) k = Aexp(Eакт /RT) 3)
4) k = Т1/2exp(Eакт/RT)
5) k = (kBT/h)exp(G /RT)
10. Гетерогенным является катализ, если:
катализатор и реагенты находятся в разных фазах и имеют границу раздела;
катализатор и реагенты находятся в одной фазе и не имеют границу раздела;
катализатор и реагенты находятся в однородной газовой смеси;
катализатор и реагенты находятся в однородной жидкой смеси;
реакция ускоряется с помощью ферментов.
