
- •Физическая химия. Спец. 320700. Тест № 2
- •Физическая химия. Спец. 320700. Тест № 3
- •Физическая химия. Спец. 320700. Тест № 4
- •Физическая химия. Спец. 320700. Тест № 5
- •Физическая химия. Спец. 320700. Тест № 6
- •Физическая химия. Спец. 320700. Тест № 7
- •Физическая химия. Спец. 320700. Тест № 8
- •Физическая химия. Спец. 320700. Тест № 9
- •Физическая химия. Спец. 320700. Тест № 9
- •Физическая химия. Спец. 320700. Тест № 10
- •Физическая химия. Спец. 320700. Тест № 11
- •Физическая химия. Спец. 320700. Тест № 12
- •Физическая химия. Спец. 320700. Тест № 13
- •Физическая химия. Спец. 320700. Тест № 14
- •Физическая химия. Спец. 320700. Тест № 15
- •Физическая химия. Спец. 320700. Тест № 16
- •Физическая химия. Спец. 320700. Тест № 17
- •Физическая химия. Спец. 320700. Тест № 18
- •Физическая химия. Спец. 320700. Тест № 19
Физическая химия. Спец. 320700. Тест № 3
1.Уравнение Ван-дер-Ваальса состояния реального газа:
1 ) 2) 3)
4) рV = RT 5) р1V1 = р2V2
2. При условии постоянства объема тепловой эффект равен:
1![]()
![]() )
2) 3) QТ
= A 4) Q = U
+ A 5) Q = 0
)
2) 3) QТ
= A 4) Q = U
+ A 5) Q = 0
3. Экзотермическому процессу отвечает неравенство:
1)G<0 2) S>0 3)U>0 4)H>0 5)H<0
4. При постоянстве естественных переменных Р и Т условием равновесия является:
1) dU = 0, d 2U > 0 2) dH = 0, d 2H > 0 3) dF = 0, d 2F > 0
4) dG = 0, d 2G > 0 5) dV = 0, d 2V > 0
5. Температурная зависимость термодинамической функции при постоянстве давления (Р = const) выражается:
1
)
G
= Н
+ Т(дG/дT)p
2) F
= U
+ Т(дF/дT)V
3) G
= RT(lnK
p
- lnK
p)
3) 4) G
= - RTlnK
p
5)
![]()
6. Для точки Д на диаграмме справедливо:
Одна жидкая фаза; число степеней свободы: с = 2
Две твердые фазы; число степеней свободы: с = 1
Две фазы – жидкая и твердая; с = 1
Две фазы – жидкая и твердая; с = 2 Д
Две твердые фазы; число степеней свободы: с = 2
7. Уравнение 1-ого закона Рауля для идеального раствора:
1)
![]() 2) Р
= СRT 3)Tзам
= Кm 4)Tкип
= Еm 5) i
= i
+ RTlnсi
2) Р
= СRT 3)Tзам
= Кm 4)Tкип
= Еm 5) i
= i
+ RTlnсi
8. Адсорбатом является:
вещество, которое поглощается из соседней или окружающей фазы;
вещество, на поверхности которого происходит адсорбция;
вещество, которое совершает работу, затраченную на увеличение единицы поверхности жидкости;
насыщенный пар над малыми каплями жидкости;
вещество, добавление которого приводит к увеличению поверхностного натяжения жидкости;
9. Зависимость Э.Д.С. гальванических элементов от температуры определяется выражением:
1![]()
![]() )
2) -Go
= nFEo
3)
)
2) -Go
= nFEo
3)
4![]() )
Е = к
-
А
Д 5)
)
Е = к
-
А
Д 5)
10. Для реакции 2-ого порядка с неравными концентрациями реагентов основной кинетический закон в дифференциальной форме имеет вид
1) dx/dt = k(a-x) 2) dx/dt = k(a-x) 2 3) dx/dt = k(a-x)(b-x)
4) dx/dt = k(a-x) 3 5) kt =ln a/(a-x)
Физическая химия. Спец. 320700. Тест № 4
1. Уравнение Каммерлинг-Оннеса состояния реального газа:
1 ) 2) 3)
4) рV = nRT 5) р1V1 = р2V2
2. Изобарная теплоемкость определяется уравнением:
1![]()
![]()
![]()
![]()
![]() )
2) 3)
4) 5)
)
2) 3)
4) 5)
CV = CР = CV = CР = CР =
3. Эндотермическому процессу отвечает неравенство:
1)G<0 2) S>0 3)U<0 4)H>0 5)H<0
4. При постоянстве естественных переменных V и Т условием равновесия является:
1) dU = 0, d 2U > 0 2) dH = 0, d 2H > 0 3) dF = 0, d 2F > 0
4) dG = 0, d 2G > 0 5) dP = 0, d 2P > 0
5. Уравнение изотермы химической реакции при постоянстве объема и температуры:
1)
![]() =
=
![]() 2)
2)
![]() =
=
![]() 3)
3)
![]()
4)
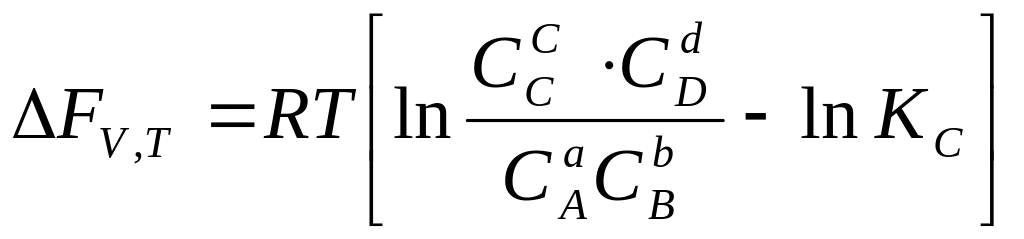 5)
5)
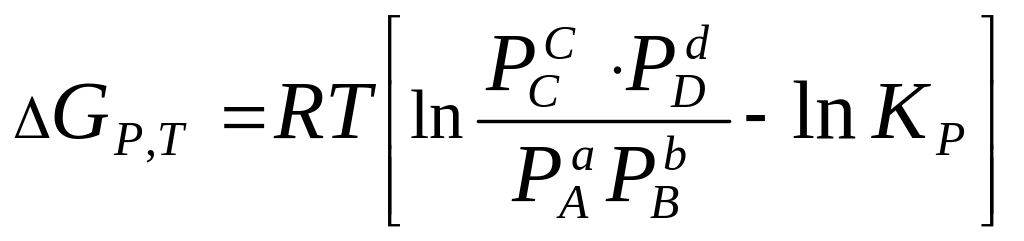
6. Для точки Д на диаграмме справедливо:
Одна жидкая фаза; число степеней свободы: с = 2
Две твердые фазы; число степеней свободы: с = 1
Две фазы – жидкая и твердая; с = 1
Две фазы – жидкая и твердая; с = 2
Две твердые фазы; число степеней свободы: с = 2 Д
7. Уравнение Вант-Гоффа для идеального раствора:
1) 2) Р = СRT 3)Tзам = Кm 4)Tкип = Еm 5) i = i + RTlnсi
8. ЭДС электрохимической цепи с учетом диффузионного потенциала будет:
1 ) 2) Е = к + А 3)
4) Е = к - А Д 5) Е = к - А
9. Метод анализа и разделения веществ, основанный на сорбции в динамических условиях, называется:
1) фотометрией 2) спектроскопией 3) полярографией
4) хроматографией 5) гравиметрией
10. Для реакции 1-ого порядка основной кинетический закон в интегральной форме имеет вид
1) kt = x/a(a-x) 2) kt = ½(a-x) 2 - 1/2a 2 3) kt = x
4) kt =[1/(a-b)]*ln[b(a-x)/a(b-x)] 5) kt =ln a/(a-x)
