
- •Химический анализ
- •Часть 1. Качественный анализ неорганических веществ
- •Введение
- •1. Качественный анализ неорганических веществ
- •1.1. Методы и условия проведения качественного химического анализа
- •Классификация методов анализа в зависимости от количества исследуемого вещества
- •Методы разделения и концентрирования
- •1.2. Качественные аналитические реакции и аналитические признаки
- •1.3. Реактивы, применяемые в качественном анализе
- •Органические реактивы, используемые в качественном анализе
- •1.4. Аналитическая классификация ионов в качественном анализе
- •Аналитическая классификация анионов
- •Контрольные вопросы
- •2. Кислотно-основная аналитическая классификация катионов
- •2.1. Первая аналитическая группа катионов
- •2.1.1. Реакции катиона лития
- •4. Реакция с гексанитрокобальтатом(III) натрия Na3[Co(no2)6]:
- •2.1.3. Реакции катиона натрия
- •2.1.4. Реакции катиона калия
- •2. Реакция с гидротартратом натрия NaHc4h4o6.
- •3. Реакция с гексанитрокобальтатом(III) натрия Na3[Co(no2)6].
- •4. Реакция с гексанитрокупратом(II) свинца и натрия Na2Pb[Cu(no2)6].
- •Сводная таблица реакций катионов первой аналитической группы
- •2.2. Вторая аналитическая группа катионов
- •2.2.1. Реакции катиона серебра
- •2.2.3. Реакции катиона свинца(II)
- •Сводная таблица реакций катионов второй аналитической группы
- •2.3. Третья аналитическая группа катионов
- •2.3.1. Реакции катиона бария
- •2.3.2. Реакции катиона кальция
- •2.3.3. Реакции катиона стронция
- •Сводная таблица реакций катионов третьей аналитической группы
- •2.4. Четвёртая аналитическая группа катионов
- •2.4.1. Реакции катиона алюминия
- •2.4.2. Реакции катиона хрома (III)
- •2.4.3. Реакции катиона цинка
- •2.4.4. Реакции катионов олова(II) и (IV)
- •Сводная таблица реакций катионов четвертой аналитической группы
- •2.5. Пятая аналитическая группа катионов
- •2.5.3. Реакции катиона марганца (II)
- •2.5.4. Реакции катиона магния
- •2.5.5. Реакции катиона висмута (III)
- •2. Реакция с 8-оксихинолином c9h6n(он).
- •2.5.6. Реакции катиона сурьмы (III)
- •1. Реакция с тиосульфатом натрия Na2s2o3.
- •2.5.7. Реакции катиона сурьмы(V)
- •Сводная таблица реакций катионов пятой аналитической группы
- •2.6. Шестая аналитическая группа катионов
- •2.6.1. Реакции катиона меди (II)
- •2.6.2. Реакции катиона никеля(II)
- •2.6.3. Реакции катиона кобальта(II)
- •2.6.5. Реакции катиона ртути(II)
- •Сводная таблица реакций катионов шестой аналитической группы
- •Контрольные вопросы к разделу 2.1
- •Контрольные вопросы к разделу 2.2
- •Контрольные вопросы к разделу 2.3
- •Контрольные вопросы к разделу 2.4
- •Контрольные вопросы к разделу 2.5
- •Контрольные вопросы к разделу 2.6
- •3. Аналитическая классификация анионов
- •3.1. Анионы первой аналитической группы
- •3.1.1. Реакции хлорид - иона
- •3.1.2. Реакции бромид-иона
- •3.1.3. Реакции иодид-иона
- •3. Реакция окисления нитритом натрия:
- •3.1.4. Реакции сульфид-иона
- •5. Реакция с гидроксокомплексом свинца [Pb(oh)4 ]2-:
- •Качественные реакции анионов первой аналитической группы
- •3.2. Анионы второй аналитической группы
- •3.2.2. Реакции сульфит-иона
- •3.2.3. Реакции карбонат-иона
- •3.2.4. Реакции фосфат-иона
- •3.2.5. Реакции тиосульфат-иона
- •3.2.6. Реакции силикат-иона
- •3.2.7. Реакции борат-иона
- •Качественные реакции анионов второй аналитической группы
- •3.3. Анионы третьей аналитической группы
- •3.3.1. Реакции нитрат-иона
- •3.3.2. Реакции нитрит-иона
- •2. Реакция с иодидом калия ki.
- •Качественные реакции анионов третьей аналитической группы
- •Контрольные вопросы к разделу 3.1
- •Контрольные вопросы к разделу 3.2
- •Контрольные вопросы к разделу 3.3
- •4. Качественный анализ неизвестного вещества
- •4.1. Предварительные испытания
- •Предварительные испытания неизвестного вещества
- •4.2. Анализ индивидуальной соли
- •4.3. Систематический анализ смеси катионов
- •4.3.2. Систематический ход анализа (один из вариантов).
- •6. Анализ раствора 4 (V группа). Аммиакат меди – синий, никеля – сине-голубой, кобальта – желтый.
- •Контрольные вопросы
- •Список литературы
- •Химический анализ
- •Часть 1. Качественный анализ неорганических веществ
Аналитическая классификация анионов
Аналитическая группа |
Анионы |
Групповой реагент |
Наблюдаемый эффект |
I |
SO42-,SO32-,CO32- PO4 3-, SiO3 2-, BO3 -, S2O3 2- |
BaCl2 |
Белые осадки, нерастворимые в воде
|
II |
Cl-, Br-, I-, S2- |
AgNO3 |
Осадки различных цветов, нерастворимые в воде и кислотах
|
III |
NO3-, NO2-, CH3COO- |
Нет группового реактива |
Соли Ва2+ и Ag+ растворимы в воде
|
Контрольные вопросы
1. Предмет изучения аналитической химии.
2. В чем состоит основная задача качественного анализа?
3. Назовите основные методы качественного анализа и требования к этим методам.
4. Что такое аналитическая реакция? Какие требования предъявляются к аналитическим реакциям?
5. Какие аналитические реакции называются общими, частными, селективными и специфическими?
6. Какие реактивы применяются в качественном анализе, и требования, предъявляемые к ним?
7. Что такое предел обнаружения?
8. Что такое дробный и систематический методы анализа?
9. Какие реакции лежат в основе кислотно-щелочного метода анализа катионов?
10. Аналитическая классификация ионов.
2. Кислотно-основная аналитическая классификация катионов
2.1. Первая аналитическая группа катионов
К первой аналитической группе относятся катионы щелочных металлов: калия K+, натрия Na+, лития Li+ и катион аммония NH4+. Большинство солей катионов первой аналитической группы представляют собой белые кристаллические вещества, хорошо растворимые в воде. Вследствие этого катионы данной группы не имеют группового реагента, и открывают их только с помощью частных реакций. Перед проведением частных реакций на катионы первой группы ионы других групп удаляют методом осаждения (например, в виде карбонатов в нейтральной или щелочной среде).
2.1.1. Реакции катиона лития
1. Окрашивание пламени. Летучие соединения лития окрашивают бесцветное пламя горелки в карминово-красный цвет. Реакция весьма чувствительна. Определению мешают ионы натрия. Желтую окраску ионов Na+ маскируют, используя индиговую призму или кобальтовое стекло, не пропускающее желтых лучей.
Методика проведения реакции. С помощью металлической петли из флакона берется небольшое количество соли и вносится в пламя спиртовки. Пламя окрашивается в карминово-красный цвет.
2. Реакция с фторидом аммония NH4F. При нагревании смеси растворов соли лития и фторида аммония выделяется белый аморфный осадок фторида лития, растворимый в уксусной кислоте.
Li+ + F- = LiF(тв).
Методика проведения реакции. В пробирку помещают 2-3 капли раствора, содержащего ионы лития, и 2-3 капли раствора фторида аммония или калия. Смесь нагревают до кипения, при этом медленно выделяется белый аморфный осадок. Определению мешают ионы Mg2+, которые можно замаскировать, проводя реакцию в присутствии аммиака при рН 9-10.
+++2.1.2. Реакции катиона аммония
1. Реакция со щелочами. При нагревании растворов солей аммония со щелочами образуется гидрат аммиака, который разлагается с выделением аммиака, имеющего характерный запах нашатырного спирта.
NH4+ + OH- ↔ NH3 Н2О ↔ NH3(г) + H2O.
Выделение аммиака можно зафиксировать с помощью лакмусовой или универсальной индикаторной бумаги, смоченной водой и внесенной в пары. При выделении аммиака лакмусовая бумага синеет.
Методика проведения реакции. В пробирку вносят 5 капель раствора, содержащего ионы аммония, и добавляют 5 капель щелочи. Пробирку слегка подогревают и к верхней части подносят влажную индикаторную бумагу. В присутствии ионов аммония индикаторная бумага синеет.
2. Реакция с гидротартратом натрия NaHC4H4O6. Образуется белый кристаллический осадок гидротартрата аммония, растворимый в кислотах и щелочах. Кристаллы имеют характерную форму.
NH4+ + HC4H4O6- = NH4HC4H4O6(тв).
Методика проведения реакции. На предметное стекло наносят капилляром 1-2 капли анализируемого раствора, рядом наносят 1-2 капли гидротартрата натрия. Капли соединяют стеклянной палочкой и перемешивают. Стекло охлаждают, и через несколько минут наблюдают в микроскоп форму образовавшихся кристаллов. Определению мешают ионы калия.
3. Реакция с реактивом Несслера (K2[HgI4]+KOH). Реактив Несслера (смесь тетраиодомеркурата(II) калия с гидроксидом калия) взаимодействует с ионом NH4+, образуя красно-бурый осадок иодида меркураммония [OHg2NH2]I, растворимый в кислотах и щелочах.
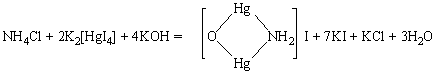
Методика проведения реакции. К одной капле раствора, содержащего ионы аммония, прибавляют 1 каплю реактива Несслера. Реакцию удобнее всего проводить на предметном стекле.
