
- •Химический анализ
- •Часть 1. Качественный анализ неорганических веществ
- •Введение
- •1. Качественный анализ неорганических веществ
- •1.1. Методы и условия проведения качественного химического анализа
- •Классификация методов анализа в зависимости от количества исследуемого вещества
- •Методы разделения и концентрирования
- •1.2. Качественные аналитические реакции и аналитические признаки
- •1.3. Реактивы, применяемые в качественном анализе
- •Органические реактивы, используемые в качественном анализе
- •1.4. Аналитическая классификация ионов в качественном анализе
- •Аналитическая классификация анионов
- •Контрольные вопросы
- •2. Кислотно-основная аналитическая классификация катионов
- •2.1. Первая аналитическая группа катионов
- •2.1.1. Реакции катиона лития
- •4. Реакция с гексанитрокобальтатом(III) натрия Na3[Co(no2)6]:
- •2.1.3. Реакции катиона натрия
- •2.1.4. Реакции катиона калия
- •2. Реакция с гидротартратом натрия NaHc4h4o6.
- •3. Реакция с гексанитрокобальтатом(III) натрия Na3[Co(no2)6].
- •4. Реакция с гексанитрокупратом(II) свинца и натрия Na2Pb[Cu(no2)6].
- •Сводная таблица реакций катионов первой аналитической группы
- •2.2. Вторая аналитическая группа катионов
- •2.2.1. Реакции катиона серебра
- •2.2.3. Реакции катиона свинца(II)
- •Сводная таблица реакций катионов второй аналитической группы
- •2.3. Третья аналитическая группа катионов
- •2.3.1. Реакции катиона бария
- •2.3.2. Реакции катиона кальция
- •2.3.3. Реакции катиона стронция
- •Сводная таблица реакций катионов третьей аналитической группы
- •2.4. Четвёртая аналитическая группа катионов
- •2.4.1. Реакции катиона алюминия
- •2.4.2. Реакции катиона хрома (III)
- •2.4.3. Реакции катиона цинка
- •2.4.4. Реакции катионов олова(II) и (IV)
- •Сводная таблица реакций катионов четвертой аналитической группы
- •2.5. Пятая аналитическая группа катионов
- •2.5.3. Реакции катиона марганца (II)
- •2.5.4. Реакции катиона магния
- •2.5.5. Реакции катиона висмута (III)
- •2. Реакция с 8-оксихинолином c9h6n(он).
- •2.5.6. Реакции катиона сурьмы (III)
- •1. Реакция с тиосульфатом натрия Na2s2o3.
- •2.5.7. Реакции катиона сурьмы(V)
- •Сводная таблица реакций катионов пятой аналитической группы
- •2.6. Шестая аналитическая группа катионов
- •2.6.1. Реакции катиона меди (II)
- •2.6.2. Реакции катиона никеля(II)
- •2.6.3. Реакции катиона кобальта(II)
- •2.6.5. Реакции катиона ртути(II)
- •Сводная таблица реакций катионов шестой аналитической группы
- •Контрольные вопросы к разделу 2.1
- •Контрольные вопросы к разделу 2.2
- •Контрольные вопросы к разделу 2.3
- •Контрольные вопросы к разделу 2.4
- •Контрольные вопросы к разделу 2.5
- •Контрольные вопросы к разделу 2.6
- •3. Аналитическая классификация анионов
- •3.1. Анионы первой аналитической группы
- •3.1.1. Реакции хлорид - иона
- •3.1.2. Реакции бромид-иона
- •3.1.3. Реакции иодид-иона
- •3. Реакция окисления нитритом натрия:
- •3.1.4. Реакции сульфид-иона
- •5. Реакция с гидроксокомплексом свинца [Pb(oh)4 ]2-:
- •Качественные реакции анионов первой аналитической группы
- •3.2. Анионы второй аналитической группы
- •3.2.2. Реакции сульфит-иона
- •3.2.3. Реакции карбонат-иона
- •3.2.4. Реакции фосфат-иона
- •3.2.5. Реакции тиосульфат-иона
- •3.2.6. Реакции силикат-иона
- •3.2.7. Реакции борат-иона
- •Качественные реакции анионов второй аналитической группы
- •3.3. Анионы третьей аналитической группы
- •3.3.1. Реакции нитрат-иона
- •3.3.2. Реакции нитрит-иона
- •2. Реакция с иодидом калия ki.
- •Качественные реакции анионов третьей аналитической группы
- •Контрольные вопросы к разделу 3.1
- •Контрольные вопросы к разделу 3.2
- •Контрольные вопросы к разделу 3.3
- •4. Качественный анализ неизвестного вещества
- •4.1. Предварительные испытания
- •Предварительные испытания неизвестного вещества
- •4.2. Анализ индивидуальной соли
- •4.3. Систематический анализ смеси катионов
- •4.3.2. Систематический ход анализа (один из вариантов).
- •6. Анализ раствора 4 (V группа). Аммиакат меди – синий, никеля – сине-голубой, кобальта – желтый.
- •Контрольные вопросы
- •Список литературы
- •Химический анализ
- •Часть 1. Качественный анализ неорганических веществ
2.2.3. Реакции катиона свинца(II)
+++1. Реакция с хроматом K2CrO4 или дихроматом K2Cr2O7 калия
2Pb2+ + Cr2O72- + 2CH3COO- + H2O ↔ 2PbCrO4(тв) + 2CH3COOH,
в результате которой образуется желтый осадок хромата свинца, нерастворимый в NH4ОН, в отличие от хромата серебра. Осадок хромата свинца растворим в растворе щелочи по реакции:
PbCrO4 (тв) + 4OH- ↔ [Pb(OH)4] 2- + CrO42-.
Методика проведения реакции. К 2-3 каплям раствора, содержащего ионы свинца, добавляют 2-3 капли раствора CH3COOH или CH3COONa и 2-3 капли K2Cr2O7. Образуется желтый осадок. Пробу центрифугируют, отделяют осадок от раствора и к осадку добавляют 3-5 капель 2 н. NaOH. Наблюдают растворение осадка. Мешают определению ионы: Ba2+, Sr2+, Bi(III), Hg2+, Ag+.
+++2. Реакция со щелочами.
Pb2+ + 2OH- ↔ Pb(OH)2 (тв).
Образуется белый осадок гидроксида свинца, растворимый в избытке реагента:
Pb(OH)2 (тв) + 2OH- = [Pb(OH)4]2-.
Методика проведения реакции. К 3 каплям раствора, содержащего ионы Pb2+, добавляют 3 капли раствора щелочи. После образования белого осадка добавляют еще несколько капель реагента и наблюдают растворение осадка.
3. Реакция с дитизоном (C6H5)2CSN4H2. В нейтральных и слабощелочных растворах дитизон реагирует с ионами свинца, образуя внутрикомплексное соединение красного цвета. Дитизонат свинца нерастворим в воде, но растворим в органических соединениях (CHCl3, CCl4):
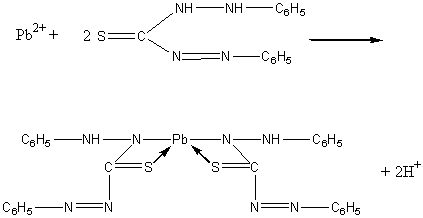 .
.
Проведению реакции мешают другие катионы, поэтому целесообразно отделить катионы свинца от других, используя хорошую растворимость в горячей воде хлорида свинца.
Методика проведения реакции. В пробирку помещают 2-3 капли исследуемого раствора, добавляют 2 н. раствора NH4OH, доводя рН до 8-10, и 2-3 капли дитизона в CCl4. Смесь сильно встряхивают в течение 30 с. В присутствии свинца зеленая окраска реагента переходит в красную.
Некоторые реакции катионов второй аналитической группы приведены в табл. 6.
Таблица 6
Сводная таблица реакций катионов второй аналитической группы
Реактив |
Ag+ |
Hg22+ |
Pb2+ |
HCl |
AgCl ↓ белый осадок, растворим в NH4OH, Na2S2O3 |
Hg2Cl2↓ белый осадок, при действии NH4OH чернеет |
PbCl2↓ белый осадок, растворим в горячей воде |
KI |
AgI ↓ желтый осадок, растворим в Na2S2O3 |
Hg2I2↓ зеленый осадок, растворим в избытке KI |
PbI2 ↓ золотисто-желтый осадок, растворим в избытке KI, CH3COOH |
K2CrO4 |
Ag2CrO4 ↓ красно-бурый осадок, растворим в HNO3, NH4OH |
Hg2CrO4 ↓ красный осадок, растворим в HNO3 |
PbCrO4 ↓ желтый осадок, растворим в NaOH, HNO3 |
Дитизон |
Желтое окрашивание хлороформного слоя (рН=7) |
- |
Красное окрашивание хлороформного слоя (рН > 7) |
NaOH |
Ag2O – буро-черный осадок, растворим в HNO3, NH4OH |
Hg – черный осадок, растворим в HNO3 |
Pb(OH)2 – белый осадок, растворим в NaOH, HNO3 |
H2SO4 |
Ag2SO4 ↓ растворим в горячей воде |
Hg2SO4 ↓ растворим в царской водке |
PbSO4 ↓ растворим в NaOH, HCl, H2SO4 |
Восстано-вители |
Ag ↓ черный осадок |
Hg ↓ черный осадок |
Pb ↓ черный осадок |
Окислители |
- |
Hg2+ |
Pb4+
|
