
- •Колот Наталья Владимировна
- •Компенсация углеводного обмена у кроликов с экспериментальным сахарным диабетом 1 типа при трансплантации островков поджелудочной железы в разные сайты организма
- •Содержание
- •Введение
- •Раздел I
- •1.1. Современные представления о физиологии поджелудочной железы и её роли в жизнедеятельности организма.
- •1.1.1. Эмбриональное становление поджелудочной железы.
- •1.1.2. Инсулин, регуляция его синтеза и секреции.
- •1.1.3. Физиологические эффекты инсулина в организме.
- •1.2. Cахарный диабет 1 типа.
- •1.3. Трансплантация островков поджелудочной железы как метод лечения сахарного диабета 1 типа.
- •1.4. Выживание островков поджелудочной железы в различных сайтах организма.
- •Раздел II
- •2.1. Получение островков поджелудочной железы.
- •2.2. Разделение суспензии клеток и островков поджелудочной железы в градиенте плотности фиколла.
- •2.3. Культивирование островков поджелудочной железы.
- •2.4. Выявление β-клеток островков поджелудочной железы с помощью специфической реакции на дитизон.
- •2.5. Определение базального и стимулированного уровня инсулина в среде культивирования.
- •2.6. Измерение активности α - амилазы в среде культивирования островков поджелудочной железы.
- •2.7. Экспериментальная модель сахарного диабета.
- •2.8. Трансплантация островков поджелудочной железы животным с экспериментальным сд 1 типа.
- •Экспериментальные группы животных:
- •2.9.1. Определение содержания глюкозы в цельной крови.
- •2.11. Определение уровня инсулина в сыворотке крови.
- •2.12. Определение уровня с-пептида в сыворотке крови.
- •2.13. Измерение биохимических показателей в сыворотке крови экспериментальных животных.
- •2.14. Определение показателей крови у экспериментальных животных.
- •2.15. Гистологический анализ образцов.
- •2.16. Реактивы.
- •2.17. Статистическая обработка результатов.
- •3.1. Изучение структурно - функциональных свойств островков поджелудочной железы неонатальных поросят и кроликов in vitro
- •3.3. Использование флуоресцентного красителя DiОc18 для идентификации трансплантата островков поджелудочной железы.
- •3.4. Изучение влияния ксенотрансплантации островков поджелудочной железы интрапортально и внутриселезеночно на функцию печени и селезенки
- •3.4.1. Влияние интрапортальной ксенотрансплантации островков поджелудочной железы на функциональное состояние печени
- •3.4.2. Влияние внутриселезеночной ксенотрансплантации островков поджелудочной железы на функциональное состояние селезенки
- •Заключение
- •Список использованной литературы
3.4. Изучение влияния ксенотрансплантации островков поджелудочной железы интрапортально и внутриселезеночно на функцию печени и селезенки
По мнению ряда авторов, трансплантация ОПЖ в портальную вену [117, 175, 293] и в пульпу селезенки [116, 136, 146, 289, 310, 330] позволяет нормализовать уровень глюкозы в крови, восстановить нарушенный углеводный обмен и обеспечить продукцию эндогенного инсулина в организме реципиента при СД 1 типа, а также способствует предупреждению развития тяжелых диабетических осложнений. Изучение показателей углеводного обмена в нашей работе показало, что интрапортальная и внутриселезеночная АлТц и КсТц ОПЖ позволяет в течение длительного времени поддерживать нормогликемию в организме реципиента. Уровень HbA1c и тест толерантности к глюкозе на 3 месяц посттрансплантационного периода не выявили существенных нарушений в углеводном обмене животных с экспериментальным СД 1 типа после интрапортальной и внутриселезеночной трансплантаций ОПЖ.
Однако, практически невыясненным остается вопрос о влиянии операции по введению ОПЖ путем инъекции на функцию органа, в который производится трансплантация. Кроме травматических послеоперационных нарушений, которые развиваются в первые дни после трансплантации, возможны также и осложнения, связанные с развитием реакции отторжения, инфильтрации иммунокомпетентными клетками, формированием рубца на поздних сроках. Все эти факторы могут негативно влиять на непосредственную жизнедеятельность органа, в который выполняют трансплантацию так, что гипогликемический эффект, достигнутый в результате введения ОПЖ может быть менее значим, чем тяжесть осложнений, нанесенных организму вследствие операции.
Эти вопросы требовали детального изучения, в связи с чем нами были изучены биохимические и другие показатели органов, гипогликемический эффект при трансплантации, в которые был максимальным: печень (интрапортальное введение) и селезенка.
3.4.1. Влияние интрапортальной ксенотрансплантации островков поджелудочной железы на функциональное состояние печени
В литературе встречаются данные, согласно которым успех интрапортальной трансплантации ОПЖ ограничен из–за быстрой потери графта, что связано с влиянием иммунных и неиммунных факторов [313]. Интрапортальная трансплантация ОПЖ может сопровождаться тяжелыми осложнениями, такими как кровотечение, гипертензия, эмболия и тромбоз портальной вены, стеатоз, массивный гепатический инфаркт, что в конечном итоге приводит к гибели реципиента [130, 333]. При трансплантации ОПЖ взрослых свиней в портальную вену обезьян происходит запуск реакции коагуляции, активации компонентов системы комплемента, агрегации тромбоцитов, инфильтрации портальной вены нейтрофильными гранулоцитами и моноцитами, которые вовлекаются в воспалительную реакцию, способствуя 70% потере графта на начальном посттрансплантационном этапе [313]. Активация вышеперечисленных реакций, возможно, связана с пиком С-пептида в сыворотке крови после проведения трансплантации. Известно, что между реакцией коагуляции, системой комплемента и клетками, принимающими участие в воспалительной реакции, существует множество связей [297]. В частности, реакция коагуляции развивается при контакте графта с кровью реципиента, что приводит к активации коллагена и тканевых факторов, которые экспрессируются и продуцируются α- и β-клетками наряду с глюкагоном и инсулином, способствуя активации и агрегации тромбоцитов [151, 198, 227, 252]. Дополнительно эндотелиальные клетки портальной вены продуцируют тромбоцит - активирующие факторы, являющиеся хемоаттрактантами для нейтрофилов. Активированные тромбоциты экспрессируют на поверхности мембраны Р-селектин – рецептор для взаимодействия с нейтрофилами и моноцитами. Тромбин стимулирует рецепторы к протеазам, представленые на гранулоцитах и моноцитах, что приводит к увеличению продукции цитокинов (ИЛ-1, ФНОα, моноцит – хемоаттрактантный белок-1) [153], а тканевые факторы, фибрин и фибриноген направлено активируют макрофаги [305]. Реакция коагуляции и агрегация тромбоцитов вызывает образование микротромбозов в терминальных ветвях портальной вены и развитию массивного инфаркта печени [313]. Цитокины, участвующие в процессе воспаления, повреждают β-клетки или островки через активацию нескольких стресс – сигнальных путей (р38 путь и путь опосредованный c-Jun NH2-терминальной киназой) [242, 258]. Активация системы комплемента, инфильтрация нейтрофилами и макрофагами, освобождение провоспалительных цитокинов, сверхактивация Fas экспрессии приводят к апоптозу островков, главным образом через ФНОα – сигнальный путь и активацию ядерного фактора – кВ - регулирующего апоптические гены и активацию каспаз [141].
В настоящее время существуют следующие пути преодоления развития воспалительных реакций, сопровождающиеся быстрой потерей интрапортального графта и развитием осложнений, к которым относят: использование антикоагулянтов (гепарин, N-ацетилцистеин и другие) [170], агентов, имеющих антивоспалительный эффект (анти–ФНОα–моноклональные антитела, статины, α1-антитрипсин, никотинамид и другие) [228, 251, 278], применение генетических модификаций в изолированных островках донора (человека, свиньи), с помощью аденовирус – опосредованной сверхэкспрессии анти-апоптических генов (А20, Bcl-2, Bcl-XL, XIAP) [150, 177, 209], применение антиоксидантов, комплемент – регулирующих белков (hDAF/hCD59) [173, 254, 278], а также создание нокаутных свиней, лишенных гена, кодирующего синтез фермента галактозил-трансферазы, ответственного за продукцию Gal-олигосахаридов [218, 266].
Однако необходимо отметить, что в работах некоторых авторов описываются данные, согласно которым активация реакции коагуляции и агрегации тромбоцитов, приводящие к быстрой потере интрапортального графта, может быть связаны с контаминацией трансплантата [133].
В связи с описанием некоторыми авторами возможных посттрансплантационных нарушений функций печени, сопровождающихся тяжелыми осложнения [130, 313, 333], мы считали необходимым в нашей работе провести исследование показателей, отражающих функциональное состояние печени, после интрапортальной трансплантации ОПЖ неонатальных поросят.
Для идентификации дисфункции печени после КсТц островков Лангерганса в портальную вену нами были проведены исследования биохимических показателей крови (содержание общего и свободного билирубина, альбумина, креатинина, активности ЩФ, АлАТ, АсАТ). По данным литературы вышеперечисленные показатели характеризуют функциональное состояние печени [69, 127, 171, 192, 271].
Одним из важных показателей развития острых и хронических диффузных заболеваний печени, дистрофических гепатопоражений при первичном билиарном циррозе печени, а также при тромбозе, эмболии, стеатозе портальной вены, массивном гепатическом инфаркте является повышение уровня общего билирубина в сыворотке крови [41, 52, 69].
Билирубин является продуктом распада гемоглобина, который образуется в клетках ретикулоэндотелиальной системы селезенки и печени вследствие катаболизма геминовой части гемоглобина и других гемсодержащих белков. Существуют две фракции билирубина: свободный и связанный. Процесс распада гемоглобина начинается в селезенке, вследствие чего образуются биливердин и свободный билирубин, который затем транспортируется в печень в виде комплекса с сывороточным альбумином. В печени свободный билирубин комплексируется с глюкуроновой кислотой и превращается в связанный билирубин или билирубинглюкуронид, который активно против градиента концентрации экскретируется в желчные протоки [9, 52]. Свободный билирубин представляет собой высоко токсичное, липофильное вещество, и может легко растворяется в липидах мембран митохондрий, нарушая метаболические процессы в гепатоцитах. При нарушении функции печени связывание билирубина замедляется, вследствие чего увеличивается уровень свободного билирубина в крови. Поэтому, избыточное содержание билирубина, особенно свободного, в крови, свидетельствует о наличии функциональных нарушений в печени [48, 69].
У интактных кроликов уровень общего билирубина в сыворотке крови в среднем составлял 9,71±0,38 мкмоль/л (Рис. 3.37), а у животных с экспериментальным СД 1 типа – 18,05±0,26 мкмоль/л.
Для дополнительного контроля проводили ложную операцию интактным животным и животным с экспериментальным СД 1 типа, при которой вместо трансплантата вводили такой же объем питательной среды с антибиотиками.
Содержание общего билирубина у ложнооперированных животных на протяжение 91 суток не превышало значения, установленные для интактных животных, тогда как у ложнооперированных с экспериментальным СД 1 типа этот покзатель в 1,7 раз был выше значений интактной группы животных (Таблица 6).
Общий билирубин в сыворотке крови кроликов с экспериментальным СД 1 типа до интрапортальной КсТц ОПЖ превышал в 1,8 раза значения интактных животных и в среднем составлял 16,77±0,32 мкмоль/л. Однако на 3 сутки посттрансплантационного периода наблюдалось постепенное снижение уровня билирубина в сыворотке крови до 13,59±0,58 мкмоль/л. На 7 сутки после интрапортальной КсТц ОПЖ содержание общего билирубина было на уровне интактных животных и в среднем составляло 7,24±1,05 мкмоль/л. Следует отметить, что на 77 сутки после интрапортального введения ОПЖ отмечалось повторное повышение содержание билирубина в сыворотки крови экспериментальных животных, а на 91 сутки содержание билирубина в среднем составляло 11,79±0,41 мкмоль/л (Рис. 3.37).

Рис. 3.37. Содержание общего билирубина в сыворотке крови кроликов с экспериментальным СД 1 типа после интрапортальной КсТц ОПЖ.
Примечания: * - отличия достоверны по отношению к значениям интактного контроля, р < 0,01, линией указан уровень показателя интактного контроля.
Таблица 6. Биохимические показатели крови у интактных и животных с экспериментальным СД 1 типа после проведения ложной операции.
Биохимические показатели |
Сутки |
Контроль |
СД 1 типа |
||
Без операции |
ЛО |
Без операции |
ЛО |
||
Глюкоза, ммоль/л |
До |
6,01 ± 0,30 |
4,25 ± 0,25 |
27,5 ± 0,05* |
26,7 ± 0,15* |
3 |
5,37 ± 0,50 |
5,55 ± 0,05 |
27,15 ± 0,15* |
27,5 ± 0,25* |
|
14 |
5,92 ± 0,21 |
5,05 ± 0,15 |
24,86 ± 0,05* |
27,3 ± 0,22* |
|
91 |
5,60 ± 0,32 |
5,65 ± 0,35 |
26,05 ± 0,25* |
27,4 ± 0,20* |
|
Билирубин, мкмоль/л |
До |
11,45 ± 0,18 |
10,95 ± 0,12 |
17,34 ± 0,29* |
16,32 ± 0,29* |
3 |
10,24 ± 0,29 |
11,25 ± 0,29 |
18,35 ± 0,29* |
19,36 ± 0,29* |
|
14 |
8,21 ± 0,29 |
9,73 ± 0,15 |
16,53 ± 0,18* |
16,83 ± 0,10* |
|
91 |
10,04 ± 0,17 |
8,21 ± 0,30 |
17,34 ± 0,30* |
17,01 ± 0,12* |
|
Креатинин, мг/мл |
До |
8,07 ± 0,20 |
7,52 ± 0,12 |
18,84 ± 0,41* |
20,23 ± 0,39* |
3 |
8,56 ± 0,48 |
8,08 ± 0,20 |
20,23 ± 0,40* |
22,31 ± 0,55* |
|
14 |
8,63 ± 0,28 |
7,38 ± 0,20 |
22,31 ± 0,56* |
23,01 ± 0,41* |
|
91 |
10,16± 0,20 |
8,29 ± 0,08 |
18,84 ± 0,40* |
20,84 ± 0,38* |
|
Альбумин, мг/мл |
До |
45,96 ± 0,54 |
45,53 ± 0,57 |
33,62 ± 0,81# |
29,78 ± 0,49# |
3 |
47,66 ± 0,62 |
46,59 ± 0,41 |
32,77 ± 0,81# |
32,34 ± 0,98# |
|
14 |
47,02 ± 0,41 |
44,04 ± 0,73 |
29,36 ± 0,25# |
34,89 ± 0,50# |
|
91 |
45,10 ± 0,49 |
46,80 ± 0,50 |
31,49 ± 1,04# |
30,00 ± 0,81# |
|
ЩФ, нмоль/сл |
До |
2875,35 ± 128,25 |
2875,35 ± 128,25 |
5985,20 ± 128,31* |
5874,14 ± 64,12* |
3 |
2875,35 ± 128,25 |
3097,48 ± 128,24 |
6873,73 ± 128,31* |
6540,53 ± 64,12* |
|
14 |
2764,29 ± 64,12 |
2208,95 ± 65,00 |
6207,33 ± 128,25* |
4985,07 ± 192,37* |
|
91 |
2264,49 ± 55,53 |
2320,02 ± 64,12 |
6873,73 ± 128,31* |
4652,41 ± 128,25* |
|
АлАт, мкмоль/ч мл |
До |
0,49 ± 0,03 |
0,49 ± 0,03 |
1,28 ± 0,03* |
1,43 ± 0,09* |
3 |
0,49 ± 0,03 |
0,54 ± 0,06 |
1,33 ± 0,02* |
1,55 ± 0,03* |
|
14 |
0,57 ± 0,03 |
0,49 ± 0,03 |
1,38 ± 0,04* |
1,33 ± 0,04* |
|
91 |
0,46 ± 0,05 |
0,49 ± 0,02 |
1,22 ± 0,03* |
1,27 ± 0,06 |
|
АсАт, мкмоль/ ч мл |
До |
0,49 ± 0,03 |
0,50 ± 0,02 |
1,69 ± 0,05* |
1,79 ± 0,05* |
3 |
0,40 ± 0,03 |
0,54 ± 0,06 |
1,79 ± 0,06* |
2,51 ± 0,18* |
|
14 |
0,54 ± 0,06 |
0,44 ± 0,03 |
1,89 ± 0,05* |
1,75 ± 0,08* |
|
91 |
0,47 ± 0,05 |
0,49 ± 0,04 |
1,98 ± 0,06* |
1,79 ± 0,06* |
|
Примечания: * - отличия достоверны относительно интактных животных, р < 0,05, # - отличия достоверны относительно интактных животных, р < 0,01.
Из литературных источников известно, что фракция свободного билирубина при отсутствии патологических процессов в печени составляет до 25% от общего билирубина [69].
В таблице 6 представлены данные содержания свободного билирубина в сыворотке крови экспериментальных групп животных. Необходимо отметить, что содержание свободного билирубина в сыворотке крови ложнооперированных животных не изменялось на протяжение всего эксперимента и оставалось на уровне интактной группы животных, который в среднем составлял 11,9±0,3% от общего билирубина. У кроликов с экспериментальным СД 1 типа независимо от проведения ложной операции содержание свободного билирубина в сыворотке крови было в 2,3-2,5 раза выше, чем у контрольной группы животных.
У группы животных с экспериментальным СД 1 типа после интрапортальной КсТц ОПЖ содержание уровень билирубина, начиная с 3 суток постепенно снижался и на 7 сутки находилсь в пределах нормальных значений. Уровень свободного билирубина у кроликов с интрапортальным ксенографтом ОПЖ не превышал 14,5±1,1% на протяжении всего периода наблюдения (Таблица 7).
Следует отметить, что уровень глюкозы в крови кроликов с экспериментальным диабетом после интрапортальной КсТц ОПЖ с 49 суток начинал повторно увеличиваться и на 91 сутки в среднем составлял 12,43±1,17 ммоль/л. Следовательно, повторное повышение уровня общего и свободного билирубина в сыворотке крови было связано с повышением уровня глюкозы в крови животных, а не с повреждением печени вследствие операции введения островков в портальную вену. Это подтверждается тем фактом, что у кроликов с экспериментальным СД 1 типа независимо от проведения ложной операции содержание общего и свободного билирубина в сыворотке крови значительно превышало показатели интактных животных, это свидетельствовало о развитии диабетической гепатопатии у этих групп животных.
Таблица 7. Относительное содержание свободного билирубина (%) в сыворотке крови интактных животных и кроликов с экспериментальным СД 1 типа после интрапортальной КсТц островков.
Группы животных |
Сутки после трансплантации |
|||||||
До тр. |
3 |
7 |
21 |
49 |
63 |
77 |
91 |
|
Интактные |
11,9±1,3 |
|||||||
Диабет |
30,3±2,8 |
|||||||
ЛО контроль |
9,8±0,6 |
10,5±1,1 |
10,2±0,7 |
12,9±1,7 |
11,4±0,9 |
11,8±0,5 |
11,9±1,1 |
11,9±1,1 |
ЛО диабет |
32,0±2,4* |
32,2±2,2* |
29,3±1,2* |
31,9±1,2* |
28,9±1,2* |
32,7±1,1* |
27,6±1,8* |
29,6±2,4 |
КсТц ОПЖ |
26,7±0,6* |
15,6±2,1 |
11,4±0,9 |
11,1±2,0 |
10,6±1,3 |
11,2±1,6 |
14,2±1,4 |
14,5±1,1 |
Примечание. * - отличия достоверны по отношению к значениям интактного контроля, р < 0,05.
Наиболее информативными показателями нарушения деятельности печени и индикаторами гепатоцеллюлярных поражений считаются содержание альбумина и активности ферментов ЩФ, АлАт, АсАт в сывортке крови [1, 9, 127, 192, 271].
Известно, что синтез альбумина происходит в основном в гепатоцитах, поэтому изучение этого показателя является важным при определении развития нарушений в печени [9, 52, 69]. При нарушениях функционального состояния печени снижается белоксинтезирующая способность, в том числе и синтез альбумина.
Содержание альбумина в сыворотке крови у интактных животных в течение 91 суток в среднем составляло 46,39±0,26 мг/мл (Рис. 3.38), при этом уровень альбумина у кроликов с экспериментальным СД 1 типа – 31,18±0,41 мг/мл.
У ложнооперированных кроликов уровень альбумина в сыворотке крови на протяжении всего периода наблюдения оставалсь в пределах контрольных значений, а у ложнооперированных кроликов с экспериментальным СД 1 типа содержание альбумина было в среднем в 1,5 раза меньше, чем у интактных животных, что свидетельствовало про нарушения синтезирующей функции печени (Таблица 6).
При изучении содержания альбумина в сыворотке крови было установлено снижение этого показателя у кроликов до интрапортального введения островков и на 3 сутки после КсТц в среднем 1,2 раза. Однако на 7 сутки отмечалось повышение уровня альбумина у кроликов с интрапортальным ксенографтом ОПЖ до уровня интактных животных. На 91 сутки посттрансплантационного периода у животных с ксенографтом в портальной вене уровень альбумина достоверно не отличался от показателей контроля и в среднем составлял 45,67±0,77 мг/мл (Рис. 3.38), что свидетельствовало о восстановлении белоксинтезирующей способности печени после интрапортальной КсТц ОПЖ.

Рис. 3.38. Содержание альбумина в сыворотке крови кроликов с экспериментальным СД 1 типа после интрапортальной КсТц ОПЖ.
Примечания: * - отличия достоверны по отношению к значениям интактного контроля, р < 0,01, линией указан уровень показателя интактного контроля.
ЩФ имеет повышенную активность в печени и остеобластах по сравнению с другими органами, поэтому при нарушении функции печени и заболеваниях костей её активность в крови повышается [1, 52]. Аминотрансферазы (АлАт и АсАт) имеют наибольшую активность в печени и ПЖ. При патологических процессах в этих органах увеличивается проницаемость мембран клеток или их лизис, вследствие чего ферменты высвобождаются из клеток, благодаря чему показатели их активности в крови увеличиваются. Таким образом, повышение активности аминотрансфераз в крови является одним из основных индикаторов поврежедения паренхимы печени и заболеваний гепатобилиарной системы [69, 127, 192, 271].
Активность ферментов в сыворотке крови интактной группы животных на протяжение всего периода наблюдений в среднем составляла: ЩФ – 2468,11±56,75 нмоль/с·л (Рис. 3.39), АсАт - 0,49±0,03 мкмоль/ч·мл (Рис. 3.40), АлАт – 0,54±0,04 мкмоль/ч·мл (Рис. 3.41). У кроликов с экспериментальным диабетом показатели были следующими: ЩФ – 6022,22±160,79 нмоль/с·л, АсАт – 1,92±0,06 мкмоль/ч·мл, АлАт – 1,35±0,03 мкмоль/ч·мл, что указывало на существование нарушений функции печени у животных при данной патологии. Этот факт подтверждают данные литературы, которые демонстрируют, что при введении животным диабетогенной дозы раствора аллоксана уже на 11 сутки начинают увеличиваться активности ЩФ, АсАт, АлАт в сыворотке крови [1].

Рис. 3.39. Активность ЩФ в сыворотке крови интактных и кроликов с экспериментальным СД 1 типа после интрапортальной КсТц ОПЖ.
Примечание. * - отличия достоверны по отношению к значениям интактного контроля, р < 0,01, линией указан уровень показателя интактного контроля.
У кроликов после ложной операции активность ЩФ, АлАт, АсАт в сыворотке крови оставалась в пределах контрольных значений, тогда как у группы кроликов с экспериментальным СД 1 типа независимо от проведения ложной операции наблюдалась повышенная активность ЩФ в 2,2 раза, АсАт в 3,6 раза, АлАт в 2,4 раза по сравнению с интактной группой животных (Таблица 6).
Н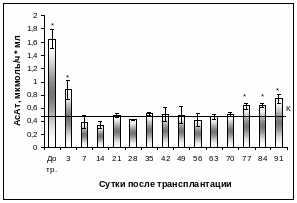 еобходимо
отметить, что у кроликов с экспериментальным
диабетом до КсТц ОПЖ активность ЩФ в
2,1 раза (Рис. 3.39), АсАт 2,9 в раза (Рис. 3.40),
АлАт в 2,5 раза (Рис. 3.41) была выше, чем у
интактных животных. На 3 сутки после
КсТц ОПЖ в портальную вену активность
ферментов постепенно начинала снижаться,
однако превышала значения контроля: ЩФ
в 1,8 раза,
АсАт в 1,6 раза, АлАт в 1,7 раза. С 7 суток
посттрансплантационного периода, когда
уровень глюкозы в крови экспериментальных
животных был в пределах нормогликемии
активности ЩФ, АсАт и АлАт в сывортке
крови животных достоверно не отличались
от интактной группы животных (Рис. 3.39,
3.40, 3.41).
еобходимо
отметить, что у кроликов с экспериментальным
диабетом до КсТц ОПЖ активность ЩФ в
2,1 раза (Рис. 3.39), АсАт 2,9 в раза (Рис. 3.40),
АлАт в 2,5 раза (Рис. 3.41) была выше, чем у
интактных животных. На 3 сутки после
КсТц ОПЖ в портальную вену активность
ферментов постепенно начинала снижаться,
однако превышала значения контроля: ЩФ
в 1,8 раза,
АсАт в 1,6 раза, АлАт в 1,7 раза. С 7 суток
посттрансплантационного периода, когда
уровень глюкозы в крови экспериментальных
животных был в пределах нормогликемии
активности ЩФ, АсАт и АлАт в сывортке
крови животных достоверно не отличались
от интактной группы животных (Рис. 3.39,
3.40, 3.41).
Рис. 3.40. Активность АсАт в сыворотке крови интактных и кроликов с экспериментальным СД 1 типа после интрапортальной КсТц ОПЖ.
Примечание. * - отличия достоверны по отношению к значениям интактного контроля, р < 0,01, линией указан уровень показателя интактного контроля.
В течение 77 суток у кроликов после интрапортальной КсТц ОПЖ активности ЩФ, АсАт, АлАт были в пределах контрольных значений. Однако на 77 суток отмечалось повторное повышение в сыворотке крови активности ЩФ в 1,2 раза, АсАт в 1,3 раза, АлАт в 1,2 раза, при этом необходимо отметить, что уровень глюкозы в крови этих животных составлял 11-12 ммоль/л.
Д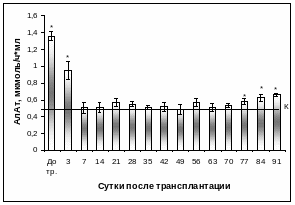 ля
дополнительной оценки влияния
интрапортальной КсТц островков на
функцию печени мы проводили изучение
коэффициента Де Ритиса, который
представляет собой соотношение АсАт к
АлАт и отражает степень тяжести поражения
печени. Повышение коэффициента Де Ритиса
более 1,33±0,26 наблюдается при тяжелых
поражениях печени, сопровождающихся
некрозом гепатоцитов [9, 41, 72].
ля
дополнительной оценки влияния
интрапортальной КсТц островков на
функцию печени мы проводили изучение
коэффициента Де Ритиса, который
представляет собой соотношение АсАт к
АлАт и отражает степень тяжести поражения
печени. Повышение коэффициента Де Ритиса
более 1,33±0,26 наблюдается при тяжелых
поражениях печени, сопровождающихся
некрозом гепатоцитов [9, 41, 72].
Рис. 3.41. Активность АлАт в сыворотке крови интактных и кроликов с экспериментальным СД 1 типа после интрапортальной КсТц ОПЖ.
Примечание. * - отличия достоверны по отношению к значениям интактного контроля, р < 0,01, линией указан уровень показателя интактного контроля.
У интактных кроликов соотношение АсАт/АлАт в среднем составляло 0,96±0,03 (Рис. 3.42), а у кроликов с экспериментальным диабетом – 1,45±0,04, что свидетельствовало про развитие диабетической гепатопатии при аллоксан – индуцированном диабете.

Рис. 3.42. Изменение коэффициента Де Ритиса у кроликов с экспериментальным СД 1 типа после интрапортальной КсТц ОПЖ.
Примечание. * - отличия достоверны по отношению к значениям интактного контроля, р < 0,01, линией указан уровень показателя интактного контроля.
Определение содержания креатинина в сыворотке крови наряду с идентификаций клубочковой фильтрации в почках также является информативным показателем печеночной недостаточности, так как синтез креатинина происходит в печени [52, 69]. Креатинин относится к «беспороговым» веществам, в норме креатинин свободно фильтруется в почечных клубочках, не подвергаясь обратному всасыванию или дополнительной секреции в канальцах и при отсутствии патологии почек полностью экскретируется из организма с мочой. Увеличение концентрации креатинина в сыворотке крови происходит при уменьшении уровня почечной фильтрации (снижении функции почек) [9, 69].
Исследование содержания креатинина в крови после трансплантации ОПЖ неонатальных поросят в портальную вену является целесообразным для обнаружения развития осложнений, которые связаны с развитием в организме СД 1 типа (нефропатии), а также посттрансплантационных осложнений.
У ложнооперированных кроликов содержание креатинина в крови не изменялось и соответствовало значениям интактных животных, тогда как у кроликов с экспериментальным СД 1 типа уровень креатинина в 2,1 раза превышал значения контроля (Таблица 6). Содержание креатинина в сыворотке крови интактных животных в среднем составляло 9,63±0,53 мг/мл (Рис. 3. 43), а у кроликов с экспериментальным СД 1 типа – 20,23±0,42 мг/мл.
На 3 сутки после КсТц ОПЖ в портальную вену наблюдалось постепенное снижение уровня креатинина в сыворотке крови и на 7 сутки посттрансплантационного периода у кроликов с интрапортальным ксенографтом островков уровень креатинина был в пределах контрольных значений и в среднем составлял 8,93±0,18 мг/мл. Повторное повышение в 1,2 раза креатинина наблюдалось на 77 сутки после КсТц ОПЖ в портальную вену (Рис. 3. 43).
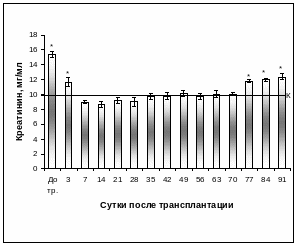
Рис. 3.43. Содержание креатинина в сыворотке крови кроликов с экспериментальным СД 1 типа после интрапортальной КсТц ОПЖ.
Примечание. * - отличия достоверны по отношению к значениям интактного контроля, р < 0,01, линией указан уровень показателя интактного контроля.
Анализ полученных данных показал повышенные показатели общего и свободного билирубина, креатинина и активностей ЩФ, АсАт, АлАт и сниженный уровень альбумина у животных с экспериментальным СД 1 типа, что свидетельствовало о развитие диабетической гепатопатии, так как у этой группы животных отмечалась гипергликемия на протяжении всего периода наблюдения, которая способствовала жировой инфильтрации печени.
У животных с экспериментальным СД 1 типа после интрапортальной КсТц ОПЖ определение биохимических показателей функции печени показало сходную динамику общего и свободного билирубина, креатинина, а также активностей ЩФ и аминотрансфераз, а именно: повышение уровня показателей до проведения КсТц, снижение в первую неделю после введения ОПЖ неонатальных поросят, и повторное повышение на 77 сутки посттрансплантационного периода.
Из литературных источников известно, что нарушение функции печени является распространенной патологией при СД 1 типа. Диабетическая гепатопатия встречается по данным разных авторов в 26-66% случаях у больных СД 1 типа. Дефицит инсулина в организме при СД приводит к нарушениям углеводного, жирового, белкового, аминокислотного обменов, повышению активности контринсулярных гормонов, сопровождающееся развитием хронического эндотоксикоза и негативно влияет на функцию печени. Повышение в плазме крови уровня триглицеридов, липопротеинов низкой и очень низкой плотности при СД 1 типа приводит к увеличению синтеза жирных кислот. Это сопровождается перенапряжением процессов β-окисления в митохондриях гепатоцитов и накоплением жирных кислот и липопротеинов низкой плотности в клетках печени, что вызывает её жировую дистрофию и приводит к нарушению связывания свободного билирубина [4, 34, 47, 57, 90].
При СД 1 типа наблюдается нарушение синтеза белка, а также отмечается интенсификация процессов катаболизма белков, при этом уменьшается содержание альбумина и повышается содержание α-глобулинов [34, 47, 111]. На фоне диспротеинемии происходит повышение активности АлАт в сыворотке крови, так как усиливается аланинглюкозный путь, который сопровождается выбросом из клеток глюкозы за счет ее дефосфорилирования повышенной ЩФ [69, 88]. Известно, что АлАт является ферментом, который обеспечивает работу аланинглюкозного шунта, способствуя переходу глюкозы в аланин и наоборот, поддерживая уровень глюкозы и белка в плазме крови. Следует отметить, что АсАт является ключевым ферментом обмена веществ и обеспечивает поступление субстратов (аспартат, глутамат, пируват и α-кетоглутарат) в цикл трикарбоновых кислот, занимая «центральную» роль в метаболизме. ЩФ в организме осуществляет процессы трансмембранного фосфорилирования, обеспечивая вход и выход глюкозы в клетки, что напрямую влияет на уровень глюкозы в крови [9]. Вследствие нарушение углеводного обмена, а именно гипергликемия, при СД 1 типа способствует повышению активности ЩФ, АсАт, АлАт в крови.
Учитывая выше представленные факты, полученные нами результаты давали основание считать, что повышение уровня сывороточного билирубина, креатинина, и активностей ЩФ и аминотрансфераз, которое наблюдалось при развитие экспериментального СД 1 типа, не связано с посттрансплантационными осложнениями и развитием функциональных нарушений в печени. Анализ динамики гликемии (Рис. 3.19 б) и биохимических показателей у кроликов с интрапортальным ксенографтом ОПЖ дают возможность утверждать, что повышение биохимических показателей, отражающие функциональное состояние печени, зависят от присутствия гипергликемичного состояния у животных, но не являются следствием интрапортального введения островков неонатальных поросят.
У кроликов после интрапортальной КсТц ОПЖ уровень глюкозы на протяжение 49 суток находился на уровне интактной группы животных. Начиная с 49 суток у кроликов с интрапортальным ксенографтом наблюдалось повышение уровня гликемии до 10 ммоль, а с 77 суток до 11-12 ммоль/л. Отсутствие изменений в содержание общего и свободного билирубина, креатинина, а также активности ферментов на протяжении 70 суток и уровня альбумина на протяжении 91 суток посттрансплантационного периода, свидетельствовало о том, что интрапортальная КсТц ОПЖ не вызывала развития интрапортальных осложнений и нарушения функции печени.
