
- •Колот Наталья Владимировна
- •Компенсация углеводного обмена у кроликов с экспериментальным сахарным диабетом 1 типа при трансплантации островков поджелудочной железы в разные сайты организма
- •Содержание
- •Введение
- •Раздел I
- •1.1. Современные представления о физиологии поджелудочной железы и её роли в жизнедеятельности организма.
- •1.1.1. Эмбриональное становление поджелудочной железы.
- •1.1.2. Инсулин, регуляция его синтеза и секреции.
- •1.1.3. Физиологические эффекты инсулина в организме.
- •1.2. Cахарный диабет 1 типа.
- •1.3. Трансплантация островков поджелудочной железы как метод лечения сахарного диабета 1 типа.
- •1.4. Выживание островков поджелудочной железы в различных сайтах организма.
- •Раздел II
- •2.1. Получение островков поджелудочной железы.
- •2.2. Разделение суспензии клеток и островков поджелудочной железы в градиенте плотности фиколла.
- •2.3. Культивирование островков поджелудочной железы.
- •2.4. Выявление β-клеток островков поджелудочной железы с помощью специфической реакции на дитизон.
- •2.5. Определение базального и стимулированного уровня инсулина в среде культивирования.
- •2.6. Измерение активности α - амилазы в среде культивирования островков поджелудочной железы.
- •2.7. Экспериментальная модель сахарного диабета.
- •2.8. Трансплантация островков поджелудочной железы животным с экспериментальным сд 1 типа.
- •Экспериментальные группы животных:
- •2.9.1. Определение содержания глюкозы в цельной крови.
- •2.11. Определение уровня инсулина в сыворотке крови.
- •2.12. Определение уровня с-пептида в сыворотке крови.
- •2.13. Измерение биохимических показателей в сыворотке крови экспериментальных животных.
- •2.14. Определение показателей крови у экспериментальных животных.
- •2.15. Гистологический анализ образцов.
- •2.16. Реактивы.
- •2.17. Статистическая обработка результатов.
- •3.1. Изучение структурно - функциональных свойств островков поджелудочной железы неонатальных поросят и кроликов in vitro
- •3.3. Использование флуоресцентного красителя DiОc18 для идентификации трансплантата островков поджелудочной железы.
- •3.4. Изучение влияния ксенотрансплантации островков поджелудочной железы интрапортально и внутриселезеночно на функцию печени и селезенки
- •3.4.1. Влияние интрапортальной ксенотрансплантации островков поджелудочной железы на функциональное состояние печени
- •3.4.2. Влияние внутриселезеночной ксенотрансплантации островков поджелудочной железы на функциональное состояние селезенки
- •Заключение
- •Список использованной литературы
3.3. Использование флуоресцентного красителя DiОc18 для идентификации трансплантата островков поджелудочной железы.
На сегодняшний день исследование «судьбы» клеточных трансплантатов в организме реципиента является сложной и до конца нерешенной проблемой. Иммуногистохимические методы базируются на использовании антител к клеточным антигенам. Несмотря на их высокоспецифичность, они являются весьма трудоёмкими и дорогостоящими. Кроме того, известно, что наборы фенотипических маркеров разработаны далеко не для всех типов клеток. Использование флуоресцентных красителей может являться простым и надёжным способом идентификации клеточного трансплантата в организме реципиента путем флуоресцентной микроскопии или проточной цитофлуориметрии [187, 246]. Наиболее стабильным в целях использования при трансплантации клеток является полиметиновый краситель – 3,3’– диоктадецилоксакарбоцианин перхлорат DiОC18, относящийся к группе триметиновых карбоцианинов [134]. В частности, AлТц фетальных, предварительно культивированных и окрашенных DiOC18, кардиомиоцитов крысам с экспериментальным инфарктом миокарда способствовала улучшению показателей сердечной деятельности у животных - реципиентов, а кардиомиоциты, меченные DiOC18, были идентифицированы в месте введения на 4 недели посттрансплантационного периода [225]. Использование трейсера DiOC18 позволяет изучить процесс адгезии и миграции нейрональных стволовых клеток и образование нейросфер в условиях in vitro, которые в дальнейшем могут быть использованы в качестве трансплантационного материала при болезни Паркинсона [318]. Эмбриональные стволовые клетки предшественники холинергических мотонейронов инкубировали с DiOC18, после чего часть клеток культивировали с миоцитами, а другую - трансплантировали внутримышечно крысам с периферичекой денервацией, при этом у животных-реципиентов предотвращалась мышечная атрофия. Флуоресцентная микроскопия позволила идентифицировать трансплантат, меченный DiOC18, на 21 сутки, при этом наблюдалось формирование новых нейромышечных соединений с денервированным мышечным волокном in vivo и с миоцитом (на 7 сутки) in vitro [246].
Нами этот флуоресцентный краситель был использован для визуализации ОПЖ, в сайте организма, в который осуществляли КсТц. Таким образом, нами была предпринята попытка провести оценку сохранности ОПЖ неонатальных поросят в печени и в селезенке на ранних сроках посттрансплантационного периода, для того, чтобы доказать связь гипогликемическго эффекта ксенотрансплантата ОПЖ с наличием β-клеток или ОПЖ в месте трансплантации.
Полиметиновый краситель DiОC18 имеет длинноцепочечный углеводородный «хвост», состоящий из 18 углеродных остатков. Благодаря этому краситель встраивается в мембранный бислой клетки или во внешнюю мембрану митохондрий и может сохраняться в мембранном бислое на протяжении 3-4 недель, благодаря мембранному потенциалу [134, 187]. Проточная цитофлуориметрия или флуоресцентная микроскопия позволяют определить количество окрашенных DiOC18 клеток или ОПЖ in vitro или in vivo при трансплантации.
Для идентификации сохранности островков мы использовали ОПЖ неонатальных поросят.
До настоящего времени в мировой литературе не обнаружено данных, касающихся использования DiOC18 в окрашивании β-клеток или ОПЖ неонатальных поросят. В результате этого нами впервые было проведено окрашивание ОПЖ неонатальных поросят полиметиновым красителем DiOC18. Однако до проведения окрашивания DiOC18 ОПЖ, которые затем использовали в качестве трансплантационного материала, необходимо было провести подбор концентрации данного красителя. Данные, касающиеся подбора концентрации DiOC18, для окрашивания ОПЖ неонатальных поросят представлены на рис. 3.33.
Рис. 3.33. Подбор концентрации DiOC18 для окрашивания островков поджелудочной железы неонатальных поросят.
КсТц ОПЖ проводили в левую долю печень или в селезёнку кроликам с экспериментальным СД 1 типа (то есть в те сайты организма, в которых наблюдался пролонгированный эффект снижения гликемии).
У кроликов после КсТц меченных ОПЖ наблюдалось постепенное снижение уровня глюкозы в крови до нормогликемии. На 7 сутки у кроликов после внутриселезеночной КсТц ОПЖ, меченных DiОC18, наблюдалась нормогликемия и уровень глюкозы в среденем состоавлял 6,51±0,55 ммоль/л. КсТц ОПЖ, меченных DiОC18, в печень способствовала снижению гликемии в среднем до 6,80±0,40 ммоль/л на 14 сутки посттрансплантационного периода. В связи с чем, было сделано заключение о том, что полиметиновый краситель DiOC18 не оказывал негативного влияния на инсулинпродуцирующую функцию островковых клеток.
Для доказательства функции трансплантированных ОПЖ осуществляли частичную гепатэктомию и тотальную спленэктомию на 3 неделю после внутрипечёночной и внутриселезёночной КсТц ОПЖ. Через неделю после частичной гепатэктомии и спленэктомии у животных наблюдалось резкое повышение уровня глюкозы в крови в среденем до 16,40±0,42 ммоль/л и 17,80±0,25 ммоль/л соответственно, а через две недели после удаления органов с ксенографтом ОПЖ уровень гликемии в среднем составлял 20,42±0,40 ммоль/л и 20,55±0,25 ммоль/л соответственно, не снижаясь на протяжении всего последующего периода.
Пробу на толерантность к глюкозе у кроликов с экспериментальным СД 1 типа и КсТц ОПЖ после частичной гепатэктомии и спленэктомии не проводили, так как уровень глюкозы у этих групп животных превышал 20-22 ммоль/л, что являлось доказательством глубокого нарушения метаболизма в организме животных.
В качестве контроля осуществляли ложную операцию диабетным и контрольным животным. Уровень глюкозы у кроликов с экспериментальным диабетом после частичной гепатэктомии и спленэктомии не снижался в течение всего периода наблюдения и составлял в среднем 23,50±1,10 ммоль/л и 22,40±0,80 ммоль/л соответственно. У контрольных животных уровень глюкозы после частичной гепатэктомии и спленэктомии также оставался неизменным и составлял в среднем 5,70±0,40 ммоль/л и 5,60±0,50 ммоль/л соответственно, что свидетельствовало о том, что операция удаления части печени и селезёнки не влияет на уровень глюкозы в крови. Тест толерантности к глюкозе проводили на 90 сутки после проведения контрольным животным ложных операций. При этом была получена классическая гликемическая кривая, характерная для интактной группы животных с пиком на 30 минуте после введения раствора глюкозы и последующем восстановлением гликемии до прежних значений, что являлось одним из признаков отсутствия нарушений в углеводном метаболизме при удалении части печени и селезенки.
Уровень HbA1c у кроликов с экспериментальным СД 1 типа на 90 сутки после КсТц ОПЖ и удаления фрагмента печени и селезёнки в среднем составлял 18,54±1,02% и 16,33±1,39% от общего гемоглобина, тогда как у интактных животных этот показатель составлял 1,59±0,25% от общего гемоглобина. Изучение содержания HbA1c на 90 сутки у интактных кроликов после частичной гепатэктомии и спленэктомии показало отсутствие достоверных отличий относительно интактных животных, и в среднем уровень HbA1c у этих групп животных составлял 1,70±0,23% и 1,67±0,34% от общего гемоглобина соответственно.
Таким образом, удаление интрапеченочного и внутриселезёночного ксенотрансплантата ОПЖ неонатального происхождения из организма животных – реципиентов приводит к возвращению экспериментального СД 1 типа, о чём свидетельствовали показатели углеводного обмена. Это доказывает наличие корригирующей функции трансплантируемых ксеногенных островковых клеток на углеводный обмен при экспериментальном СД 1 типа.
После забора фрагмента печени и селезенки с ксенографтом ОПЖ осуществляли коллагенизацию ткани и последующее выделение в ступенчатом градиенте плотности фиколла ОПЖ неонатальных поросят.
При исследовании методом проточной цитофлуориметрии суспензии, выделенной из фрагмента печени и селезёнки, показало наличие 2,3% (Рис. 3.34 а, б) и % (Рис. 3.35 а, б) объектов, имеющих флуоресценцию в области 510 нм. Данные объекты были обнаружены в слое фиколла с плотностью 1,089 г/см3.


а б
Рис. 3.34. Цитофлуориметрический анализ суспензии, полученной из фрагмента печени: а) дот плот ось х – прямое (FSC); ось y - боковое (SSC) светорассеивание; б) денсити плот; ось х – FL1-H – зелёная флуоресценция (510 нм); ось y – SSC – боковое светорассеивание.
Рис. 3.35. Цитофлуориметрический анализ суспензии, полученной из селезёнки: а) дот плот ось х – прямое (FSC); ось y - боковое (SSC) светорассеивание; б) денсити плот; ось х – FL1-H – зелёная флуоресценция (510 нм); ось y – SSC – боковое светорассеивание.
Образцы суспензий, выделенные из печени и селезёнки, часть из которых была подвергнута цитофлуориметрическому анализу, также использовалась для флуоресцентной микроскопии. Объекты, имеющие зелёную флуоресценцию, были обнаружены после выделения их в ступенчатом градиенте фиколла в слое с плотностью 1,089 г/см3. Следует отметить, что в слое фиколла с плотностью 1,094 г/см3 были обнаружены единичные объекты, имеющие зелёную флуоресценцию, только при проведении флуоресцентной микроскопии (Таблица 5).
Таблица 5. Присутствие, окрашенных DiOC18, клеток и островков, выделенных на 21 сутки после КсТц из печени и селезёнки кроликов с экспериментальным СД 1 типа.
-
Плотность, г/см3
Проточная цитофлуориметрия
Флуоресцентная микроскопия
В печень
В селезёнку
В печень
В селезёнку
1,080
-
-
-
-
1,089
+
+
+
+
1,094
-
-
+
+
1,100
-
-
-
-
На рис. 3.36. представлен объекты, имеющие зелёную флуоресценцию в области 510 нм и выделенные из селезенки кролика в слое фиколла с плотностью 1,089 г/см3. При этом полученные объекты имели меньший размер и были неоднородно прокрашены, чем те которые мы трансплантировали изначально.
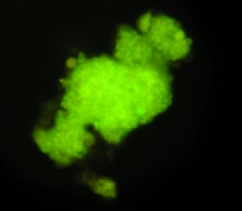
Рис. 3.36. Объекты, имеющие зелёную флуоресценцию в области 510 нм, выделенные из селезёнки в слое фиколла с плотностью 1,089г/см3. Ок. 10, об. 40.
Таким образом, внутрипеченочный и внутриселезеночный трансплантаты ОПЖ неонатальных поросят были обнаружены на 3 недели посттрансплантационного периода, свидетельствуя о том, что на ранних сроках после трансплантации гипогликемический эффект определяется функцией пересаженных островков.
По результатам данного раздела 3.3. опубликованы следующие работы:
1. Использование флуоресцентных полиметиновых красителей в клеточной трансплантации / Божок Г.А., Алабедалькарим Н.М., Дудецкая Г.В., Колот Н.В., Погребняк Н.Л., Легач Е.И. // Материалы III Всероссийского симпозиума с международным участием «Актуальные вопросы тканевой и клеточной транспланталогии», г. Москва, ЦИТО. – 2007. – С. 56.
