
- •Колот Наталья Владимировна
- •Компенсация углеводного обмена у кроликов с экспериментальным сахарным диабетом 1 типа при трансплантации островков поджелудочной железы в разные сайты организма
- •Содержание
- •Введение
- •Раздел I
- •1.1. Современные представления о физиологии поджелудочной железы и её роли в жизнедеятельности организма.
- •1.1.1. Эмбриональное становление поджелудочной железы.
- •1.1.2. Инсулин, регуляция его синтеза и секреции.
- •1.1.3. Физиологические эффекты инсулина в организме.
- •1.2. Cахарный диабет 1 типа.
- •1.3. Трансплантация островков поджелудочной железы как метод лечения сахарного диабета 1 типа.
- •1.4. Выживание островков поджелудочной железы в различных сайтах организма.
- •Раздел II
- •2.1. Получение островков поджелудочной железы.
- •2.2. Разделение суспензии клеток и островков поджелудочной железы в градиенте плотности фиколла.
- •2.3. Культивирование островков поджелудочной железы.
- •2.4. Выявление β-клеток островков поджелудочной железы с помощью специфической реакции на дитизон.
- •2.5. Определение базального и стимулированного уровня инсулина в среде культивирования.
- •2.6. Измерение активности α - амилазы в среде культивирования островков поджелудочной железы.
- •2.7. Экспериментальная модель сахарного диабета.
- •2.8. Трансплантация островков поджелудочной железы животным с экспериментальным сд 1 типа.
- •Экспериментальные группы животных:
- •2.9.1. Определение содержания глюкозы в цельной крови.
- •2.11. Определение уровня инсулина в сыворотке крови.
- •2.12. Определение уровня с-пептида в сыворотке крови.
- •2.13. Измерение биохимических показателей в сыворотке крови экспериментальных животных.
- •2.14. Определение показателей крови у экспериментальных животных.
- •2.15. Гистологический анализ образцов.
- •2.16. Реактивы.
- •2.17. Статистическая обработка результатов.
- •3.1. Изучение структурно - функциональных свойств островков поджелудочной железы неонатальных поросят и кроликов in vitro
- •3.3. Использование флуоресцентного красителя DiОc18 для идентификации трансплантата островков поджелудочной железы.
- •3.4. Изучение влияния ксенотрансплантации островков поджелудочной железы интрапортально и внутриселезеночно на функцию печени и селезенки
- •3.4.1. Влияние интрапортальной ксенотрансплантации островков поджелудочной железы на функциональное состояние печени
- •3.4.2. Влияние внутриселезеночной ксенотрансплантации островков поджелудочной железы на функциональное состояние селезенки
- •Заключение
- •Список использованной литературы
2.16. Реактивы.
В работе были использованы реактивы марки х.ч. и ч.д.а. раствор Хэнкса, глутамин (Россия), канамицин и бензилпенициллин натриевой соли (Львовфарм, Украина), среда 199 (ВетМед, Украина), глюкоза (Реахим, Украина), ксилазин (Эстония), кетамин, физиологический раствор, формалин, уксусная кислота, цитрат натрия, дитизон, диметилсульфоксид (Украина), Гемоглан и Глюкотест (Норма, Украина), БСА, Нереs, аллоксан тетрагидрат, гемостатическая губка, коллагеназа типа IA, фиколл, трипановый синий (Sigma, США).
2.17. Статистическая обработка результатов.
Статистическую обработку результатов проводили по методу Стьюдента - Фишера [19, 40, 43] при использовании непарного критерия Стьюдента и однофакторного дисперсионного анализа с помощью программного приложения Excel. Данные представлены как среднее значений, полученных в 2-х аналогичных экспериментах и измеренных в 2-х параллельных, стандартная ошибка; достоверными считались отличия при р < 0,01 и р < 0,05.
РАЗДЕЛ ІІІ
СОБСТВЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1. Изучение структурно - функциональных свойств островков поджелудочной железы неонатальных поросят и кроликов in vitro
Исследование структурно - функциональных свойств ОПЖ полученных от неонатальных кроликов и неонатальных поросят в разные сроки культивирования является актуальным и недостаточно изученным вопросом.
По мнению ряда авторов эмбриональные и неонатальные ткани значительно лучше и дольше переживают в условиях культуры, чем ткани взрослых животных [19, 183, 273]. Кроме того, эмбриональные и неонатальные ткани могут длительное время переживать в условиях in vitro без добавления ростовых факторов за счёт продукции и накопления в среде культивирования собственных ростовых факторов. Следует отметить, что частая замена среды приводит к вымыванию из эксплантата факторов роста. Ткани, полученные от эмбрионов и неонатальных животных, обладают большим потенциалом к делению, а добавление в культуру сыворотки, содержащей факторы роста, соматомедины, гормоны, медиаторы, кейлоны, релизинг- и ингибирующие факторы, способствует её интенсивному росту, сохранению структуры и функциональной активности эксплантатов в культуре [19, 211]. Известно, что фетальные и неонатальные клетки и ткани хорошо переживают в условиях гипоксии [313] и тепловой ишемии [118], способны к продукции полноценных гормонов в условиях in vitro [273, 309, 321].
Претрансплантационное культивирование ОПЖ неонатальных животных в условиях гипербарической оксигенации (95% О2) при 22 или 37°С является одним из основных способов снижения иммуногенности трансплантационного материала [44, 129]. Следует отметить, что Rutzky L.P. и соавторы с помощью иммуногистохимического мечения продемонстрировали исчезновение флуоресценции на 7 сутки культивирования островков, что свидетельствовало об элиминации дендритных клеток и клеток, экспресирующих главный комплекс гистосовместимости II класса [279]. Кроме иммуномодулирующего эффекта культивирование ОПЖ способствует восстановлению связей между островковыми клетками, которые были нарушены при травматической изоляции эндокринных клеток, обеспечивает β-клеточный рост, а также даёт возможность провести микробиологический скрининг графта [19, 129, 213]. Оптимальными условиями для культивирования фетальных и неонатальных ОПЖ является температура 37°С и 5% СО2 [44, 211, 268, 316]. Следует также отметить, что в организме животных разных видов и даже внутри одного вида клетки и ткани очень разнообразны в своем строении и функционировании [183, 238]. Поэтому необходимо было провести исследование структурно – функциональных особенностей ОПЖ неонатальных животных (поросят и кроликов) и выявить отличия, характерные для каждого вида животных, а также определить сроки переживания неонатальных ОПЖ в культуре.
В нашей работе мы изучали в сравнительном аспекте структурно - функциональные свойства островков, полученных из ПЖ неонатальных поросят и неонатальных кроликов, которые в дальнейших экспериментах использовались бы в качестве трансплантационного материала.
ОПЖ неонатальных животных мы получали путем механической и ферментативной обработки хвостовой части ПЖ, при этом не проводили специальной очистки полученной суспензии от ацинарных клеток.
На протяжении 8 суток культивирования мы осуществляли подсчёт ОПЖ обоих видов животных в надосадочной культуральной жидкости. На первые сутки культивирования ОПЖ неонатальных поросят надосадочная культуральная жидкость содержала 26,63 ± 4,50 × 104 островков/мл, а ОПЖ неонатальных кроликов – 12,00 ± 1,72 × 104 островков/мл (Рис. 3.1). На вторые сутки культивирования было отмечено, что концентрация ОПЖ неонатальных поросят составляла 31,72 ± 2,84 × 104 островков/мл; а ОПЖ неонатальных кроликов – 5,25± 2,25 × 104 островков/мл. Важно отметить, что эти показатели оставались практически без изменения для обоих видов животных с третьих по восьмые сутки культивирования. Однако необходимо выделить, что концентрация ОПЖ неонатальных поросят была выше концентрации ОПЖ неонатальных кроликов в культуральной надосадочной жидкости на протяжении всего периода наблюдения (Рис. 3.1).
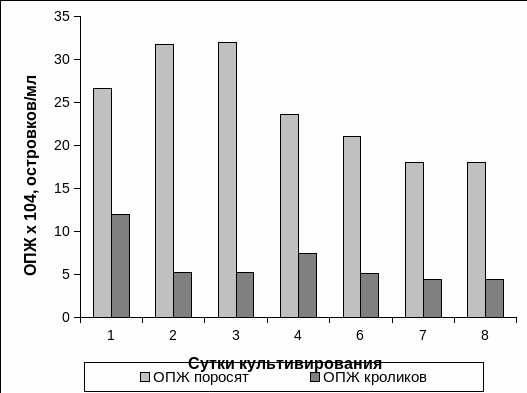
Рис. 3.1. Содержание островков поджелудочной железы неонатальных животных в надосадочной культуральной жидкости.
Примечание. * – отличия содержания ОПЖ достоверны между двумя видами животных, p<0,05.
В ходе проведения морфометрического анализа культур ОПЖ было установлено, что ОПЖ неонатальных кроликов практически полностью прикреплялись ко дну культуральной чашки, а во флотирующем состояние оставалось небольшое количество одиночных клеток и мелкие клеточные кластеры. Тогда как ОПЖ неонатальных поросят не прикреплялись ко дну культуральной чашки и в значительном количестве оставались свободно флотирующими в питательной среде на протяжении 8 суток культивирования.
В работе [213] были обнаружены данные, которые совпадают с полученными нами результатами о том, что культура, получаемая из ПЖ неонатальных поросят, состоит из двух фракций: флотирующей и прикрепленной ко дну культуральной чашки. При этом ОПЖ неонатальных поросят составляют свободно флотирующую фракцию.
Одним из основных показателей структурной целостности клеточных мембран ОПЖ неонатальных животных является способность этих клеток исключать трипановый синий - суправитальный краситель. Использование этого красителя позволяет провести оценку количества жизнеспособных ОПЖ, полученных путем ферментативного расщепления ПЖ неонатальных животных и сохранности жизнеспособности ОПЖ в различные сроки культивирования [58].
Изменение жизнеспособности ОПЖ обоих видов животных в разные сроки культивирования представлено на рис. 3.2.
На момент получения суспензии островковых клеток жизнеспособность ОПЖ неонатальных поросят и неонатальных кроликов была сходной и составляла 79,4±3,5% и 77,5±2,9% от общего количества клеток.
На вторые сутки культивирования отмечалось постепенное повышение жизнеспособности ОПЖ для обоих видов неонатальных животных, что, возможно, было связано с протеканием репаративных процессов в островковых клетках, а также восстановлением энергетической базы [19, 58], вследствие чего клетки приобретали способность исключать суправитальный краситель. Однако на шестые сутки культивирования наблюдалось снижение жизнеспособности ОПЖ обоих видов животных, и на восьмые сутки культивирования ОПЖ неонатальных поросят и кроликов этот показатель в среднем составлял 63,0±1,8% и 64,5±0,9% соответственно. Снижение жизнеспособности ОПЖ неонатальных животных, возможно, было связано с накоплением продуктов метаболизма в среде культивирования.
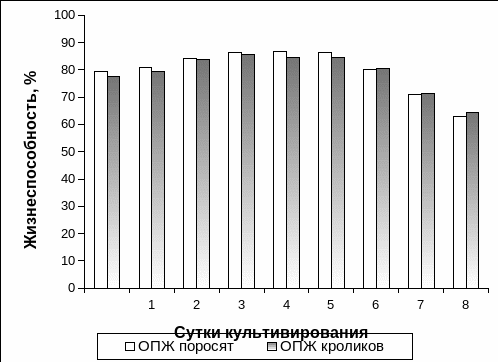
Рис. 3.2. Жизнеспособность островков поджелудочной железы неонатальных поросят и неонатальных кроликов в разные сроки культивирования.
Одним из основных показателей функционального состояния клеток на протяжении всего периода культивирования является исследование их базальной и стимулированной гормональной продукции [31, 128, 131, 220, 255].
В наших исследованиях мы провели изучение инсулинпродуцирующей способности ОПЖ на протяжении культивирования. Следует отметить, что инсулинпродуцирующая способность островков, как неонатальных поросят, так и неонатальных кроликов оставалась на достаточно высоком уровне на протяжении шести суток культивирования. Уровень содержания инсулина на первые сутки культивирования ОПЖ неонатальных поросят в среднем составлял 13,27 ± 2,18 мкМЕ/мл/ х 104 островков, а содержание инсулина в культуре ОПЖ неонатальных кроликов было достоверно выше и в среднем составляло – 20,30 ± 1,68 мкМЕ/мл/ х 104 островков (Рис. 3.3).
Концентрация инсулина в культурах ОПЖ неонатальных поросят и неонатальных кроликов не изменялась на протяжении шести суток культивирования и была сходной с уровнем инсулина в первые сутки культивирования. При изучении концентрации инсулина в среде культивирования мы установили, что в течение шести суток концентрация инсулина в культуре ОПЖ неонатальных кроликов была достоверно выше уровня инсулина, содержащегося в культуральной среде ОПЖ неонатальных поросят (Рис. 3.3).
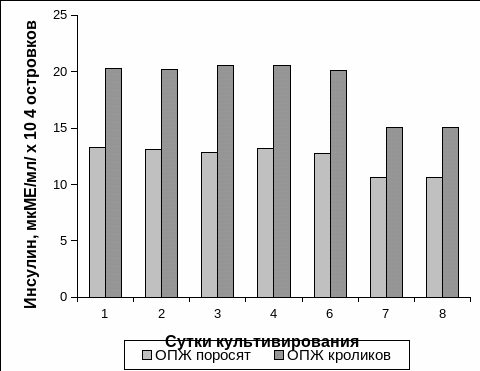
Рис. 3.3. Динамика изменения инсулинпродуцирующей способности в процессе культивирования островков поджелудочной железы неонатальных поросят и неонатальных кроликов.
Примечание. * – отличия достоверны между двумя видами ОПЖ, p<0,05.
На 7-8 сутки культивирования содержание инсулина снижалось в культурах ОПЖ обоих видов неонатальных животных, при этом достоверных отличий между двумя видами животных не было отмечено.
В культуре ОПЖ неонатальных поросят уровень инсулина на восьмые сутки в среднем составлял 10,64 ± 1,71 мкМЕ/мл/ х 104 островков, а в культуре ОПЖ неонатальных кроликов – 15,08 ± 3,03 мкМЕ/мл/ х 104 островков, что составляло соответственно 80% и 74% от значений первого дня культивирования (Рис. 3.3). Снижение уровня содержания инсулина в среде культивирования обоих видов неонатальных животных, вероятно, может быть связано с уменьшением питательных веществ и ростовых факторов, необходимых для нормального функционирования ОПЖ и накоплением продуктов метаболизма островковых клеток в среде культивирования.
В целом из полученных нами данных следует, что ОПЖ неонатальных поросят и неонатальных кроликов имеют относительно высокий инсулинпродуцирующий потенциал, который остается практически без существенных изменений на протяжении шести суток культивирования, что подтверждает концентрация инсулина в среде культивирования панкреатических островков.
Однако наши исследования показали, что культура ОПЖ неонатальных кроликов обладает большей инсулинпродуцирующей способностью, чем культура ОПЖ неонатальных поросят, возможно, это связано с тем, что при частичной замене питательной среды мы удаляли из культуры, свободно плавающие эндокринные клетки ПЖ неонатальных поросят. При рассмотрении рис. 3.1. было отмечено достоверное отличие количества островков неонатальных поросят в надосадочной жидкости по сравнению с панкреатическими островками неонатальных кроликов, так как они при культивировании прикрепляются ко дну культуральной чашки.
Важным моментом в достижении положительного клинического эффекта является степень жизнеспособности гормонопродуцирующих клеток в культурах, которая зависит от условий культивирования. Известно, что на начальных этапах культивирования в эндокринных клетках активируются метаболические процессы, которые приводят к их функциональному перенапряжению и развитию дистрофических процессов в цитоплазме клеток [31, 255].
При анализе литературы было обнаружено, что использование глюкозы во время культивирования способствует активации секреции инсулина β-клетками ОПЖ. Это в свою очередь обуславливает целесообразность использования глюкозы при выращивании культуры ОПЖ неонатальных поросят и неонатальных кроликов. В литературных данных встречаются доказательства того, что жизнеспособность β-клеток можно повышать добавлением глюкозы определенной концентрации в питательную среду при культивировании, что приводит к стимулированию секреции инсулина β-клетками островков Лангерганса [31, 131, 220]. В ткани ПЖ отмечается присутствие «выводных протоков», клеточные элементы которых содержат мелкие электронно плотные секреторные гранулы, являющиеся характерными для островковых клеток в культуре. Это позволяет рассматривать их как переходную форму между экзо - и эндокринными клетками. Вследствие чего, под действием глюкозы в культуре усиливаются процессы ацино-инсулярной трансформации, что является дополнительным источником образования β-клеток [125, 138, 231].
Однако необходимо отметить, что при культивировании ОПЖ важным является подбор такой концентрации глюкозы, которая не будет вызывать функционального перенапряжения β-клеток [31, 131, 255]. Известно, что 10 мМ и 16,7 мМ концентрации глюкозы не вызывают значительного синтеза инсулина, который связан с функциональным перенапряжением β-клеток, что при дальнейшей их трансплантации в период адаптации могло привести к значительному снижению их функциональной активности [31].
Считают, что при подборе условий получения, ферментативного расщепления и культивирования эндокринной ткани ПЖ особенно важным является сохранить не только её базальную гормональную функцию, но и способность адекватно отвечать на специфические стимулирующие факторы (глюкозу). В связи с этим в нашей работе необходимым является провести исследование секреторной активности ОПЖ неонатальных поросят и неонатальных кроликов в условиях активации секреции инсулина 10 мМ концентрации глюкозой.
Способность к стимулированной продукции инсулина ОПЖ двух видов неонатальных животных была изучена на восьмые сутки культивирования. При инкубации в питательной среде, содержащей 1,67 мМ концентрации глюкозы, продукция инсулина ОПЖ неонатальных поросят составляла 9,93 ± 5,46 мкМЕ/мл/ х 104 островков. При добавлении в питательную среду культивирования глюкозы в концентрации 10 мМ и в течении 1 часа инкубации при 37°С содержание инсулина резко возрастало до 98,78 ± 17,59 мкМЕ/мл/ х 104 островков (Рис. 3.4).
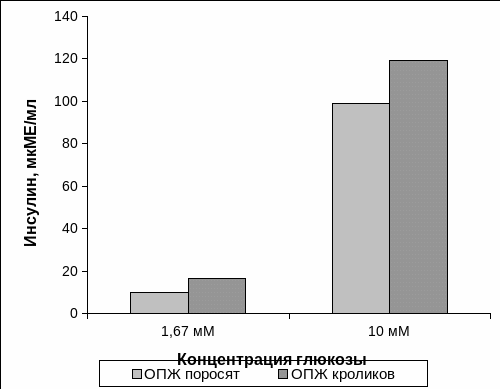
Рис. 3.4. Инсулинпродуцирующий потенциал островков поджелудочной железы неонатальных поросят и неонатальных кроликов в среде культивирования с различным содержанием глюкозы.
Примечание. * – отличия достоверны по сравнению со значениями нсулина в среде с 1,67 мМ глюкозы, p<0,05.
Важно отметить, что стимулированный 10 мМ глюкозой уровень инсулина в культуре ОПЖ неонатальных кроликов составил 119,08 ± 11,74 мкМЕ/мл/ х 104 островков при базальном содержании инсулина в культуре ОПЖ неонатальных кроликов – 16,60 ± 3,06 мкМЕ/мл/ х 104 островков.
Из представленных данных на рис. 3.4. видно, что при культивировании ОПЖ обоих видов неонатальных животных стимулированный уровень содержания инсулина был достоверно выше по сравнению со значениями инсулина в среде культивирования, которая содержала 1,67 мМ концентрацию глюкозы.
Следовательно, при использовании во время культивирования глюкозы стимулирующей 10 мМ концентрации в среде инкубации наблюдался адекватный секреторный ответ ОПЖ обоих видов животных, что свидетельствует о способности β-клеток адекватно отвечать на стимулирующий сигнал. При этом важно указать, что 10 мМ концентрация глюкозы не вызывала перенапряжение клеток. Однако в работе [31] представлены данные, согласно которым 22 мМ концентрация глюкозы вызывает функциональное перенапряжение клеток, и как следствие β-клетки и ОПЖ не могут адекватно реагировать на введение глюкозы в культуральную среду.
На разных этапах получения ОПЖ неонатальных животных (ферментативная и механическая обработка панкреатической ткани, культивирование) (см. РАЗДЕЛ МАТЕРИАЛЫ И МЕТОДЫ) мы не проводили их специальной очистки от ацинарных клеток, которые способны синтезировать и секретировать панкреатические ферменты, такие как панкреатическая α-амилаза [259].
П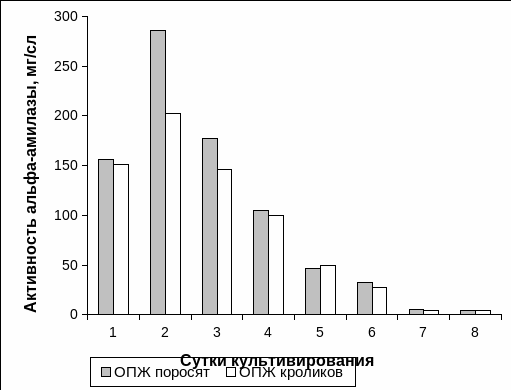 оэтому,
следующей задачей в нашей работе было
оценить активность α–амилазы в разные
сроки культивирования ОПЖ неонатальных
животных. На
первые
сутки культивирования ОПЖ концентрация
α - амилазы в среднем составляла 155,6±14,9
мг/с·л – в культуре ОПЖ неонатальных
поросят, и 151,1±15,6 мг/с·л – в культуре
ОПЖ неонатальных кроликов. Однако на
вторые сутки отмечалось резкое повышение
активности α-амилазы в 1,9 и в 1,3 раза в
культуральной среде ОПЖ неонатальных
поросят и неонатальных кроликов. Возможно
резкое повышение активности панкреатической
α–амилазы в среде инкубации ОПЖ
неонатальных животных на вторые сутки
культивирования связано с лизисом
ацинарных клеток и выходом фермента в
среду инкубации. Так как с третьих суток
наблюдалось постепенное снижение
активности α-амилазы в среде инкубации
ОПЖ неонатальных поросят и кроликов,
которая в среднем составляла 176,7±9,4
мг/с·л и 146,1±6,3 мг/с·л соответственно
(Рис. 3.5).
оэтому,
следующей задачей в нашей работе было
оценить активность α–амилазы в разные
сроки культивирования ОПЖ неонатальных
животных. На
первые
сутки культивирования ОПЖ концентрация
α - амилазы в среднем составляла 155,6±14,9
мг/с·л – в культуре ОПЖ неонатальных
поросят, и 151,1±15,6 мг/с·л – в культуре
ОПЖ неонатальных кроликов. Однако на
вторые сутки отмечалось резкое повышение
активности α-амилазы в 1,9 и в 1,3 раза в
культуральной среде ОПЖ неонатальных
поросят и неонатальных кроликов. Возможно
резкое повышение активности панкреатической
α–амилазы в среде инкубации ОПЖ
неонатальных животных на вторые сутки
культивирования связано с лизисом
ацинарных клеток и выходом фермента в
среду инкубации. Так как с третьих суток
наблюдалось постепенное снижение
активности α-амилазы в среде инкубации
ОПЖ неонатальных поросят и кроликов,
которая в среднем составляла 176,7±9,4
мг/с·л и 146,1±6,3 мг/с·л соответственно
(Рис. 3.5).
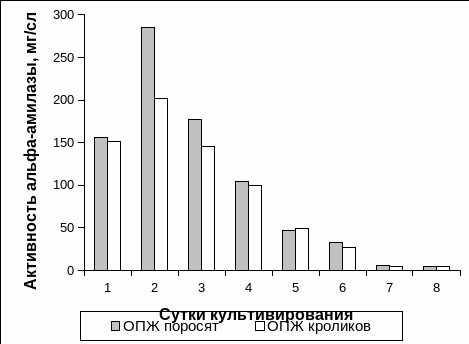
Рис. 3.5. Активность α-амилазы в среде культивирования островков поджелудочной железы неонатальных поросят и неонатальных кроликов.
Примечание: * – отличия достоверны между двумя видами ОПЖ, p<0,05.
На 7-8 сутки культивирования активность α–амилазы в среде инкубации культур ОПЖ обоих видов неонатальных животных снижалась до минимума, и на восьмые сутки в среднем составляла 4,8 ± 1,5 мг/с·л – для ОПЖ неонатальных поросят, 4,4 ± 1,7 мг/с·л – для ОПЖ неонатальных кроликов (Рис. 3.5). Это свидетельствует о деструкции экзокринных клеток во время культивирования.
В литературе встречаются данные, согласно которым ацинарные клетки плохо переживают в процессе культивирования и являются очень чувствительными к глюкозе, которая, вероятно, способствует их разрушению на ранних этапах культивирования и выходу панкреатического фермента в среду культивирования [259].
Полученные нами данные, касающиеся инсулинпродуцирующей способности ОПЖ, а также способность адекватно отвечать ОПЖ обоих видов животных на стимулирующие сигналы доказывает тот факт, что ацинарные клетки в среде культивирования и продуцируемые ими панкреатические ферменты не оказывают негативного влияния на функциональные свойства неонатальных ОПЖ обоих видов животных.
Проведенная нами сравнительная морфологическая и функциональная оценка состояния ОПЖ неонатальных поросят и неонатальных кроликов позволяет сделать заключение о том, что данный эндокринный материал представляет собой островковоподобные клеточные кластеры, которые обладают высокой инсулинпродуцирующей активностью, а также способностью адекватно отвечать на изменение концентрации глюкозы в среде культивирования. При этом абсолютные значения секреции инсулина были выше в культуре ОПЖ неонатальных кроликов по сравнению с ОПЖ неонатальных поросят. Следует также отметить, что при использованном методе получения больший выход островков наблюдался из ПЖ неонатальных поросят.
Однако наличие высокой активности α-амилазы в культурах ОПЖ неонатальных поросят и неонатальных кроликов на 1-4 сутки культивирования подтверждают присутствие в культурах ацинарных клеток. Вследствие этого на следующем этапе нашей работы необходимо было провести выделение в ступенчатом градиенте плотности фиколла ОПЖ из суспензии, полученной из панкреатической ткани неонатальных животных (см. РАЗДЕЛ МАТЕРИАЛЫ И МЕТОДЫ).
При разделении в ступенчатом градиенте плотности фиколла суспензии клеток из ПЖ неонатальных поросят и неонатальных кроликов образовывались три клеточные фракции. Однако наблюдались некоторые отличия в разделении суспензии панкреатических клеток по плотностям фиколла между видами неонатальных животных. При разделении суспензии панкреатических клеток неонатальных поросят в градиенте фиколла были получены три клеточные фракции в слоях фиколла с плотностями - 1,089, 1,094 и 1,100 г/см3 (Рис. 3.6 а). Разделение суспензии клеток ПЖ неонатальных кроликов в градиенте фиколла также показало образование трех фракций клеток в слоях фиколла с плотностями 1,080, 1,089 и 1,100 г/см3 (Рис. 3.6 б).


1
 ,089
г/см3
1,080г/см3
,089
г/см3
1,080г/см3
 1,089
г/см3
1,089
г/см3
1 ,094 г/см3
1 ,100 г/см3 1,100 г/см3
а б
Рис. 3.6. Разделение суспензии клеток, полученных из ПЖ неонатальных поросят (а) и неонатальных кроликов (б), в ступенчетом градиенте плотности фиколла.
Проведение микроскопического исследования биологического материала, полученного из разных фракций фиколла, показало, что в слое фиколла с плотностью 1,100 г/см3 находились разного размера ацинарные клетки неонатальных поросят и неонатальных кроликов. При разделении суспензии панкреатических клеток неонатальных поросят в слое фиколла с плотностью 1,094 г/см3 были обнаружены одиночные клетки (Рис. 3.7 а), а при разделении клеточной суспензии ПЖ неонатальных кроликов одиночные клетки находились в слое фиколла с плотностью 1,089 г/см3 (Рис. 3.7 б).

а б
Рис. 3.7. Одиночные клетки неонатальных поросят (а), которые были обнаружены в слое фиколла с плотностью 1,094 г/см3 и неонатальных кроликов (б), которые были обнаружены в слое фиколла с плотностью 1,089 г/см3. Ок. 10, об. 20 (а) и 40 (б).
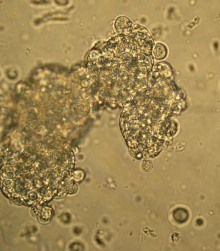
В слое фиколла с плотностью 1,089 г/см3 находились ОПЖ и одиночные клетки неонатальных поросят (Рис. 3.8 а), а ОПЖ и одиночные клетки неонатальных кроликов были обнаружены в слое фиколла с плотностью 1,080 г/см3 (Рис. 3.8 б).
В слое фиколла с плотностью 1,040 г/см3 при разделении суспензии клеток обоих видов неонатальных животных находился дебрис и деструктурированные клетки.
а б
Рис. 3.8. ОПЖ и одиночные клетки неонатальных поросят (а), обнаруженые в слое фиколла с плотностью 1,089 г/см3 и ОПЖ неонатальных кроликов (б), обнаруженые в слое фиколла с плотностью 1,080 г/см3. Ок. 10, об. 40.
Таким образом, было установлено присутствие ОПЖ и β-клеток неонатальных поросят в слоях фиколла с плотностью 1,089-1,094 г/см3, а неонатальных кроликов в слоях фиколла с плотностью 1,080-1,089 г/см3.
В работе [308] показано, что ОПЖ и β-клетки неонатальных поросят находятся в слое фиколла с плотностями 1,060-1,096 г/см3, что в целом совпадало с нами полученными данными. В литературных источниках встречаются данные, согласно которым эмбриональные островковые клетки кроликов, при разделении в ступенчатом градиенте плотности находятся в слое фиколла с плотностями 1,045-1,075 г/см3 [63]. Однако, основными способами выделения β-клеток и ОПЖ неонатальных кроликов являются: 1) наслаивание суспензии, полученной из ПЖ на градиент фиколла (перколла) с плотностью 1,040 г/см3, что позволяет очистить суспензию только от дебриса и деструктурированных клеток [95]; 2) способ получения островковых клеток без использования ферментативной обработки, методов очистки, фильтрации и центрифугирования [83], в основе которого лежит миграция одиночных β-клеток из фрагментов ПЖ в культуральную среду, однако получение ОПЖ этот способ не предусматривает.
Дитизон является красителем, который специфически окрашивает инсулинсодержащий аппарат живых β-клеток, образуя в них дитизонат цинка, который представляет собой пурпурно-красную зернистость, более выражено реакция с дитизоном протекает в кластероподобных β-клеточных структурах [147, 296]. Необходимо отметить, что окраска более выражена в гранулярном аппарате клеток и в меньшей степени в её цитоплазме. Дитизон способен селективно окрашивать панкреатические β-клетки мышей, кроликов, собак, свиней и человека [148, 296]. Цинк необходим в островковых β-клетках для упаковки инсулина в секреторных гранулах, интегральная часть инсулина кристаллизуется с двумя ионами цинка, образуя гексамер, также имеется свободно ионизирующий цинк в экстрагранулярном пространстве, который представляет собой резерв для гранулярного цинка [144]. Селективно комплексируя цинк дитизон позволяет идентифицировать β-клетки, которые обладают инсулинпродуцирующей способностью [296].
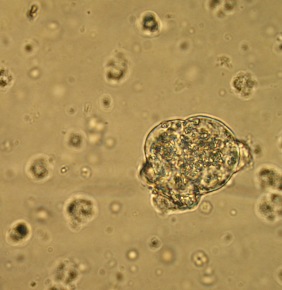
Гистохимическое исследование срезов ткани ПЖ неонатальных поросят с помощью специфического дитизон – содержащего раствора позволило выявить большое количество ОПЖ, которые содержали дитизонат цинка в виде пурпурно - красной зернистости, особенно в центре островков. При этом ОПЖ располагались диффузно между ацинарной тканью, которая не прокрашивалась дитизоном (Рис. 3.9)
Рис. 3.9. Гистопрепарат ПЖ неонатального поросенка. Окраска дитизоновым раствором. Ок. 10, об. 40.
При разделении суспензии клеток ПЖ неонатальных поросят в ступенчатом градиенте плотности фиколла были получены несколько клеточных фракций в слоях фиколла с плотностями 1,089, 1,094 и 1,100 г/см3.
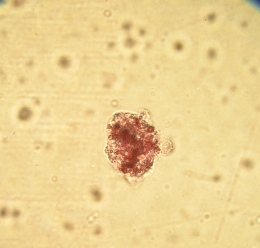
Окрашивание дитизоном материала фракций фиколла различной плотности показало, что во фракции фиколла с плотностью 1,089 г/см3 находились дитизон - позитивные клеточные кластеры и одиночные клетки, при этом раствор дитизона полностью прокрашивал гранулярный аппарат островков Лангерганса и β клеток, свидетельствуя про наличие инсулинпродуцирующих клеток в этих культурах (Рис. 3.10 а). На 4 сутки культивирования дитизон - позитивные ОПЖ и β-клетки неонатальных поросят, выделенные из слоя фиколла с плотностью 1,089 г/см3, также были идентифицированы, при этом значительное количество ОПЖ находилось в свободно флотирующем состоянии (Рис. 3.10 б), что подтверждало ранее полученные данные, согласно которым ОПЖ неонатальных поросят остаются свободно флотирующими в питательной среде [213]. Микроскопическое исследование дна чашки Петри в этой же культуре ОПЖ неонанатльных поросят показало наличие прикрепленных ко дну мелких дитизон-позитивных клеток.
а б
Рис. 3.10. Дитизон – окрашенные ОПЖ неонатальных поросят на момент получения (а) и на 4 сутки культивирования (б), выделенных из фракции фиколла с плотностью 1,089 г/см3. Ок. 10, об. 40.
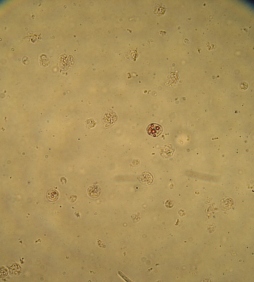
При окрашивании раствором дитизона и проведении микроскопического исследования материала, полученного из суспензии клеток ПЖ неонатальных поросят в слое фиколла с плотностью 1,094 г/см3, были обнаружены флотирующие (Рис. 3.11 а) и прикрепленные ко дну (Рис. 3.11 б) одиночные клетки и мелкие клеточные конгломераты, некоторые из них имели пурпурно - красную зернистость, а остальные не прокрашивались на протяжении 8 суток культивирования.

а б
Рис. 3.11. Одиночные клетки неонатальных поросят во флотирующем состояние (а) и прикрепленные ко дну культуральной чашки, прокрашенные раствором дитизона, выделенные из слоя фиколла с плотноситью 1,094 г/см3. Ок. 10, об. 40.
При получении ОПЖ неонатальных кроликов путем ферментативного расщепления (коллагенизации) панкреатической ткани и разделения в градиенте плотности фиколла, было обнаружено образование трех клеточных фракций в слоях с плотностью 1,080, 1,089 и 1,100 г/см3. Каждую из полученных фракций фиколла окрашивали дитизоном на момент получения и на 4 сутки культивирования.
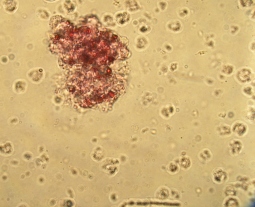
Во фракции фиколла с плотностью 1,080 г/см3 были обнаружены ОПЖ неонатальных кроликов, имеющие пурпурно - красную окраску, что свидетельствовало про наличие в них инсулинопродуцирующих β-клеток (Рис. 3.12 а).
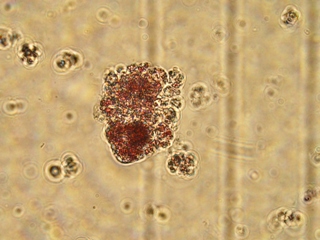
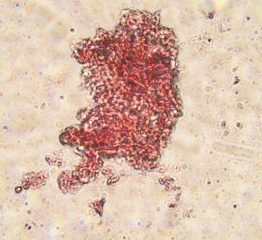
Рис. 3.12. Дитизон – окрашенные ОПЖ неонатальных кроликов на момент получения (а) и на 4 сутки культивирования (б), выделенных из фракции фиколла с плотностью 1,080 г/см3. Ок. 10, об. 40.
Необходимо отметить, что на 4 сутки культивирования ОПЖ неонатальных кроликов, выделенные из фракции фиколла с плотностью 1,080 г/см3, окрашивались дитизоном и были прикреплены ко дну чашки Петри (Рис. 3.12 б). Однако небольшая фракция флотирующих одиночных клеток и мелкие клеточные кластеры из этого же слоя также имели темно – красные гранулы, это подтверждало ранее полученные данные, согласно которым ОПЖ неонатальных кроликов прикрепляются ко дну культуральной чашки, а в свободно флотирующем состояние остаются одиночные клетки, в основном β-клетки, которые могут кооперироваться друг с другом в культуре, образуя дуплеты, триплеты и мелкие кластеры [95].
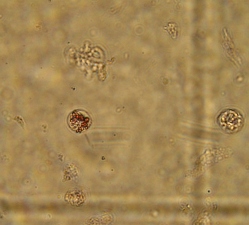
Во фракции фиколла с плотностью 1,089 г/см3 как на момент получения ОПЖ неонатальных кроликов (Рис. 3.13 а), так и на 4 сутки культивирования (Рис. 3.13 б) были обнаружены прикрепленные ко дну прокрашенные и непрокрашенные дитизоном одиночные клетки и небольшие клеточные конгломераты. Во флотирующем состояние обнаруживалась небольшая количество клеток, выделенных из этого же слоя фиколла, которые практически не прокрашивалась дитизоном.

а б
Рис. 3.13. Дитизон – окрашенные одиночные клетки неонатальных кроликов на момент получения (а) и и мелкие клеточные кластеры на дне культуральной чашки на 4 сутки культивирования (б), выделенные из слоя фиколла с плотностью 1,089 г/см3. Ок. 10, об. 40.
Следует отметить, что в слое фиколла с плотностью 1,100 г/см3 неонатальных поросят и неонатальных кроликов были обнаружены мелкие и крупные клетки, возможно, ацинарные, так как они не окрашивались дитизоном как на момент получения, так и на протяжении всего периода культивирования, что сидетельствовало об отсутствие в этой клеточной фракции инсулинпродуцирующих клеток, при этом клетки находились в прикрепленном и флотирующем состоянии (Рис. 3.14).
ОПЖ неонатальных поросят и неонатальных кроликов, содержащие гранулярный аппарат β-клеток, имеющий пурпурно-красную окраску при окрашивании дитизон, обнаруживались при культивировании до восьмых суток.
Рис. 3.14. Клетки неонатальных поросят, выделенные из слоя фиколла с плотностью 1,100 г/см3, на четвертые сутки культивирования. Нет специфической окраски дитизоном. Ок. 10, об. 20.
Таким образом, большая фракция дитизон – позитивных клеток и ОПЖ при разделении их в градиенте плотности фиколла были обнаружены в случае использования суспензии клеток ПЖ неонатальных поросят во фракции с плотностью 1,089 г/см3, а неонатальных кроликов во фракции с плотностью 1,080 г/см3. При этом в условиях in vitro большая часть ОПЖ неонатальных поросят находилась во флотирующем состоянии, а ОПЖ неонатальных кроликов были прикреплены ко дну культуральной чашки.
Идентификация в культурах ОПЖ неонатальных животных большого количества дитизон – позитивных клеток является доказательством наличия огромного инсулипродуцирующего потенциала у β-клеток и позволяет заключить, что ОПЖ неонатальных животных могут быть использованы в дальнейшем при трансплантации животным с экспериментальным СД 1 типа.
Таким образом, полученный нами биологический материал, содержащий ОПЖ и β- клетки, может быть использован для дальнейшей алло- и ксенотрансплантации с целью замещения утраченной эндокринной функции собственной железы и поддержания гормонального статуса у животных с экспериментальным СД 1 типа.
По результатам данного раздела 3.1. опубликованы следующие работы:
1. Сравнительное изучение инсулинпродуцирующей способности островков поджелудочной железы новорожденных поросят и новорожденных кроликов in vitro / Скрипниченко (Колот) Н.В., Божок Г.А., Бондаренко Т.П. // Вісник Харківського національного уніаерситету ім. В.Н. Каразіна: Серія – Біологія. – 2006. – Вип. 4 – № 748. – С. 159-163.
2. Морфофункціональна характеристика клітинних культур підшлункової залози новонароджених поросят / Скрипниченко (Колот) Н.В., Божок Г.А. // Збірник тез І міжнародної наукової конференції молодих вчених «Біологія: від молекули до біосфери». – м. Харків, 2006. – С. 80.
3. Вивчення та порівняння інсулінпродукуючої властивості культур острівців підшлункової залози новонароджених поросят та новонароджених кролів / Колот Н.В., Божок Г.А., Бондаренко Т.П. // Збірник тез доповідей ІІІ міжнародної наукової конференції студентів та аспірантів «Молодь та поступ біології». – м. Львів, 2007. – С. 470.
3.2. Алло - и ксенотрансплантация островков поджелудочной железы неонатальных животных в различные сайты организма кроликов с экспериментальным сахарным диабетом 1 типа
Трансплантация инсулинпродуцирующих β-клеток или ОПЖ является физиологическим способом, который позволяет создать в организме реципиента эндогенный «источник» полноценных гормонов, способных осуществлять физиологическую регуляцию метаболизма [53, 102, 214, 316]. Дефицит аллогенного материала для трансплантации с неизбежностью привел к использованию β-клеток или ОПЖ ксеногенной природы [68, 101, 219, 245, 323]. Наибольшее внимание уделяется таким донорским источникам для трансплантации изолированных β-клеток или ОПЖ как поросята [102, 179, 273, 308, 316, 321] и кролики [63, 84, 97, 110, 268, 269]. Использование β-клеток или ОПЖ, полученных из ПЖ неонатальных поросят, связано с их анатомическим и физиологическим сходством с ПЖ человека. Молекула инсулина свиньи отличается лишь по одной аминокислоте от человеческого инсулина и совпадает по антигенным особенностям [273, 308, 309, 316].
Однако возможность использования в качестве эндокринного материала - β-клеток или ОПЖ от доноров отдаленного филогенетического родства (поросята и кролики) для лечения СД в клинике остается недостаточно изученной.
По данным литературы трансплантация ОПЖ в иммунопривилегированные органы реципиента способствует длительному выживанию графта, поскольку предупреждает развитие клеточных и гуморальных реакций, направленных на повреждение графта и обеспечивает длительное поддержание нормогликемии [126, 207, 256, 269]. Подбор оптимального места для трансплантации ОПЖ в организме реципиента позволяет обеспечить длительное выживание трансплантата без использования иммуносупрессивной терапии. В мировой литературе встречаются данные отличающиеся по наличию антидиабетического эффекта и длительности выживания трансплантата после трансплантации сингенных, аутогенных и аллогенных β-клеток или ОПЖ в такие сайты как портальная вена печени [117, 288, 293], селезенка [146, 180, 181, 201, 237, 304, 310, 324], капсула почки [116, 120, 191, 226, 241], тестисы [156, 256], костный мозг [159, 283]. Недостаточно изученным остается вопрос, касающийся подбора иммуновыгодных сайтов в организме реципиента для β-клеток или ОПЖ ксеногенного происхождения.
В нашей работе мы провели исследования в сравнительном аспекте влияния сайтов трансплантации ОПЖ (селезенка, портальная вена, паренхима печени, костный мозг, капсула почки, семенник, внутривенно) на показатели углеводного обмена и сроки выживания ОПЖ неонатальных поросят и неонатальных кроликов в организме половозрелых кроликов с экспериментальным СД 1 типа.
Выбор данных сайтов трансплантации был обусловлен следующим. Литературные данные сидетельствуют о том, что трансплантация аллографтов ОПЖ под капсулу почки крысам с экспериментальным диабетом позволяет поддерживать нормогликемию в организме реципиента на протяжении 6 месяцев [324], изографты ОПЖ в данном сайте функционируют на протяжении 13-18 месяцев [226]. При этом ксенотрансплант ОПЖ взрослых свиней функционировал в течение 53 суток под капсулой почек обезьян с экспериментальным диабетом [277].
Интрапортальная АлТц ОПЖ при использовании комбинированной иммуносупрессивной терапии, исключающей глюкокортикоиды, позволяет поддерживать нормогликемию в организме больных СД 1 типа, отодвигает или предупреждает развитие вторичных осложнений диабета, способствует снижению инсулинопотребности длительного периода времени [117, 288, 293]. Однако механизм распределения ОПЖ в организме реципиента после интрапортальной трансплантации пока еще не известен. В литературе встречаются данные, согласно которым после интрапортальной трансплантации ОПЖ взрослых свиней происходит быстрая потеря графта за счет развития иммунного ответа в организме реципиента [130, 313].
При трансплантации ауто- [116, 201, 237, 310], алло- [146] и изографтов [312] ОПЖ в пульпу селезенки животным с экспериментальным диабетом с или без использования иммуносупрессивной терапии наблюдалось длительное выживание ОПЖ в селезенке. Фетальные ОПЖ человека функционировали на протяжении 4 месяцев после КсТц в пульпу селезенки крыс с аллоксановым диабетом [136]. Возможно, длительное выживание ОПЖ в пульпе селезенки связано с наличием обильного кровоснабжения этого органа и с функцией депонирования крови [249].
Тестисы являются иммунопривилегированным сайтом для трансплантации, так как в них происходит экспрессия Fas L и CD40 L, а их взаимодействие с Fas и CD40 молекулами, а также присутствие CD 30 – апоптического сигнала повышает апоптоз Т-лимфоцитов, участвующих в иммунном отторжении трансплантата [145, 156, 178, 256]. В некоторых работах встречаются данные, согласно которым у некоторых видов животных (грызуны) CD8 Т-клетки памяти резистентны к апоптозу и могут экспрессировать антиапоптические молекулы, при этом на 4 неделе посттрансплантационного периода наблюдается потеря аллографта [292].
Изографты и аллографты ОПЖ введенные в костный мозг крыс с экспериментальным диабетом без использования иммуносупрессивной терапии способствовали длительному поддержанию нормогликемии в организме животных – реципиентов [159, 283].
Трансплантация ОПЖ непосредственно в паренхиму печени была использована для изучения фактора влияния на ОПЖ гепатоцитов, которые являются непосредственной мишенью действия инсулина. Введение ОПЖ внутривенно было использовано для изучения длительности функционирования ОПЖ при введении в общий кровоток.
Экспериментальный СД 1 типа у животных – реципиентов вызывали однократным внутривенным введением раствора аллоксана тетрагидрата (см. РАЗДЕЛ МАТЕРИАЛЫ И МЕТОДЫ). Известно, что введение раствора аллоксана, который является производным мочевой кислоты, приводит к массовой гибели β-клеток островков Лангерганса. Аллоксан и его восстановленный продукт диалуровая кислота селективно попадают в клетки панкреатических островков, в основном β-клетки, где вступают в редокс – цикл с образованием супероксидных радикалов, подвергающиеся дисмутации в перекись водорода и попадая под влияние реакции Фентона преобразовываются в высокореактивные гидроксильные радикалы. Действие активных соединений кислорода и гидроксильных радикалов с одновременным повышением внутриклеточной концентрации ионов Са2+ приводят к алкилированию ДНК панкреатических эндокринных клеток и обуславливают быструю гибель β-клеток путем апоптоза или некроза [36, 325, 331]. Необходимо отметить, что введение аллоксана сопровождается активацией ПОЛ, которое имеет аутокаталитический механизм, приводящий к высокой продукции токсических и реактивных метаболитов альдегида и накоплению свободных радикалов, вызывая оксидативную деструкцию клеточных мембран и клеточную гибель [80, 325, 331]. В здоровом организме присутствует защитный антиоксидантный механизм, включающий в себя внутриклеточные ферменты, такие как супероксиддисмутаза, глутатион, каталаза, и внеклеточные неферментативные вещества (уремическая кислота, глюкоза, билирубин, трансферин, церулоплазмин) [139, 334]. СД 1 типа вызывает нарушение действия антиоксидантной системы, способствуя накоплению свободных радикалов и приводя к оксидативному стрессу в организме [325, 331].
В первые 2-4 часа после введения диабетогенной дозы раствора аллоксана блокируется выход инсулина из островковых β-клеток, что способствует увеличению уровня глюкозы в крови, вторая фаза действия аллоксана на клетку сопровождается селективным повреждением β-клеточных мембран и освобождением большого количества инсулина из секреторных гранул, при этом в организме развивается тяжелая гипогликемия, которая длится около 16-24 часов. Инсулин в свою очередь очень быстро разрушается в крови и через 30 часов после введения аллоксана начинается выраженная инсулиновая недостаточность и стойкая гипергликемия [36].
При проведении нашей работы на первые сутки после введения раствора аллоксана диабетогенной концентрации погибло 10% животных в результате развития у них тяжелого гипогликемического состояния, а в течение первой недели погибло около 20% кроликов от развития острой гипергликемии и тяжелых диабетических осложнений (Рис. 3.15). У животных на 7-8 сутки после введения им раствора аллоксана развивалась гипергликемическая кома, сопровождающаяся глюкозурией, от животных исходил резкий запах ацетона.
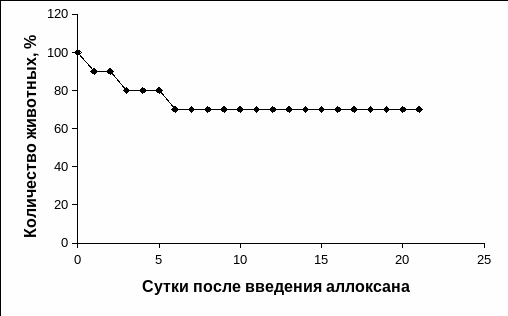
Рис. 3.15. Показатель выживаемости животных после однократного введения диабетогенной дозы раствора аллоксана.
Изучение динамики гликемии уже на 4 сутки после внутривенного введения раствора аллоксана показало у 80% кроликов достоверное повышение уровня глюкозы в крови по сравнению с исходными значениями, при этом уровень глюкозы в среднем составлял 10,16±0,88 ммоль/л (Рис. 3.16). С 4 суток наблюдалось постепенное повышение содержания глюкозы в крови экспериментальных животных.
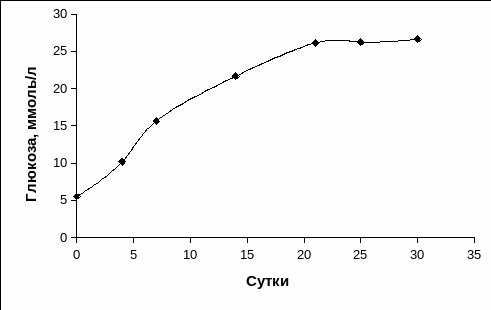
Рис. 3.16. Динамика гликемии у кроликов после введения диабетогенной дозы раствора аллоксана.
Примечание. * - отличия достоверны по отношению к исходному уровню глюкозы, p<0,05.
К концу второй недели наблюдения у животных с экспериментальным СД 1 типа помимо прогрессирующей гипергликемии наблюдались и другие признаки СД 1 типа: полидипсия, полифагия, глюкозурия, выпадение шерсти, потеря массы тела, животные становились малоподвижными.
На 21 сутки после введения аллоксана у кроликов наблюдалась гипергликемия, составляющая в среднем 26,11±2,03 ммоль/л, находясь в пределах этих значений и на 25-30 сутки, что было охарактеризовано как стойкая гипергликемия (Рис. 3.16). Следует отметить, что стойкая гипергликемия и другие признаки диабета сохранялись у животных с экспериментальным СД 1 типа до момента их гибели. Исходя из полученных данных динамики гипергликемии, мы считали, что 21 сутки после однократной инъекции раствора аллоксана являлись оптимальным сроком для проведения трансплантации ОПЖ.
Необходимо отметить, что реакция на однократное введение аллоксана в популяции животных была различна. У 20% экспериментальных животных на 14 сутки после развития гипергликемии наблюдалась ремиссия экспериментального диабета и уровень глюкозы с 14,90±1,90 ммоль/л снижался до 9,81±0,75 ммоль/л, а к 21 суткам уровень глюкозы возвращался к значениям, характерным для интактных животных, оставаясь на уровне контроля в течение последующего периода. В связи с этим для дальнейших экспериментов мы использовали животных, у которых уровень глюкозы находился не ниже 19-20 ммоль/л.
В наших исследованиях мы считали необходимым оценить у животных с экспериментальным диабетом не только динамику гликемии, но и другие показатели (массу тела, уровень глюкозы в моче), изменение которых характерно для оценки присутствия в организме СД 1 типа (Таблица 1).
Таблица 1. Масса тела и глюкозурия после внутривенной инъекции раствора аллоксана.
Показатели животных |
Сутки после введения аллоксана |
||||
0 |
7 |
14 |
21 |
30 |
|
Масса тела, кг |
2,91±0,22 |
2,61±0,23 |
2,47±0,13# |
2,32±0,33# |
2,31±0,20# |
Глюкоза в моче, % |
0,00±0,00 |
1,30±0,16* |
1,73±0,07* |
1,99±0,01* |
1,98±0,02* |
Примечания: * - отличия достоверны по отношению к исходным значениям, p<0,05, # - отличия достоверны по отношению к исходным значениям, p<0,01.
Из данных, представленных в таблице 1, видно, что наряду с повышением уровня глюкозы в крови наблюдается появление значительного количества глюкозы в моче у кроликов с экспериментальным СД 1 типа по сравнению с интактной группой животных. Это свидетельствует о присутствии в организме кроликов нарушений в процессе фильтрации и развития почечной недостаточности, вследствие СД 1 типа на 21-30 сутки после однократной инъекции аллоксана.
У интактных животных глюкоза в моче не обнаруживалась в течение всего периода наблюдения.
После введения аллоксана наблюдалось постепенное снижение массы тела животных (Таблица 1), при этом на 21 сутки масса тела животных уменьшалась в 1,2 раза по сравнению с исходными значениями. Снижение массы тела животных, развитие гипергликемии и глюкозурии к 21 суткам посталлоксанового периода подтверждает, что у животных в организме развивается СД 1 типа.
Для определения срока начала развития нарушений в углеводном обмене у животных после введения диабетогенной дозы аллоксана целесообразно было провести тест толерантности к глюкозе.
Следует отметить, что у кроликов до введения раствора аллоксана при однократной углеводной нагрузки наблюдалось классическое изменение гликемии с пиком на 30 минуте и восстановление уровня глюкозы в крови на 90 минуте до нормальных значений (Рис. 3.17), что свидетельствовало о нормальном протекание углеводного обмена. На 7 сутки после введения раствора аллоксана у животных гликемическая кривая изменялась подобно интактным животных, хотя уровень глюкозы был выше. На 14 сутки после введения аллоксана и на протяжении последующего периода (до 42 суток) при проведении теста толерантности к глюкозе у животных с экспериментальным СД 1 типа отмечалось нарушение хода гликемической кривой, при этом кривые имели сглаженный характер (Рис. 3.17).
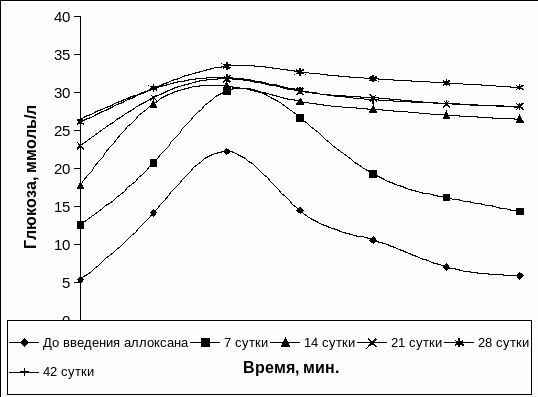
Рис. 3.17. Гликемические кривые при однократной нагрузке глюкозой у животных до введения аллоксана и с экспериментальным СД 1 типа.
Примечание. * - отличия достоверны относительно интактных животных, р<0,05.
Известно, что при СД 1 типа развивается полная инсулиновая недостаточность [34, 47, 90], поэтому мы считали необходимым оценить изменение содержания инсулина в сыворотке крови кроликов с аллоксан-индуцированным диабетом. Инсулин в сыворотке крови кроликов до и после введения раствора аллоксана определяли иммуноферментным способом.
На рис. 3.18. представлена динамика инсулина у кроликов в посталлоксановый период. На 4 сутки отмечалось постепенное снижение содержания инсулина в сыворотке крови, которое в среднем составляло 9,03±1,16 мкМЕ/мл, тогда как исходный уровень инсулина в среднем составлял 23,24±3,97 мкМЕ/мл (Рис. 3.18). Концентрация инсулина в крови на 21 сутки в среднем составляла 2,05±1,15 мкМЕ/мл, что было на границе чувствительности метода определения гормона, который определяли с помощью ИФА, DRG Diagnostic. Следует отметить, что на 30 сутки после введения аллоксана животным инсулин в крови не определялся.
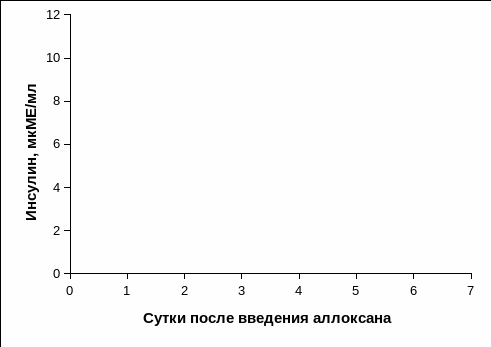
Рис. 3.18. Динамика инсулина в сыворотке крови кроликов с экспериментальным СД 1 типа до и после введения диабетогенной дозы аллоксана.
Примечание. * - отличия достоверны по отношению к исходным значениям, p<0,05.
АлТц и КсТц ОПЖ неонатальных животных проводили на 21 сутки после введения животным - реципиентам диабетогенной дозы раствора аллоксана.
В течение всего посттрансплантационного периода мы проводили определение массы тела животных, уровня глюкозы в крови и моче, содержания гликозилированного гемоглобина (HbA1c), уровня инсулина и С-пептида в сыворотке крови экспериментальных животных, а также проводили тест толерантности к глюкозе на поздних сроках посттрансплантационного периода.
Выживаемость животных после проведения АлТц и КсТц ОПЖ неонатальных животных в целом была выше, чем после введения диабетогенной дозы аллоксана. В 10% случаев гибель животных наступала из-за передозировки наркоза и гиперактивности самих животных. Следует отметить, что после трансплантации ОПЖ в селезенку, под капсулу почки, в семенник, внутривенно, в паренхиму печени выживаемость животных в посттрансплантационный период была 100%. Однако после трансплантации ОПЖ в портальную вену и в костный мозг гибель животных составляла 10% на первые сутки посттрансплантационного периода и была связана с развитием внутреннего кровотечения.
После АлТц и КсТц ОПЖ неонатальных животных нормогликемия была достигнута при пересадке ОПЖ в портальную вену, в паренхиму печени, в селезенку, в костный мозг, в семенник и под капсулу почки. При АлТц и КсТц ОПЖ неонатальных животных внутривенно не было достигнуто нормогликемии, уровень глюкозы не опускался ниже 13,20±0,20 и 15,45±0,25 ммоль/л соответственно.
Ускоренная динамика восстановления нормального уровня глюкозы (на 7 сутки после АлТц и КсТц ОПЖ) отмечалась при пересадке островков в селезенку. В остальных экспериментальных условиях уровень глюкозы нормализовался на 14 сутки после АлТц и КсТц ОПЖ, достоверно не отличаясь от значений интактных животных, и в среднем составлял в портальную вену – 5,38±0,31 и 6,52±0,53 ммоль/л, в паренхиму печени – 5,70±0,35 и 6,75±0,78 ммоль/л, под капсулу почки – 7,33±0,26 и 7,35±0,50 ммоль/л, в костный мозг - 6,23±0,22 и 6,97±0,46 ммоль/л соответственно (Рис. 3.19 а, б).
АлТц и КсТц ОПЖ в семенник характеризовались замедленным восстановлением нормогликемии, и только на 20 сутки посттрансплантационного периода уровень глюкозы у этой группы животных составлял в среднем 8,20±0,20 и 8,25±0,25 ммоль/л (Рис. 3.18 а, б).
У интактной группы животных уровень глюкозы в крови составлял в среднем 5,95±0,50 ммоль/л.
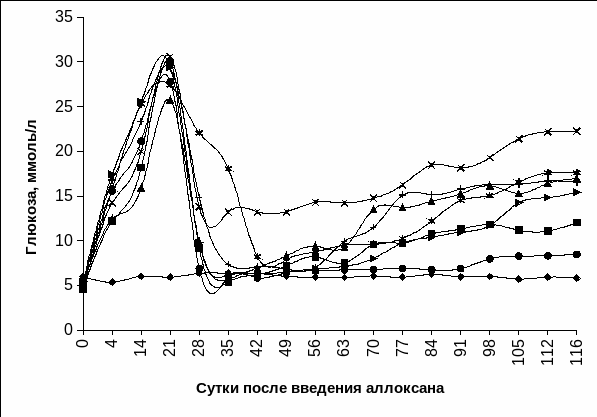 Рис.
3.19 а Динамика гликемии кроликов интактных
(1) и с экспериментальным СД 1 типа после
АлТц ОПЖ неонатальных кроликов: в
селезенку (2), в портальную вену (3), в
костный мозг (4), в паренхиму печени (5),
под капсулу почки (6), в семенник (7),
внутривенно (8).
Рис.
3.19 а Динамика гликемии кроликов интактных
(1) и с экспериментальным СД 1 типа после
АлТц ОПЖ неонатальных кроликов: в
селезенку (2), в портальную вену (3), в
костный мозг (4), в паренхиму печени (5),
под капсулу почки (6), в семенник (7),
внутривенно (8).
Примечание. * - отличия достоверны относительно интактных животных, р<0,01.
На 28 сутки после КсТц ОПЖ в паренхиму печени наблюдалось повторное повышение уровня глюкозы в крови в среднем до 9,30±0,32 ммоль/л, а после АлТц ОПЖ в паренхиму печени повторное увеличение гликемии до 9,40±0,15 ммоль/л обнаруживалось на 35 сутки. Следует отметить, что на 98 сутки посттрансплантационного периода уровень глюкозы у этих групп животных составлял 16,95±0,21 и 17,20±0,20 ммоль/л, а к 120 суткам увеличивался до 20-22 ммоль/л.
После интратестикулярной и субкапсулярной КсТц ОПЖ уровень гликемии начинал повышаться на 35 сутки и в среднем составлял 10,05±0,15 и 9,75±0,25 ммоль/л соответственно. Увеличение уровня глюкозы в крови наблюдалось на 42 сутки у экспериментальных животных с аллотрансплантатами в семеннике и под капсулой почки до 9,50±0,50 и 9,92±0,2 ммоль/л соответственно. На 98 сутки после АлТц и КсТц ОПЖ в семенник и под капсулу почки уровень глюкозы составлял в среднем 17,60±0,10 и 19,10±0,50 ммоль/л, 16,68±0,18 и 16,45±0,25 ммоль/л соответственно, а к 120 суткам уровень глюкозы у этих групп животных повышался до 20-21 ммоль/л.
Повышение гликемии после интрапортальной АлТц и КсТц ОПЖ было обнаружено на 49 сутки посттрансплантационного периода, при этом уровень гликемии в среднем составлял 9,58±0,68 и 9,88±0,50 ммоль/л, а на 98 сутки – 12,05±0,93 и 12,43±1,17 ммоль/л соответственно (Рис. 3.19 а, б), оставаясь в пределах этих значений на протяжении 120 суток.
Увеличение гликемии наблюдалось на 56 сутки у животных с экспериментальным СД 1 типа после АлТц и КсТц ОПЖ неонатальных животных в костный мозг в среднем до 9,75±0,35 и 10,15±0,36 ммоль/л соответственно, а на 98 сутки посттрансплантационного периода уровень глюкозы в крови составлял 15,43±0,30 и 16,9±0,40 ммоль/л соответственно.
В случае введения ОПЖ неонатальных кроликов и неонатальных поросят в селезенку уровень глюкозы оставался в пределах нормальных значений в течение 70 суток, при этом уровень глюкозы у экспериментальных животных в среднем составлял 6,88±0,24 и 6,92±0,53 ммоль/л соответственно. Следует отметить, что у животных после внутриселезеночной АлТц и КсТц ОПЖ уровень глюкозы в крови не превышал 9 ммоль/л весь последующий период наблюдения. Такой уровень глюкозы в крови является показателем легкой степени диабета в организме животных – реципиентов.
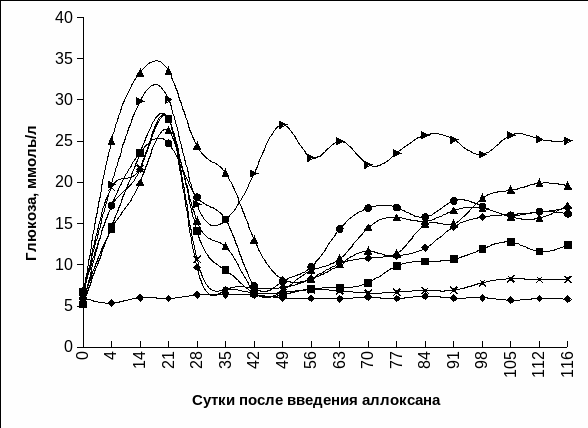 Рис.
3.19 б. Динамика гликемии кроликов интактных
(1) и с экспериментальным СД 1 типа после
КсТц ОПЖ неонатальных кроликов: в
селезенку (2), в портальную вену (3), в
костный мозг (4), под капсулу почки (5), в
паренхиму печени (6), в семенник (7),
внутривенно (8).
Рис.
3.19 б. Динамика гликемии кроликов интактных
(1) и с экспериментальным СД 1 типа после
КсТц ОПЖ неонатальных кроликов: в
селезенку (2), в портальную вену (3), в
костный мозг (4), под капсулу почки (5), в
паренхиму печени (6), в семенник (7),
внутривенно (8).
Примечание. * - отличия достоверны относительно интактных животных, р<0,01.
Уровень глюкозы на протяжении всего периода наблюдения у кроликов с экспериментальным СД 1 типа, которым не осуществляли трансплантацию ОПЖ неонатальных животных, не опускался ниже 20-24 ммоль/л, что являлось показателем тяжелой степени СД 1 типа, кроме гипергликемии у этой группы животных присутствовали все клинические признаки диабета (полиурия, полидипсия, полифагия, глюкозурия, потеря массы тела), а также отмечалась гибель животных.
В качестве контроля изучали уровень глюкозы у ложнооперированных животных и у ложнооперированных животных с экспериментальным диабетом, при этом в каждый из вышеуказанных сайтов организма вместо ОПЖ вводили питательную среду, на которой получали островки, её объём был равен объёму трансплантационного материала. У ложнооперированных животных на протяжении 98 суток уровень глюкозы не изменялся и в среднем составлял 5,71±0,60 ммоль/л, тогда, как у ложнооперированных кроликов с экспериментальным СД 1 типа содержание глюкозы в среднем составляло 23,65±1,24 ммоль/л.
Таким образом, на основе полученных нами результатов на двух видах неонатальных животных было установлено, что АлТц и КсТц ОПЖ в селезенку и портальную вену обладают длительным гипогликемическим эффектом в организме животных с экспериментальным СД 1 типа.
Одним из показательных методов выявления скрытых нарушений углеводного обмена, а также способа функциональной оценки ОПЖ в посттрансплантационный период является проведение теста толерантности к глюкозе. При изучении динамики гликемии после однократной углеводной нагрузки у интактных животных были определены время и доза глюкозы для получения классической гликемической кривой, приемлемые для кроликов, содержащихся в условиях вивария ИПКиК НАН Украины. Данные, полученные на интактных кроликах, показали, что повышение и восстановление уровня глюкозы в крови до нормальных значений происходит через 90 минут после однократного внутривенного введения глюкозы, концентрация которой составляла 0,5 г на кг массы тела животного. В литературе мы обнаружили данные, совпадающие с нами полученными результатами [111].
У интактных животных была получена классическая гликемическая кривая с пиком на 30 минуте после внутривенного введения раствора глюкозы и снижением до близкого к исходному уровню к 90 минуте исследования. Тест толерантности к глюкозе был проведен на 90 сутки кроликам с экспериментальным СД 1 типа после АлТц и КсТЦц ОПЖ (Рис. 3.20 а, б).
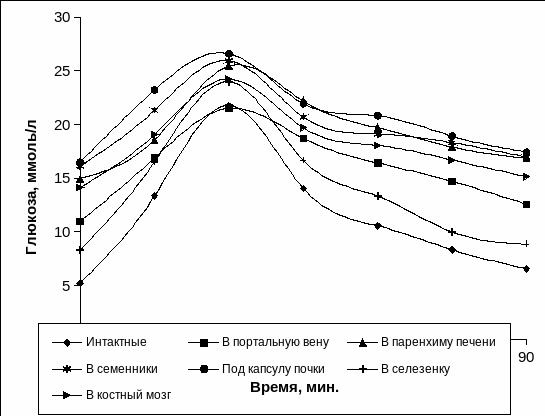
Рис. 3.20 а. Гликемические кривые при однократной нагрузке глюкозой у интактных и животных с АлТц ОПЖ в различные сайты организма.
Примечание. * - отличия достоверны относительно интактных животных, р<0,05.
Животных с внутривенной АлТц и КсТц ОПЖ для проведения теста углеводной нагрузки не использовали, так как исходный уровень гликемии у них к моменту исследования превышал нормальные значения в 4-5 раз и в среднем составлял 22,15±0,15 и 24,55±0,25 ммоль/л соответственно.
Гликемическая кривая изменялась подобно контрольной группе у животных с алло - и ксенографтами ОПЖ неонатальных животных в селезенке и в портальной вене печени (Рис. 3.20 а, б). Однако значения глюкозы в случае АлТц и КсТц ОПЖ в портальную вену и в селезенку были повышены.
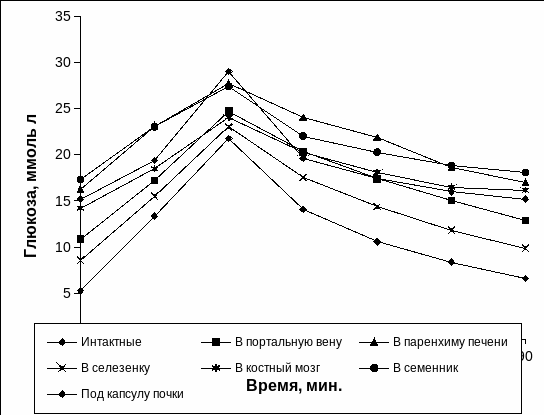
Рис. 3.20 б. Гликемические кривые при однократной нагрузке глюкозой у интактных и животных с КсТц ОПЖ в различные сайты организма.
Примечание. * - отличия достоверны относительно интактных животных, р<0,05.
Сглаженный характер кривой растянутой во времени постгликемической фазой свидетельствовал о нарушении толерантности к глюкозе у животных с алло - и ксенотрансплантатами ОПЖ в костном мозге, под капсулой почки, в семеннике и в паренхиме печени (Рис. 3.19 а, б).
Тест толерантности к глюкозе проводили и в группах ложнооперированных животных на 90 сутки после введения им вместо трансплантата питательной среды с антибиотиками. В условиях углеводной нагрузки у ложнооперированных животных наблюдалось изменение гликемической кривой подобно интактным животным, являясь показателем того, что введение среды 199 в изучаемые сайты организма не приводит к нарушению углеводного обмена у животных. Необходимо отметить, что тест толерантности к глюкозе не проводили в группах ложнооперированных животных с экспериментальным СД 1 типа, так как уровень глюкозы у них был выше 20-22 ммоль/л на протяжении всего периода наблюдения.
По данным литературы [47, 90] и в ходе проведения наших исследований было установлено, что экспериментальный СД 1 типа сопровождается потерей массы тела у животных. Вследствие этого мы считали необходимым оценить изменение массы тела у кроликов после АлТц и КсТц ОПЖ в различны сайты организма.
В таблице 2 представлены данные, согласно которым на 7 сутки после оперативного вмешательства у животных наблюдалось незначительное снижение массы тела после всех видов АлТц и КсТц ОПЖ. К 28 суткам после проведения АлТц и КсТц ОПЖ в портальную вену, в паренхиму печени, в селезенку, в костный мозг, в семенник и под капсулу почки у животных наблюдалось постепенное увеличение массы тела. Повторное повышение уровня глюкозы в крови животных с алло - и ксенографтами ОПЖ способствовало повторному снижению массы тела. У животных после АлТц и КсТц ОПЖ в селезенку и в портальную вену повторного снижения массы тела не наблюдалось на протяжении всего периода наблюдения.
У кроликов с экспериментальным СД 1 типа после внутривенной АлТц и КсТц ОПЖ масса тела практически не изменялась, оставаясь на исходном уровне в течении всего посттрансплантационного периода.
У ложнооперированных животных с экспериментальным СД 1 типа на протяжении всего периода наблюдения не отмечалось повышения массы тела, тогда как у ложнооперированных животных без диабета масса тела изменялась подобно интактной группе животных.
Таблица 2. Масса тела кроликов (кг) с экспериментальным СД 1 типа после АлТц и КсТц ОПЖ неонатальных животных.
Сайт организма, в который проводили трансплантацию |
Сутки после трансплантации |
||||||
До тр. |
7 |
28 |
49 |
63 |
70 |
98 |
|
Масса тела, кг |
|||||||
Контроль
|
3,4±0,3 |
3,4±0,3 |
3,5±0,2 |
3,6±0,1 |
3,7±0,3 |
3,7±0,2 |
3,8±0,4 |
Диабет
|
2,4±0,1* |
2,4±0,2* |
2,3±0,3* |
2,4±0,2* |
2,3±0,3* |
2,2±0,2* |
2,3±0,4* |
АлТц в портальную вену |
2,9±0,1* |
2,8±0,3* |
3,3±0,2 |
3,5±0,1 |
3,3±0,2 |
3,4±0,2 |
3,4±0,3 |
АлТц в паренхиму печени |
2,7±0,2* |
2,6±0,1* |
3,3±0,2 |
3,2±0,2 |
3,0±0,3* |
3,0±0,2* |
2,9±0,1* |
АлТц в селезенку |
2,9±0,4* |
2,9±0,3* |
3,5±0,2 |
3,6±0,3 |
3,6±0,2 |
3,7±0,3 |
3,8±0,3 |
АлТц под капсулу почки |
2,5±0,1* |
2,4±0,1* |
3,2±0,1 |
3,3±0,3 |
3,0±0,3* |
3,0±0,3* |
2,9±0,2* |
АлТц в семенник |
2,6±0,1* |
2,5±0,2* |
3,2±0,2 |
3,0±0,1* |
2,9±0,2* |
2,8±0,2* |
2,8±0,1* |
АлТц в костный мозг |
2,4±0,1* |
2,2±0,2* |
3,1±0,1 |
3,3±0,2 |
3,2±0,2 |
3,0±0,1* |
2,9±0,2* |
АлТц внутривенно |
2,5±0,1* |
2,5±0,3* |
2,6±0,2* |
2,6±0,1* |
2,4±0,1* |
2,4±0,1* |
2,4±0,2* |
КсТц в портальную вену |
2,8±0,2* |
2,6±0,2* |
3,3±0,2 |
3,5±0,2 |
3,6±0,2 |
3,7±0,1 |
3,6±0,4 |
КсТц в паренхиму печени |
2,7±0,1* |
2,6±0,2* |
3,4±0,1 |
3,0±0,2* |
3,0±0,4* |
2,9±0,2* |
2,9±0,2* |
КсТц в селезенку |
2,8±0,4* |
2,7±0,4* |
3,2±0,3 |
3,3±0,2 |
3,4±0,2 |
3,5±0,2 |
3,5±0,3 |
КсТц под капсулу почки |
2,6±0,2* |
2,5±0,1* |
3,2±0,3 |
3,1±0,2 |
3,0±0,2* |
3,0±0,2* |
2,9±0,1* |
КсТц в семенник |
2,7±0,1* |
2,6±0,1* |
3,1±0,2 |
3,0±0,2* |
2,9±0,2* |
2,9±0,3* |
2,9±0,1* |
КсТц в костный мозг |
2,1±0,5* |
1,9±0,3* |
3,1±0,2 |
3,2±0,1 |
3,1±0,2 |
2,9±0,2* |
2,9±0,1* |
КсТц внутривенно |
1,9±0,1* |
1,9±0,2* |
1,8±0,1* |
1,9±0,1* |
1,9±0,1* |
1,8±0,1* |
1,9±0,2* |
Примечание. * - отличия достоверны относительно исходных значений, р<0,01.
Важным показателем СД 1 типа и развития тяжелого диабетического осложнения, нефропатии, является наличие гликозурии, которая является следствием снижения реабсорбции глюкозы в почечных канальцах и нарушения процессов фильтрации плазмы крови, и как следствие развития гломерулосклероза [4, 34, 47, 152].
Гликозурию определяли в моче всех экспериментальных групп животных каждую неделю на протяжении всего периода наблюдения. При этом у интактной группы животных глюкоза в моче не обнаруживалась, тогда как у животных с экспериментальным СД 1 типа содержание глюкозы в моче в среднем составляло 1,9±0,1%.
Следует отметить, что у ложнооперированных животных глюкоза в моче не обнаруживалась в течение 98 суток наблюдения, а у ложнооперированных кроликов с экспериментальным СД 1 типа содержание глюкозы в моче в среднем составляло 1,9±0,2%.
Уменьшение суточной гликозурии до полного её исчезновения наблюдалось в первый месяц у кроликов с экспериментальным СД 1 типа после АлТц и КсТц ОПЖ в портальную вену, в паренхиму печени, в селезенку, в семенник, под капсулу почки и в костный мозг. Однако с повторным ростом гликемии проявлялась гликозурия в группах животных с алло - и ксенотрансплантатами ОПЖ в портальной вене, в паренхиме печени, в семеннике, под капсулой почки, в костном мозге. После внутриселезеночной ОПЖ глюкоза в моче не обнаруживалась на протяжении всего периода наблюдения.
Уровень глюкозы в моче не опускался ниже 1,1-1,5% весь период наблюдения после внутривенных АлТц и КсТц ОПЖ (Таблица 3).
Таблица 3. Содержание глюкозы в моче у кроликов с экспериментальным СД 1 типа после АлТц и КсТц ОПЖ неонатальных животных.
Сайт организма, в который проводили трансплантацию |
Сутки после трансплантации |
|||||
До тр. |
7 |
21 |
35 |
49 |
98 |
|
Глюкоза, % |
||||||
Интактные |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
Диабет |
1,95±0,05* |
1,75±0,25* |
1,85±0,15* |
1,95±0,05* |
1,90±0,10* |
1,90±0,10* |
АлТц в портальную вену |
1,75±0,25* |
0,07±0,02* |
0,00±0,00 |
0,00±0,00 |
0,10±0,05* |
0,35±0,05* |
АлТц в паренхиму печени |
1,85±0,15* |
0,15±0,05* |
0,00±0,00 |
0,07±0,02* |
0,15±0,05* |
0,90±0,10* |
АлТц в селезенку |
1,93±0,04* |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
АлТц под капсулу почки |
1,95±0,03* |
0,40±0,09* |
0,00±0,00 |
0,00±0,00 |
0,28±0,03* |
0,83±0,03* |
АлТц в семенник |
1,95±0,05* |
0,85±0,25* |
0,00±0,00 |
0,00±0,00 |
0,15±0,05* |
0,75±0,25* |
АлТц в костный мозг |
1,92±0,03* |
0,20±0,04* |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,45±0,05* |
АлТц внутривенно |
1,90±0,10* |
1,10±0,10* |
1,20±0,10* |
1,20±0,20* |
1,30±0,20* |
1,60±0,20* |
КсТц в портальную вену |
1,90±0,10* |
0,10±0,05* |
0,00±0,00 |
0,00±0,00 |
0,15±0,02* |
0,38±0,02* |
КсТц в паренхиму печени |
1,90±0,05* |
0,37±0,08* |
0,00±0,00 |
0,27±0,09* |
1,03±0,12* |
1,40±0,20* |
КсТц в селезенку |
1,83±0,17* |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
КсТц под капсулу почки |
1,95±0,05* |
0,15±0,05* |
0,00±0,00 |
0,10±0,05* |
0,50±0,01* |
1,10±0,10* |
КсТц в семенник |
1,95±0,05* |
1,1±0,10* |
0,00±0,00 |
0,15±0,05* |
0,15±0,05* |
1,15±0,15* |
КсТц в костный мозг |
1,95±0,05* |
1,30±0,10* |
0,00±0,00 |
0,00±0,00 |
0,15±0,05* |
0,50±0,05* |
КсТц внутривенно |
1,90±0,10* |
1,50±0,10* |
1,90±0,10* |
1,55±0,05* |
1,75±0,05* |
1,90±0,10* |
Примечание. * - отличия достоверны относительно исходных значений, р<0,05.
Долгое время основным показателем эффективности терапии СД считалось определение уровня глюкозы натощак. Значение этого показателя часто неправомочно с точки зрения оценки компенсации заболевания, так как накануне анализа крови больному достаточно в течение суток соблюдать жесткую диету и уровень сахара в крови не будет отражать тяжелых нарушений углеводного обмена [172, 204]. В настоящее время при диагностике и лечении СД 1 типа большое внимание уделяется оценке содержания гликозилированного гемоглобина (HbA1c) в крови. Этот показатель позволяет выявить степень компенсации углеводного обмена в отдаленные сроки после трансплантации ОПЖ (3-4 месяца) [216, 264]. HbA1c образуется в результате неферментативного взаимодействия гемоглобина А с глюкозой крови, накапливаясь в эритроцитах в течение всего времени их существования (90-120 дней), при этом молекула глюкозы конденсируется с β-концевым валином β-цепи молекулы гемоглобина А. Установлено, что гликозилирование осуществляется через стадию образования альмидина, сравнительно нестойкого, «обратимого» соединения, затем посредством химического преобразования (преобразование Амадори) альмидин превращается в относительно стойкое, «необратимое» соединение кетоамин, который остается присоединенным к белку на весь период жизни. Гликозилированию подвергаются многие белки организма (белки крови, хрусталика глаза, почек, нервов, кровеносных сосудов). Скорость гликозилирования и количество гликозилированных белков зависит от величины и длительности гипергликемии [182]. Поэтому, HbA1c имеет прямую корреляцию с концентрацией глюкозы в крови и длительности «соприкосновения» глюкозы и эритроцитов, являясь интегрированным показателем компенсации углеводного обмена на протяжении последних 60-90 дней [172]. Наличие HbA1c свидетельствует о СД, а изменение его уровня помогает оценить эффективность лечения. Риск развития осложнений СД 1 типа напрямую связан с качеством проводимой терапии и достигаемого уровня компенсации диабета.
Согласно имеющимся данным, даже незначительное снижение уровня HbA1c (на 1%) обуславливает уменьшение риска развития микрососудистых осложнений, которые приводят к поражениям органов зрения, почек или нервной системы на 35%, макроваскулярных осложнений – на 25%, смертности в результате осложнений – на 25%, на 7% - показателя общей смертности, а также снижение на 18% частоты фатального и нефатального острого инфаркта миокарда [172, 216].
Таким образом, фракция HbA1c отражает степень контроля гликемии и состояние углеводного обмена на протяжении 3-4 месяцев и, соответственно, качество компенсации СД.
Содержание HbA1c в гемолизате крови определяли на 91 сутки после проведения АлТц и КсТц ОПЖ в различные сайты организма.
У интактных кроликов уровень HbA1c составлял 1,6±0,1% от общего гемоглобина, а у животных с экспериментальным СД 1типа – 17,9±0,5%, что в 11,2 раза превышало значения интактных животных, отражая развитие глубоких нарушений обменных процессов у этой группы животных.
Содержание HbA1c было повышено относительно интактной группы животных у кроликов после АлТц ОПЖ в 2,1 раза в портальную вену, в 3,4 раза в паренхиму печени, в 3,4 раза под капсулу почки, в 3,5 раза в семенник, в 2,6 раза в костный мозг, в 6,1 раза внутривенно (Рис. 3.21).
После внутриселезеночной АлТц и КсТц уровень HbA1c на 91 сутки наблюдения находился на уровне интактных животных и составлял 1,4319±0,34% и 1,84±0,67% соответственно от общего гемоглобина, что свидетельствовало про компенсацию углеводного обмена.
Уровень HbA1c у животных с КсТц превышал значения интактной группы животных: в портальную вену в 2,4 раза; в паренхиму печени в 4,4 раза; под капсулу почки в 3,6 раза; в семенник в 4,1 раза, в костный мозг в 3,4 раза; внутривенно в 8,2 раза (Рис. 3.21).
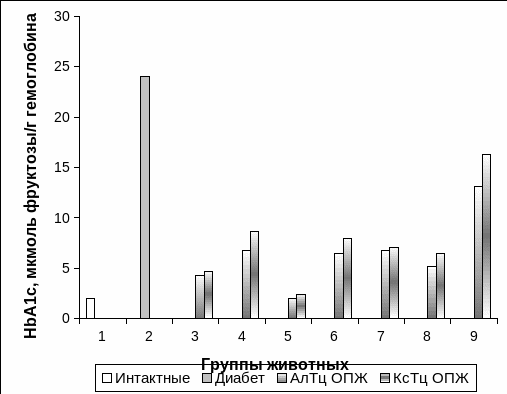
Рис. 3.21. Содержание HbA1c у интактных (1), у кроликов с экспериментальным СД 1 типа (2) и после АлТц и КсТц в портальную вену (3), после АлТц и КсТц в паренхиму печени (4), после АлТц и КсТц в селезенку (5), после АлТц и КсТц в семенник (6), после АлТц и КсТц под капсулу почки (7), после АлТц и КсТц в костный мозг, после АлТц и КсТц внутривенно.
Примечание. * - отличия достоверны относительно интактных животных, р<0,05.
В целом, у кроликов с трансплантатами ОПЖ уровень HbA1c был повышен относительно контроля, так как все животные перенесли стадию развития диабета.
Содержание HbA1c у ложнооперированных кроликов в среднем составляло 1,4±0,4%, а у ложнооперированных кроликов с экспериментальным СД 1 типа 15,5±1,5%.
Таким образом, введение «носителя» (питательной среды) в различные сайты организма не приводило к компенсации углеводного обмена при СД 1 типа, что еще раз подтверждало наличие антидиабетического эффекта трансплантации островков неонатального происхождения.
Полученные нами данные о содержании HbA1c соответствуют динамике изменения гликемии в крови экспериментальных животных и отражают наличие компенсации диабета за 3 месяца, подтверждая развитие более быстрого снижения уровня глюкозы в крови и нормализации углеводного обмена у после трансплантации ОПЖ.
Обобщая полученные результаты можно заключить, что эффективность АлТц и КсТц ОПЖ зависит от места ведения трансплантата. Наши экспериментальные данные показали, что компенсация углеводного обмена у животных с экспериментальным СД 1 типа происходит более эффективно после внутриселезеночной и интрапортальной АлТц и КсТц по сравнению с другими сайтами организма. Иммунологическая переференция этих органов и особенность их кровоснабжения играют важную роль в выживании островковых трансплантатов [249, 293].
Следует отметить, что после АлТц и КсТц ОПЖ в паренхиму печени, в костный мозг, в семенник и под капсулу почки происходит частичная компенсация углеводного обмена, о чем свидетельствует уровень HbA1c, который не превышал 7% на 3 месяц посттрансплантационного периода.
Внутривенная трансплантация ОПЖ является неэффективной, так как не позволяет нормализовать уровень глюкозы в крови и компенсировать нарушения углеводного обмена.
В нашей работе мы проводили изучение инсулинпродуцирующей способности трансплантационного материала в зависимости от места трансплантации на разных сроках посттрансплантационного периода.
Уровень инсулина в сыворотке крови интактной группы животных составлял в среднем 129,83±1,88 пМоль/л, а у кроликов с экспериментальным СД 1 типа на протяжении 98 суток был равен 39,15±4,01 пМоль/л. В группах животных с ложной операцией уровень инсулина находился в пределах контрольных значений и составлял 128,68 пМоль/л, тогда как у ложнооперированных с экспериментальным СД 1 типа – 38,95±3,91 пМоль/л.
На 7 сутки после внутриселезеночной КсТц ОПЖ концентрация инсулина в сыворотке крови в 2,5 раза превышала значения, установленные для интактной группы животных, и в среднем составляла 320,32±1,89 пМоль/л. После интрапортальной КсТц ОПЖ на 7 сутки посттрансплантационного периода содержание инсулина было в пределах контрольных значений и в среденм составляло 127,10±7,22 пМоль/л. Содержание инсулина на 7 сутки после проведения КсТц ОПЖ в семенник в 1,85 раза, под капсулу почки в 1,85 раза, в паренхиму печени в 1,57 раза, в костный мозг в 2,46 раза и внутривенно в 4,16 раза было ниже, чем у интактной группы животных (Рис. 3.22).
На 14 сутки после внутриселезеночной КсТц ОПЖ наблюдалось снижение уровня инсулина до 250,07±4,40 пМоль/л, сохраняясь на этом уровне до 70 суток. Начиная с 70 суток в группе животных с внутриселезеночным ксенографтом ОПЖ наблюдалось постепенное снижение уровня инсулина до 197,64±2,71 пМоль/л, а на 98 сутки до 158,47±3,14 пМоль/л, превышая в 1,2 раза значения интактного контроля (Рис. 3.22).
Интрапортальная КсТц ОПЖ на 14 сутки способствовала повышению уровня инсулина в крови в среднем до 178,02±3,61 пМоль/л, оставаясь в пределах этих значений до 49 суток. В последующий период наблюдалось постепенное снижение уровня инсулина в сыворотке крови до контрольных значений. Следует отметить, что после интрапортальной КсТц ОПЖ уровень инсулина не опускался ниже контрольных значений на протяжении всего периода наблюдений.
После КсТц ОПЖ на 14 сутки отмечалось повышение уровня инсулина в сыворотке крови в 1,5 раза – в паренхиму печени, в 1,2 раза – в костный мозг относительно контрольных животных, оставаясь на таком уровне до 35-42 суток соответственно. В последующий период у этих групп животных наблюдалось постепенное снижение концентрации инсулина в сыворотке крови до значений, характерных для группы животных с экспериментальным диабетом.
У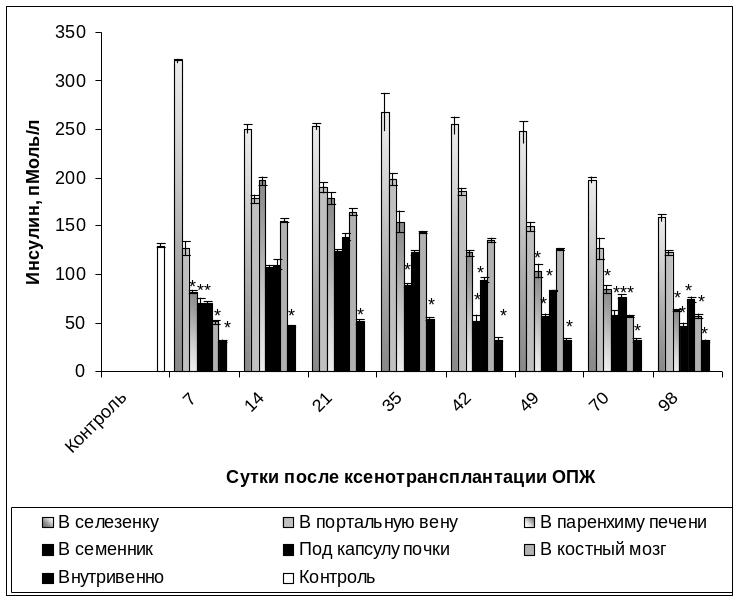 ровень
инсулина, начиная с 14 суток после КсТц
ОПЖ в семенник и под капсулу почки,
постепенно увеличивался и на 21 сутки
достигал значений, характерных для
контрольной группы. Однако на 35 сутки
после интратестикулярной и субкапсулярной
КсТц ОПЖ наблюдалось постепенное
снижение содержания инсулина в крови
до значений, отражающих присутствие СД
1 типа (Рис. 3.22).
ровень
инсулина, начиная с 14 суток после КсТц
ОПЖ в семенник и под капсулу почки,
постепенно увеличивался и на 21 сутки
достигал значений, характерных для
контрольной группы. Однако на 35 сутки
после интратестикулярной и субкапсулярной
КсТц ОПЖ наблюдалось постепенное
снижение содержания инсулина в крови
до значений, отражающих присутствие СД
1 типа (Рис. 3.22).
Рис. 3.22. Изменение уровня инсулина в сыворотке крови экспериментальных групп животных в различные сроки посттрансплантационного периода.
Примечание. * - отличия достоверны по сравнению с интактной группой животных, р<0,05.
Следует отметить, что у кроликов с внутривенным ксенотрансплантатом ОПЖ увеличение уровня инсулина не наблюдалось на протяжении 98 суток, при этом значения не превышали 54,11±1,77 пМоль/л (Рис. 3.22).
В целом, полученные данные свидетельствовали про наличие инсулинпродуцирующей способности ОПЖ, трансплантированных во все сайты организма, кроме внутривенного введения. При этом внутриселезеночная и интрапортальная КсТц ОПЖ приводила к нормализации уровня инсулина и показателей углеводного обмена у животных – реципиентов с экспериментальным СД диабетом 1 типа. При введении ОПЖ в паренхиму печени, в семенник, в костный мозг и под капсулу почки наблюдался краткосрочный эффект повышения инсулина.
Известно, что уровень С-пептида в сыворотке крови является показательным параметром, который подтверждает протекание процессов синтеза и секреции инсулина в организме [91, 276]. Однако изучение научной литературы свидетельствует о том, что С-пептид является очень мутабельным. В частности, С-пептид человека отличается от С-пептида свиньи 10 аминокислотными остатками и содержит на 2 аминокислоты меньше [111].
При определении С-пептида в сыворотке крови экспериментальных животных мы получили значения, которые были значительно ниже, чем в стандартных сыворотках. Так, в контроле были получены значения 24,68±7,86 пМоль/л. Это, возможно, было связано с низкой чувствительностью стандартного набора, предназначенного для определения С-пептида в сыворотке крови человека. Однако некоторая динамика в содержание С-пептида в сыворотке крови нами была отмечена (Таблица 4).
Содержание С-пептида в сыворотке крови кроликов с экспериментальным СД 1 типа в 3,9 раза был ниже, чем у интактных животных. В группе животных после внутриселезеночной КсТц ОПЖ уровень С-пептида находился в пределах контрольных значений, и максимальное его повышение в 6,2 раза наблюдалось на 35 сутки. После интрапортальной КсТц ОПЖ уровень С-пептида находился на уровне контроля на протяжении всего периода наблюдения. На 21-35 после КсТц ОПЖ в костный мозг, в паренхиму печени, в семенник и под капсулу почки наблюдалось увеличение уровня С-пептида в сыворотке крови, однако затем наблюдалось повторное снижение данного показателя. У кроликов с внутривенным ксенографтом ОПЖ уровень С-пептида в сыворотке крови не изменялся в течении 98 суток, оставаясь на уровне, характерном для животных с экспериментальным диабетом (Таблица 4).
Таблица 4. Содержание С-пептида в сыворотке крови кроликов после КсТц ОПЖ.
Сайт, в который осуществляли трансплантацию
|
Сутки после ксенотрансплантации ОПЖ |
||||
7 |
21 |
35 |
49 |
98 |
|
С-пептид, пМоль/л |
|||||
Контроль |
24,68±7,86 |
||||
Диабет |
6,25±1,13* |
||||
В селезенку |
13,35±1,01* |
21,79±1,78 |
148,97±11,52* |
65,70±13,01* |
22,61±6,35 |
В портальную вену печени |
14,40±1,86* |
20,49±1,75 |
24,73±1,08 |
16,26±0,74* |
11,60±2,06* |
В паренхиму печени |
10,50±0,55* |
19,61±4,83 |
10,67±2,59* |
9,17±0,61* |
4,73±1,11* |
В семенник |
6,22±0,37* |
10,65±0,41* |
10,34±0,71* |
7,24±1,08* |
4,72±0,50* |
Под капсулу почки |
8,24±0,72* |
75,93±3,34 |
9,10±1,02* |
8,93±0,72* |
7,93±0,10* |
В костный мозг |
12,63±1,39* |
25,93±1,49 |
23,63±0,68 |
11,28±0,95* |
10,14±1,18* |
В ушную вену |
7,19±1,73* |
8,03±1,77* |
6,94±0,71* |
5,59±1,25* |
3,10±1,02* |
Примечание. * - отличия достоверны по сравнению с интактной группой животных, р<0,05.
Анализ представленных данных показал, что выбор места гетеротопической трансплантации ОПЖ является очень важным. При проведении трансплантации ОПЖ необходимо учитывать специфические особенности регуляции и метаболизма трансплантируемого материала, а также иммуно - биологические свойства органа, в который была осуществлена трансплантация. Наилучшие результаты были получены при АлТц и КсТц ОПЖ неонатального происхождения в паренхиматозные органы селезенку и печень (через портальную вену). Кратковременная эффективность в снижении гипергликемии и регуляции углеводного обмена была показана в случаях трансплантации в костный мозг, в паренхиму печени, под капсулу почки и в семенник. Трансплантация островков в общий кровоток через ушную вену не показала положительного результата.
На следующем этапе нашей работы был проведен гистологический анализ органов, в которые производили трансплантацию ОПЖ, и собственных ПЖ животных - реципиентов.
На 98 сутки после внутрипеченочной трансплантации ОПЖ структура печени реципиента находится в дегенеративно – дистрофическом состоянии. Это выражается в том, что в сохраненных печеночных дольках наблюдается зернистая дистрофия гепатоцитов, микронекрозы, лимфоцитарная инфильтрация, что свидетельствует о потере трансплантата. Некоторые печеночные дольки разъединены и окружены прослойками соединительной ткани (Рис. 3.23). На фоне такой патологической картины при окраске гематоксилином и эозином трудно идентифицировать островковые клетки.
Рис. 3.23. Фрагмент печени в месте введения трансплантата. Окраска гематоксилином и эозином. Ок. 10, об. 40.
При исследовании печени после интрапортальной АлТц и КсТц не было обнаружено ОПЖ у реципиентов в месте введения, однако показатели углеводного обмена были на уровне, характерном для легкой степени диабета.
В ходе проведения гистологического анализа почки, семенника и костного мозга алло – и ксенотрансплантата ОПЖ обнаружено не было, как не было обнаружено и патологически измененных тканей данных органов.
На гистологическом препарате селезенки животных – реципиентов микроскопически определяется белая пульпа органа, содержащая лимфатические фолликулы. Среди лимфоидной ткани обнаруживаются округлые светло - окрашенные структуры, состоящие из соединительнотканных волокон, содержащие фибробласты. Между фибробластов определяются единичные клетки со светлой гомогенно - окрашенной цитоплазмой и округлыми пикнотическими ядрами. В некоторых структурах отсутствуют описанные клетки, и отмечается одна вакуолизация. Данные образования не характерны для гистостуктуры селезенки, что даёт основание предположить, что это фрагменты ксенотрансплантата, находящиеся в дегенеративном состоянии (Рис. 3.24). Однако, необходимо отметить, что у животных с внутриселезеночным алло – и ксенотрансплантатом на протяжении 98 суток уровень глюкозы в крови не превышал 9 ммоль/л, а уровень HbA1c достоверно не отличался от контрольных животных, что, возможно, связано с накоплением инсулина в обнаруженных нами структурах в пульпе селезенки, который, постепенно поступает в кровоток, и способствует поддержанию уровня глюкозы и инсулина в крови этой группы животных.
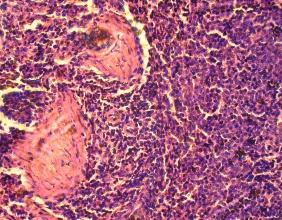
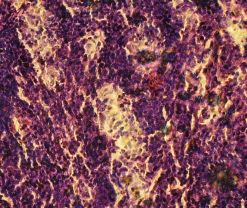
Рис. 3.24. Фрагмент селезенки кролика в месте введения ксенографта. Окраска гематоксилином и эозином. Ок. 10, об. 40.
В результате возникшей трудности идентифицировать трансплантат в пульпе селезенки при окраске гематоксилином и эозином мы проводили окрашивание этого же гистопрепарата селезенки дитизон – содержащим раствором, при этом в месте введения трансплантата были идентифицированы хорошо сохраненные ОПЖ, содержащие дитизонат цинка в виде пурпурно - красной зернистости (Рис. 3.25).
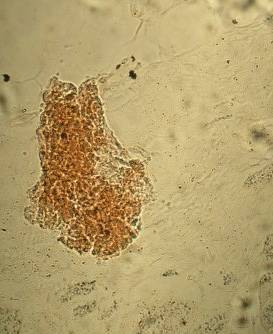
Рис. 3.25. Фрагмент селезенки с ксенографтом ОПЖ кролика. Окраска дитизон – содержащим раствором. Ок. 10, об. 40.
При окрашивании дитизоновым раствором гистологических срезов селезенки контрольного кролика пурпурно - красная зернистость не обнаруживалась (Рис. 3.26 а), а окрашивание ПЖ интактного кролика показало наличие дитизон - позитивных ОПЖ (Рис. 3.26 б).

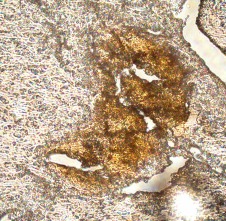
а б
Рис. 3.26. Фрагмент селезенки (а) и поджелудочной железы (б) интактного кролика. Окраска дитизон – содержащим раствором. Ок. 10, об. 40.
Таким образом, полученные нами данные при проведении гистохимического анализа подтверждают наличие островков в селезенки на 98 сутки после трансплантации ОПЖ неонатальных поросят. Окрашивание гематоксилином и эозином не показало наличие хорошо сформированных островков, что может быть связано с объёмом органа или трудностью идентифицировать островки среди лимфоидной ткани селезенки.
Следует отметить, что присутствие клеток, дающих позитивную окраску с дитизоном в месте трансплантации, было обнаружено лишь в случае пересадки ОПЖ внутриселезеночно. В остальных случаях, отсутствие трансплантата ОПЖ могло быть связано с невозможностью идентификации ОПЖ в большом объеме ткани (как в случае интрапортальной трансплантации) или с отсутствием трансплантата вследствие его разрушения, например, в результате иммунологического отторжения. В этом случае наличие в этом месте инфильтрации лимфоцитов и соединительной ткани указывало на отторжение пересаженных островков. В частности, подобная картина наблюдалась в месте трансплантации в паренхиму печени.
До сих пор, остается открытым вопрос о механизме влияния трансплантации ОПЖ на компенсацию СД 1 типа. В связи с этим для всестороннего анализа влияния трансплантации неонатальных ОПЖ на компенсацию экспериментального СД 1 типа нами было проведено гистологическое исследование собственных ПЖ реципиентов.
ПЖ интактного кролика представлена дольками с отчетливо выраженными контурами, которые разделены тонкими соединительнотканными прослойками. В дольках определяются ацинусы, располагающиеся радиально. Ацинусы состоят из плотно расположенных клеток пирамидальной формы, содержащие в базальной части гиперхромные округлые ядра, а апикальная их часть была направлена к центру. Цитоплазма ацнарных клеток окрашена гомогенно. Среди ацинусов выделяются островки Лангерганса, которые представляют собой клеточные конгломераты, имеющие более светлую окраску. Островки содержат неупорядочное скопление клеток, содержащих гипо – и гиперхромные ядра округлой формы. Установлено, что центральную часть островка занимают β-клетки, ответственные за синтез и секрецию инсулина, тогда как в краевых участках располагаются многочисленные α-клетки. Кровеносные сосуды в интактной ПЖ имеют нормальное кровенаполнение. На гистопрепарате были хорошо выражены клеточные контакты, что свидетельствовало о наличие взаимодействия между островковыми клетками (Рис. 3.27 а).
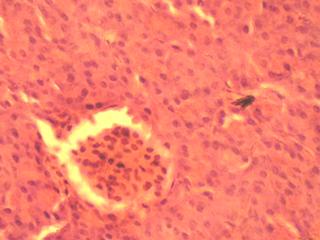
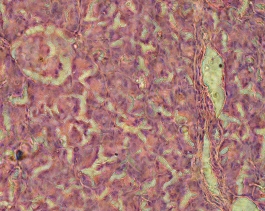
а б
Рис. 3.27. Фрагмент поджелудочной железы интактного (а) и половозрелого кролика с экспериментальным диабетом. Окраска гематоксилином и эозином. Ок. 10, об. 40.
В ПЖ кролика с экспериментальным СД 1 типа гистологически определяется разрастание соединительной ткани между дольками. Ацинусы располагаются не плотно друг к другу. В некоторых из них обнаруживаются лизированные клетки, а в некоторых клетки подверженные микронекрозу. На гистопрепарате отмечается сосудистая реакция в виде стазов. Между ацинусами определяются атрофические островки, содержащие дегенеративные клетки с кариолизисом, а вокруг них располагаются фибробласты. В некоторых островках наблюдается вакуолизация клеток, содержащие бледно – окрашенный материал, что было обуслолено гидропической деструкцией островковых клеток, в особенности β-клеток. В клетках центральной части островков отсутствовуют ядра, что свидетельствует о гибели инсулинпродуцирующих клеток (Рис. 3.27 б). Описанная структура ПЖ соответствует гистоструктуре органа животных, подвергшихся действию аллоксана, и соответствует структурным перестройкам при диабете.
Гистоструктура ПЖ реципиента после внутриселезёночной трансплантации ОПЖ показала наличие плотно расположенных ацинусов, структура ацинарных клеток была сходной с интактной ПЖ. Среди ацинусов отмечались островки Лангерганса разных размеров, обнаруживались и очень крупные островки. Островки содержали клетки с гипо – и гиперхромной гомогенно - окрашенной цитоплазмой. В островковых клетках определялись крупные округлые гипо – и гиперхромные ядра, а также ядра, содержащие глыбчатый и сетчатый хроматин. Вокруг сосудов и протоков обнаруживается разрастание соединительной ткани. Описанная гистологическая картина ПЖ после трансплантации в селезёнку свидетельствует о гиперфункции островков (Рис. 28).
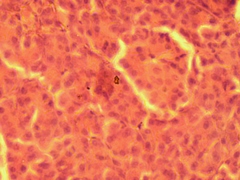
Рис. 3.28. Фрагмент поджелудочной железы половозрелого кролика после трансплантации ОПЖ в селезенку. Окраска гематоксилином и эозином. Ок. 10, об. 20.
В ПЖ животных – реципиентов после интрапортальной трансплантации структура ацинарной ткани мозаична. Среди нормальных ацинусов, обнаруживались дегенеративные, распавшиеся на отдельные клетки с микронекрозами. Стенки кровеносных сосудов утолщены. Островки разных размеров, хорошо дифференцируются и содержат клетки с округлыми гипо – и гиперхромными ядрами, в некоторых клетках наблюдается пикноз. На основание гистоструктуры можно предположить о гиперфункции островков на фоне дегенеративно – дистрофических перестроек в паренхиме органа (Рис. 3.29)
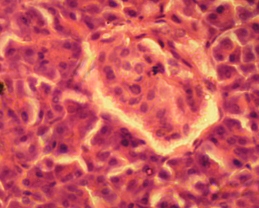
Рис. 3.29. Фрагмент поджелудочной железы половозрелого кролика после трансплантации ОПЖ в портальную вену печени. Окраска гематоксилином и эозином. Ок. 10, об. 40.
В ПЖ кролика после трансплантации ОПЖ в костный мозг (Рис. 3.30 а) и в паренхиму печени (Рис. 3.30 б) обнаруживаются дегенеративно – дистрофические изменения. Ацинарная ткань состоит из плохо контурированных ацинусов. Границы ацинусов и ацинарных клеток размыты и не определяются, клетки содержат мутную цитоплазму, при этом ядра у них либо лизированы, либо вакуолизированы. Ядра расположены хаотично по всей клетке, вследствие этого структура ацинусов нарушена. В некоторых участках железы обнаружен распад ацинусов на отдельные клетки с микронекрозами. Островки трудно идентифицировать на фоне атрофии ацинарной ткани. Единичные островки содержат клетки с округлыми гипо – и гиперхромными ядрами, а в большинстве островков наблюдается вакуолизация клеток, при этом было обнаружено, что часть островковых клеток лизировалась с образованием некротических глыбок, другая – содержит ядра в разной степени дегенерации. Отмечается разрастание в междольковых пространствах соединительная ткань. Сосуды полнокровные, обнаружена сосудистая реакция в виде стазов.
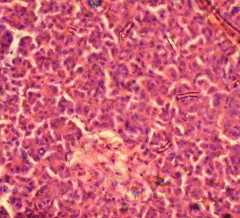
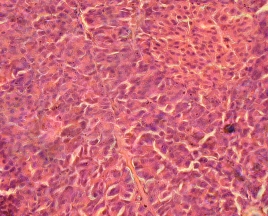
а б
Рис. 3.30. Фрагмент поджелудочной железы половозрелого кролика после трансплантации ОПЖ в костный мозг (а) и в паренхиму печени (б). Гистопрепарат. Окраска гематоксилином и эозином. Ок. 10, об. 40.
В ПЖ кроликов после трансплантации ОПЖ под капсулу почки структура ацинарной ткани соответствует норме. Однако между ацинусами наблюдаются фибробласты в прорастающих тяжах соединительной ткани за счёт чего ацинусы отодвинуты друг от друга с образованием микротрещин. Ацинусы содержат клетки с дисперсно окрашенной цитоплазмой и гипо – и гиперхромными ядрами (Рис. 3.31 а). Определяются единичные островки, в которых отмечаются клетки с округлыми гиперхромными ядрами, при этом центральная часть островков разрежена. Межклеточное пространство вакуолизировано. Обнаруживаются стазы. Морфофункциональное состояние ацинарной ткани ПЖ можно отметить как гиперфункциональное на фоне деструкции островков Лангерганса (Рис. 31 б).
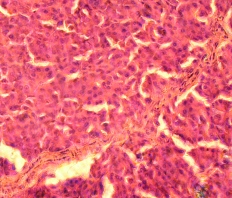
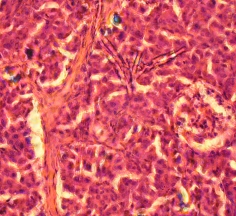
а б
Рис. 3.30. Фрагмент поджелудочной железы половозрелого кролика после трансплантации ОПЖ под капсулу почки. Гистоструктура ацинарной ткани (а) и островки (б). Гистопрепарат. Окраска гематоксилином и эозином. Ок. 10, об. 40.
При трансплантации в семенник ПЖ реципиента переживает глубокие дегенеративные изменения, особенно происходящие в ацинарной ткнани. Это выражается в отсутствии дольчатости органа. Наблюдается лизис и слияние ацинусов с образованием очагов с микронекрозами. Единичные островки плохо контурируются, некоторые из них лизированы. Островковые клетки малочисленны, в некоторых определяются вакуолизированные остатки цитоплазматического вещества. Ядра крупные гипохромные, сождержат сетчатый хроматин. Отмечается полнокровие сосудов и стазы (Рис. 32 а).
После внутривенной трансплантации островков у животных – реципиентов в ПЖ обнаруживаются дегенеративно – дистрофические явления, которые заключаются в следующем: междольковые пространства расширены, отмечается разрастание жировой и соединительной ткани. Ацинусы сжаты, клетки в них плотно расположены и содержат цитоплазму плотной консистенции. Островки дегенеративные с размытыми контурами, в них наблюдаются клетки, ядра которых как вакуолизированы, так и лизированы. В некоторых клетках островков наблюдается гидропическая деструкция. Клетки располагаются хаотично, и содержат водянистую цитоплазму и гипохромные ядра. Стенки протоков утолщены. Обнаруживаются стазы. Орган переживает диабетическую дистрофию (Рис. 3. 32 б).

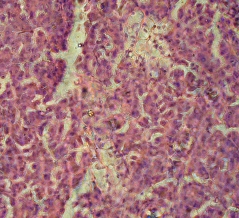
а б
Рис. 3.32. Фрагмент поджелудочной железы половозрелого кролика после трансплантации ОПЖ в семенник (а) и внутривенной трансплантации ОПЖ (б). Гистопрепарат. Окраска гематоксилином и эозином. Ок. 10, об. 40.
Проведенный гистологический анализ показал, что независимо от места (органа) трансплантации ОПЖ неонатальных животных через 3 месяца в ПЖ животных – реципиентов наблюдаются выраженные дегенеративно – дистрофические изменения, которые выражаются в сосудистых реакциях органа, в активации соединительной ткани, в микронекрозах ацинусов, в уменьшение числа островков в результате их лизиса. Сохранившиеся островки претерпевают гипертрофию, что вызывает нарушение синтеза инсулина и трудности его секреции в кровяное русло, а также отмечаются структурные перестройки с потерей β-клеток, их вакуолизацией, кариорексиса. Деструкция ацинарной ткани, по всей видимости, в большинстве случаев вызывает патологию пищеварения из–за нарушения нормального синтеза и секреции ферментов. Однако необходимо отметить, что в ПЖ животных с внутриселезёночным трансплантатом ОПЖ дегенеративно – дистрофические изменения были менее выражены, чем в других группах животных.
Сравнительный анализ гистопрепаратов собственных ПЖ и показателей углеводного обмена показал, что длительный гипогликемический эффект, компенсация экспериментального СД 1 типа, высокий уровень инсулина в крови кроликов с внутриселезеночным и интрапортальным трансплантатами связан не восстановлением собственной железы, а с функционированием алло – и ксенографта. Кроме того, на 98 сутки после внутриселезеночной КсТц ОПЖ у животных – реципиентов при проведении гистохимического анализа с помощью дитизонового раствора в селезенке были идентифицированы хорошо сохранившиеся островки. Полученные результаты анализа углеводного обмена и гистологических образцов свидетельствует про сохранность островков неонатальных животных в селезёнке и наличие антидиабетического эффекта, а также более эффективной компенсации СД 1 типа после трансплантации ОПЖ в селезёнку, чем в другие сайты организма.
Таким образом, проведенные нами исследования показали, что сайт организма, в который осуществляли введение ОПЖ неонатального происхождения оказывает существенное влияние на длительность выживание островковых клеток и на компенсацию углеводного обмена при экспериментальном СД 1 типа.
По результатам данного раздела 3.2. опубликованы следующие работы:
1. Комбинированная трансплантация органотипических культур эндокринных желез в профилактике и лечении эндокринопатий / Легач Е.И., Божок Г.А., Скрипниченко (Колот) Н.В. // Матеріали науково - практичної конференції «Профілактика, діагностика та лікування – основні складові терапії». – м. Харків, 2006. – С. 49.
2. Влияние места трансплантации островков поджелудочной железы на компенсацию углеводного обмена у кроликов с экспериментальным сахарным диабетом 1 типа / Колот Н.В., Божок Г.А., Легач Е.И., Бондаренко Т.П. // Проблеми ендокринної патології. – 2007. – № 4. – С. 71-77.
3. Интрапортальная комбинированная трансплантация островков с клетками Сертоли как способ коррекции нарушений углеводного обмена при экспериментальном сахарном диабете / Легач Е.И., Колот Н.В., Божок Г.А. // Трансплантологія. – 2007. – Т. 9, № 1. – С.151-153.
4. Интрапортальная комбинированная ксенотрансплантация островков поджелудочной железы с клетками Сертоли в лечении экспериментального сахарного диабета / Легач Е.И., Божок Г.А., Колот Н.В., Бондаренко Т.П. // Материалы III Всероссийского симпозиума с международным участием «Актуальные вопросы тканевой и клеточной трансплантологии». – г. Москва, ЦИТО, 2007. – С. 75-76.
5. Показники вуглеводного обміну при інтрапортальній ксенотрансплантації острівців підшлункової залози кролям з алоксановим діабетом / Колот Н.В., Божок Г.А., Бондаренко Т.П. // Матеріали ІІІ міжнародної наукової конференції студентів та аспірантів «Молодь та поступ біології». – м. Львів, 2008. – С. 425-426.
6. Трансплантация островков поджелудочной железы в костный мозг кроликов с экспериментальным сахарным диабетом 1 типа / Колот Н.В., Божок Г.А., Легач Е.И., Бондаренко Т.П. // Вісник Харківського національного уніаерситету ім. В.Н. Каразіна: Серія – Біологія. – 2008. – Вип. 5-6 – № 749. – С.
7. Изучение динамики содержания инсулина и показателей углеводного обмена после внутриселезеночной ксенотрансплантации островков поджелудочной железы / Божок Г.А., Колот Н.В., Бондаренко Т.П., Легач Е.И. // Материалы IV Всероссийского съезда трансплантологов, посвященный памяти О.О. Шалимова. – г. Москва, 2008. – С.
