
- •Глава 1
- •§ 2. Электрические и магнитные поля
- •§ 3. Характеристики векторных полей
- •§ 4. Законы электромагнетизма
- •§ 5. Что это такое — «поля»?
- •§ 6. Электромагнетизм в науке и технике
- •Дифференциальное исчисление векторных полей
- •§ 2. Скалярные и векторные поля — т и h
- •§ 3. Производные полей — градиент
- •Выбрав удобную систему координат, мы можем написать
- •§ 4. Оператор
- •§ 5. Операции с
- •У равнения Максвелла
- •§ 6. Дифференциальное уравнение потока тепла
- •Е сли площадь этой плиты а, то поток тепла за единицу времени равен
- •§ 7. Вторые производные векторных полей
- •§ 8. Подвохи
- •§ 2. Поток векторного поля
- •§ 3. Поток из куба; теорема Гаусса
- •§ 4, Теплопроводность; уравнение диффузии
- •§ 5. Циркуляция векторного поля
- •§ 6. Циркуляция по квадрату; теорема Стокса
- •§ 7. Поля без роторов и поля без дивергенций
- •§ 8. Итоги
- •Магнитостатика
- •§ 2. Закон Кулона; наложение сил
- •Закон Кулона
- •§ 3. Электрический потенциал
- •Э лектростатический потенциал
- •§ 5. Поток поля е
- •§ 6. Закон Гаусса; дивергенция поля е
- •§ 7. Поле заряженного шара
- •§ 8. Линии поля; эквипотенциальные поверхности
- •§ 2. Равновесие в электростатическом поле
- •§ 3. Равновесие с проводниками
- •§ 4. Устойчивость атомов
- •§ 5. Поле заряженной прямой линии
- •§ 6. Заряженная плоскость; пара плоскостей
- •§ 7. Однородно заряженный шар; заряженная сфера
- •§ 8. Точен ли закон Кулона?
- •§ 9. Поля проводника
- •§ 10. Поле внутри полости проводника
- •Электрическое поле в разных физических условиях
- •§ 2. Электрический диполь
- •§ 3. Замечания о векторных уравнениях
- •§ 4. Диполъный потенциал как градиент
- •§ 5. Дипольное приближение для произвольного распределения
- •§ 6. Поля заряженных проводников
- •§ 7. Метод изображений
- •§ 8. Точечный заряд у проводящей плоскости
- •§ 9. Точечный заряд у проводящей сферы
- •§ 10. Конденсаторы; параллельные пластины
- •§ 11. Пробой при высоком напряжении
- •§ 12. Ионный микроскоп
- •Электрическое поле в разных физических условиях (продолжение)
- •§ 2. Двумерные поля; функции комплексного переменного
- •§ 3. Колебания плазмы
- •§ 4. Коллоидные частицы в электролите
- •§ 5. Электростатическое поле сетки
- •§ 2. Энергия конденсатора. Силы, действующие на заряженные проводники
- •§ 3. Электростатическая энергия ионного кристалла
- •§ 4. Электростатическая энергия ядра
- •§ 5. Энергия в электростатическом поле
- •§ 6. Энергия точечного заряда
- •§ 2. Электрические токи в атмосфере
- •§ 3. Происхождение токов в атмосфере
- •§ 4. Грозы
- •§ 5. Механизм распределения зарядов
- •§ 6. Молния
- •§ 2. Вектор поляризации р
- •§ 3. Поляризационные заряды
- •§ 4. Уравнения электростатики для диэлектриков
- •§ 5. Поля и силы в присутствии диэлектриков
- •§ 2. Электронная поляризация
- •§ 3. Полярные молекулы; ориентационная поляризация
- •§ 4. Электрические поля в пустотах диэлектрика
- •Следовательно, если поле внутри однородного диэлектрика мы назовем е, то можно записать
- •§ 5. Диэлектрическая проницаемость жидкостей; формула Клаузиуса — Моссотти
- •§ 6. Твердые диэлектрики
- •§ 7. Сегиетоэлектричество; титанат бария
- •Электростатические аналогии
- •§ 2. Поток тепла; точечный источник вблизи бесконечной плоской границы
- •§ 3. Натянутая мембрана
- •§ 4. Диффузия нейтронов; сферически-симметричный источник в однородной среде
- •§ 5. Безвихревое течение жидкости; обтекание шара
- •§ 6. Освещение; равномерное освещение плоскости
- •§ 7. «Фундаментальное единство» природы
- •Глава13
- •§ 2. Электрический ток; сохранение заряда
- •§ 3. Магнитная сила, действующая на ток
- •§ 4. Магнитное поле постоянного тока; закон Ампера
- •§ 5. Магнитное поле прямого провода и соленоида; атомные токи
- •§ 6. Относительность магнитных и электрических полей
- •§ 7. Преобразование токов и зарядов
- •§ 8. Суперпозиция; правило правой руки
- •§ 2. Векторный потенциал заданных токов
- •Это векторное уравнение, конечно, распадается на три уравнения
- •§ 3. Прямой провод
- •§ 4. Длинный соленоид
- •§ 5. Поле маленькой петли; магнитный диполь
- •§ 6. Векторный потенциал цепи
- •§ 7. Закон Био— Савара
§ 3. Электростатическая энергия ионного кристалла
Рассмотрим теперь применение понятия электростатической энергии в атомной физике. Мы не можем запросто измерять силы, действующие между атомами, но часто нас интересует разница в энергиях двух расстановок атомов (к примеру, энергия химических изменений). Так как атомные силы в основе своей — это силы электрические, то и химическая энергия в главной своей части — это просто электростатическая энергия.
Рассмотрим, например, электростатическую энергию ионной решетки. Ионный кристалл, такой, как NaCl, состоит из положительных и отрицательных ионов, которые можно считать жесткими сферами. Они электрически притягиваются, пока не соприкоснутся; затем вступает в дело сила отталкивания, которая быстро возрастает, если мы попытаемся сблизить их теснее.
Для первоначального приближения вообразим себе совокупность жестких сфер, представляющих атомы в кристалле соли. Строение такой решетки было определено с помощью дифракции рентгеновских лучей. Эта решетка кубическая — что-то вроде трехмерной шахматной доски. Сечение ее изображено на фиг. 8.5. Промежуток между ионами 2,81 Å (или 2,81•10-8 см).
Е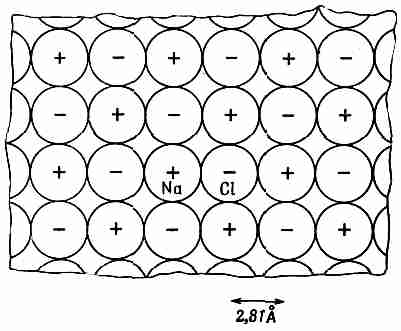 сли
наше представление о системе правильно,
мы должны уметь проверить его, задав
следующий вопрос: сколько понадобится
энергии, чтобы разбросать эти ионы, т.
е. полностью разделить кристалл на
ионы? Эта энергия должна быть равна
теплоте испарения соли плюс энергия,
требуемая для диссоциации молекул на
ионы. Полная энергия разделения NaCl
на ионы,
как следует из опыта, равна 7,92 эв
на молекулу.
сли
наше представление о системе правильно,
мы должны уметь проверить его, задав
следующий вопрос: сколько понадобится
энергии, чтобы разбросать эти ионы, т.
е. полностью разделить кристалл на
ионы? Эта энергия должна быть равна
теплоте испарения соли плюс энергия,
требуемая для диссоциации молекул на
ионы. Полная энергия разделения NaCl
на ионы,
как следует из опыта, равна 7,92 эв
на молекулу.
Фиг. 8.5. Поперечный разрез кристалла соли в масштабе нескольких атомов.
В двух перпендикулярных к плоскости рисунка сечениях будет такое же шахматное расположение ионов Na и Сl (см. вып. 1, фиг. 1.7).
П![]() ользуясь
коэффициентом перевода
ользуясь
коэффициентом перевода
и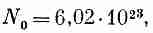 числом Авогадро (количество молекул в
грамм-молекуле)
числом Авогадро (количество молекул в
грамм-молекуле)
можно представить энергию испарения в виде
![]()
И![]() злюбленная
единица энергии, которой пользуются
физико-химики,— килокалория, равная
4190 дж;
так что 1 эв
на молекулу
— это все равно что 23 ккал/моль.
Химик сказал
бы поэтому, что энергия диссоциации
NaCl
равна
злюбленная
единица энергии, которой пользуются
физико-химики,— килокалория, равная
4190 дж;
так что 1 эв
на молекулу
— это все равно что 23 ккал/моль.
Химик сказал
бы поэтому, что энергия диссоциации
NaCl
равна
Можем ли мы получить эту химическую энергию теоретически, подсчитывая, сколько работы понадобится для того, чтобы распотрошить кристалл? По нашей теории она равна сумме потенциальных энергий всех пар ионов. Проще всего составить себе представление об этой энергии, выбрав какой-то один ион и подсчитав его потенциальную энергию по отношению ко всем прочим ионам. Это даст удвоенную энергию на один ион, потому что энергия принадлежит парам зарядов. Если нам нужна энергия, связанная с одним каким-то ионом, то мы должны взять полусумму. Но на самом деле нам нужна энергия на молекулу, содержащую два иона, так что вычисляемая нами сумма прямо даст нам энергию на молекулу.
Энергия иона по отношению к его ближайшему соседу равна —e2/a, где e2=q2e/40, а а — промежуток между центрами ионов. (Мы рассматриваем одновалентные ионы.) Эта энергия равна —5,12 эв; мы уже видим, что ответ получается правильного порядка величины. Но нам еще предстоит подсчитать бесконечный ряд членов.
Начнем со сложения энергий всех ионов, лежащих по прямой. Считая ион, отмеченный на фиг. 8.5 значком Na, нашим выделенным ионом, сперва рассмотрим те ионы, которые лежат на одной с ним горизонтали. Там есть два ближайших к нему иона хлора с отрицательными зарядами, на расстоянии я от Na каждый. Затем идут два положительных иона на расстояниях 2а и т. д. Обозначая эту сумму энергий U1, напишем
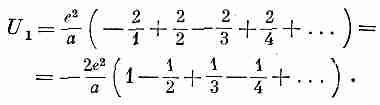
(8.19)
Ряд сходится медленно, так что численно его оценить трудно,
н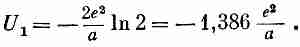 о
известно, что он равен ln2.
Значит,
о
известно, что он равен ln2.
Значит,
(8.20)
Т еперь
перейдем к ближайшей линии, примыкающей
сверху. Ближайший ион отрицателен и
находится на расстоянии а.
Затем
стоят два положительных на расстояниях2а.
Следующая пара — на расстоянии 5а,
следующая— на10а
и т. д. Для всей линии получается ряд
еперь
перейдем к ближайшей линии, примыкающей
сверху. Ближайший ион отрицателен и
находится на расстоянии а.
Затем
стоят два положительных на расстояниях2а.
Следующая пара — на расстоянии 5а,
следующая— на10а
и т. д. Для всей линии получается ряд
(8.21)
Таких линий четыре: выше, ниже, спереди и сзади. Затем имеются четыре линии, которые являются ближайшими по диагонали, и т. д. и т. д.
Е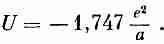 сли
вы терпеливо произведете подсчеты для
всех линий и затем все сложите, то
увидите, что итог таков:
сли
вы терпеливо произведете подсчеты для
всех линий и затем все сложите, то
увидите, что итог таков:
Это число немного больше того, что было получено в (8.20) для первой линии. Учитывая, что е2/а=-5,12 эв, мы получим
![]()
Наш ответ приблизительно на 10% больше экспериментально наблюдаемой энергии. Он показывает, что наше представление о том, что вся решетка скрепляется электрическими кулоновскими силами, в основе своей правильно. Мы впервые получили специфическое свойство макроскопического вещества из наших познаний в атомной физике. Со временем мы добьемся гораздо большего. Область науки, пробующая понять поведение больших масс вещества на языке законов атомного поведения, называется физикой твердого тела.
А как же с ошибкой в наших расчетах? Почему они не до конца верны? Мы не учли отталкивание между ионами на близких расстояниях. Это ведь не совершенно жесткие сферы, так что, сблизясь, они немного сплющиваются. Но они не очень мягкие и сплющиваются самую чуточку. Все же какая-то энергия уходит на эту деформацию, и вот, когда ионы разлетаются, эта энергия высвобождается. Энергия, которая на самом деле нужна для того, чтобы развести все ионы врозь, чуть меньше той, которую мы вычислили; отталкивание помогает преодолеть электростатическое притяжение.
А есть ли возможность как-то прикинуть долю этого отталкивания? Да, если мы знаем закон силы отталкивания. Мы еще не умеем пока анализировать детали механизма отталкивания, но некоторое представление о его характеристиках мы можем получить из макроскопических измерений. Измеряя сжимаемость кристалла как целого, можно получить количественное представление о законе отталкивания между ионами, а отсюда — о его вкладе в энергию. Таким путем было обнаружено, что вклад этот должен составлять 1/9,4 часть вклада от электростатического притяжения и иметь, естественно, противоположный знак. Если этот вклад мы вычтем из чисто электростатической энергии, то получим для энергии диссоциации на молекулу число 7,99 эв. Это намного ближе к наблюдаемому результату 7,92 эв, но все еще не находится в совершенном согласии. Есть еще одна вещь, которую мы не учли: мы не сделали никаких допущений о кинетической энергии колебаний кристалла. Если сделать поправку на этот эффект, то сразу возникнет очень хорошее согласие с экспериментальной величиной. Значит, наши представления правильны: главный вклад в энергию кристалла, такого, как NaCl, является электростатическим.
