- •9. Загальні показники якості об’єктів довкілля
- •9.1. Застосування хімічних методів в аналізі об’єктів довкілля
- •9.2. Загальні якісні характеристики ґрунту
- •9.3. Загальні кількісні характеристики ґрунту
- •9.4. Загальні кількісні характеристики, спільні для ґрунтів та вод
- •9.5. Загальні кількісні характеристики якості вод
- •9.6. Загальні кількісні характеристики газів та повітря
- •9.7. Загальні кількісні характеристики рослинного зразка
- •Контрольні запитання
- •10. Огляд фізико-хімічних методів аналізу, які застосовують в контролі об’єктів довкілля
- •10.1. Оптичні методів в аналізі об’єктів довкілля
- •10.1.1. Застосування спектрофотометричного аналізу
- •10.1.2. Застосування методів полуменевої фотометрії та індуктивно-зв’язаної плазми в аналізі
- •10.2. Електрохімічні методи в аналізі об’єктів довкілля
- •10.2.1. Застосування кондуктометричного методу аналізу
- •10.2.2. Застосування кулонометричного методу аналізу
- •10.2.3. Застосування вольтамперометричних методів аналізу
- •10.2.4. Застосування потенціометричного методу аналізу
- •10.3. Застосування кінетичних методів в аналізі об’єктів довкілля
- •Контрольні запитання
- •11. Методи концентрування і розділення в аналізі об’єктів довкілля
- •11.1. Застосування фізичних методів розділення та концентрування
- •11.2. Застосування відгонки летких речовин
- •11.3. Застосування сорбції (твердофазової екстракції)
- •11.4. Застосування екстракції
- •11.5. Застосування осадження та співосадження
- •11.6. Застосування електровиділення металів та електрофорезу
- •Контрольні запитання
- •12. Застосування хроматографічних методів в аналізі об’єктів довкілля
- •12.1. Застосування методів рідинної хроматографії
- •12.2. Застосування методів тонкошарової та паперової хроматографії
- •12.3. Застосування методів газової хроматографії
- •Контрольні запитання
11.4. Застосування екстракції
Екстракція – найпростіший та достатньо селективний метод розділення та концентрування. Її застосовують для відділення та концентрування важких металів. Слід зазначити, що важкі метали повинні бути попередньо вивільнені з комплексів з гумусовими речовинами.
При екстракції досягається абсолютне та відносне концентрування. Абсолютне концентрування досягається внаслідок меншого об’єму органічної фази порівняно з водною фазою. Відносне концентрування – збільшується концентрація певних мікроелементів, фактично змінюється співвідношення концентрацій визначуваних і сторонніх компонентів на користь визначуваних. Екстракцією можна очищати воду, про що велась мова вище. При екстракції концентрація мікроелементів збільшується у 10-100 разів. Застосовують різні види екстракції.
Твердо-рідиннофазова екстракція полягає в обробці твердої фази (зразка) водою або розчином. Зразок переважно завжди зволожений. У присутності великої кількості розчинника зі зразка переходять у розчин легкорозчинні речовини, між зразком і розчином встановлюється рівновага. Як розчинник можна використати воду, водний розчин, органічний розчинник (ацетон). Екстракцію здійснюють як у статичних умовах (заливають тверду фазу рідиною і витримують певний проміжок часу, а потім фільтрують), так і в динамічних, пропускаючи рідину через тверду фазу в колонці. Цей спосіб застосовують під час одержання витяжок з проби ґрунту рослинного матеріалу, харчового продукту та інших зразків.
Рідинно-рідиннофазова екстракція – це розподіл визначуваної речовини між двома незмішуваними рідинами.
Процес екстракції описується законом Нернста, який характеризує рівновагу розподілу інгредієнта А між двома рідкими фазами:
Авод Аорг.
Константа
рівноваги
(розподілу)
екстракції
має значення:
 ,
,
де [A]o. і [A]в. рівноважна концентрація інгредієнту А в органічній та водній фазі; К константа рівноваги, яку називають константою розподілу.
Інгредієнт А може входити до складу кількох різних сполук, які у водній фазі (або в органічній) перебувають між собою у рівновазі. Переважно визначають сумарний вміст інгредієнта в речовині, тому замість константи розподілу К використовують коефіцієнт розподілу D, який характеризує ефективність екстракції:
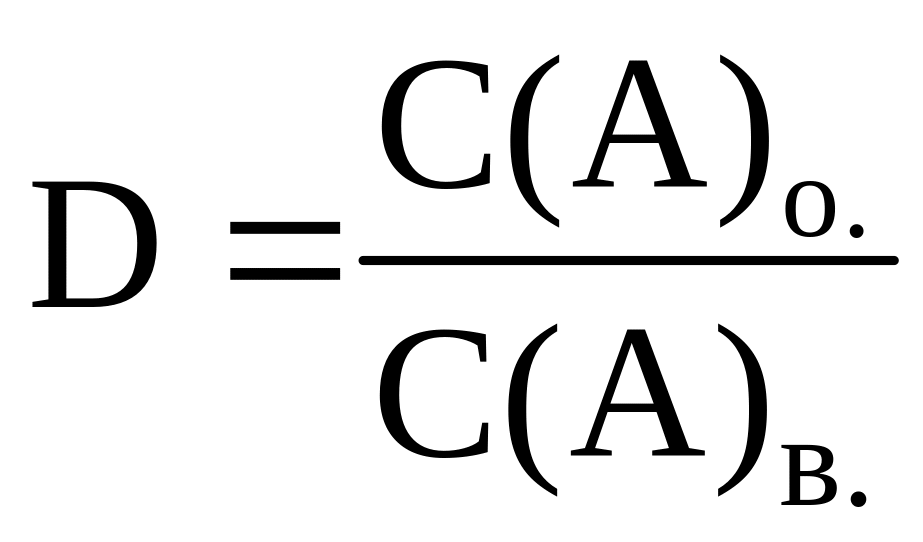 ,
,
де С(А)о. і С(А)в. загальна аналітична концентрація інгредієнта А в органічній та водній фазі; D коефіцієнт розподілу інгредієнта А.
Важливою характеристикою процесу екстракції є ступінь добування речовини (А) RА:
 ,
,
де n(А)о. і n(А)поч. в. кількість молів інгредієнта А в органічній фазі та його початкова кількість у водній фазі.
Можливість розділення двох речовин кількісно характеризується фактором збагачення, який показує, у скільки разів відношення кількостей розділюваних речовин в органічній фазі відрізняється від їх співвідношення у водній:
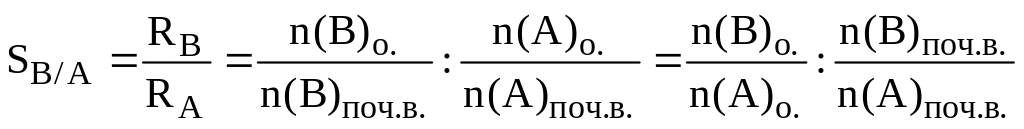 ,
,
де R ступінь добування після першого циклу екстракції;
n(А)о. кількість молів інгредієнта А в органічній фазі після екстракції;
n(A)поч.в. початкова кількість молів інгредієнта А у водній фазі.
З водного розчину речовина переходить в органічну фазу у вигляді комплексних сполук, іонних асоціатів. Якщо екстрагент реагує з визначуваним іоном, то розділення декількох іонів базується на відмінностях констант екстракції при певному значенні рН.
Для процесу Mn+(в) + nHL(o) + nH2O MLn(o) + nH3O+(в)
константа рівноваги має значення:
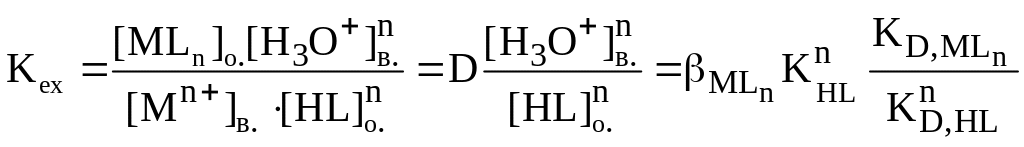 .
.
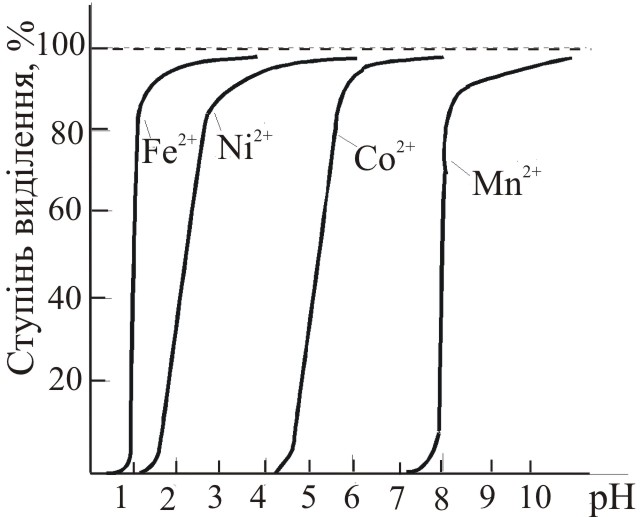
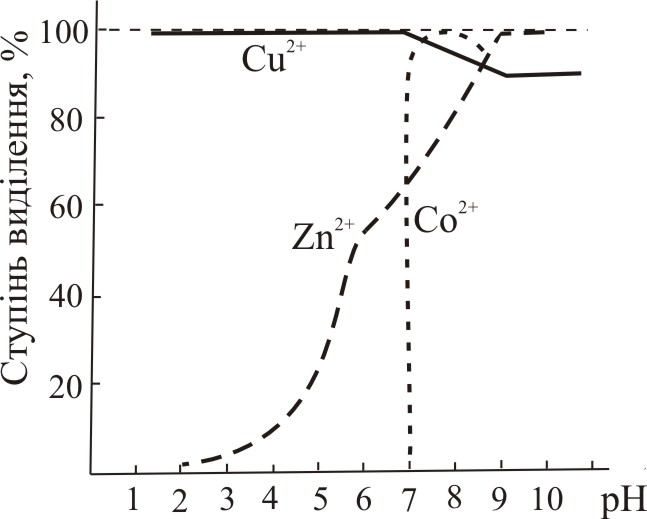
Відмінність величин констант екстракції комплексних сполук різних елементів при різних значеннях рН дозволяє їх розділити (рис.11.1).
а |
б |
Рис. 11.1. Діаграма екстракції 8оксихінолятів (а) та дитизонатів (б) деяких металів залежно від рН |
|
Рідинно-рідинна екстракція може бути проведена неперервно або дискретно, один раз, а за необхідності – декілька разів для більш повного переходу в органічну фазу визначуваного інгредієнта. Вона застосовується для відділення і розділення нерозчинних або слаборозчинних у воді органічних речовин, що часто передує підготовці до хроматографічного визначення. Розчин в органічному розчиннику можна безпосередньо використати для фотометричного та атомно-абсорбційного визначення.
У природному об’єкті іони металів переважно зв’язані у стійкі фульвокомплекси. Крім того, важкі метали утворюють асоціати з колоїдними частинками. Тому перед процедурою екстрагування руйнують ці комплекси та органічні речовини кислотами та окисниками (H2SO4, HNO3, H2O2).
Чутливість екстракції залежить від міцності комплексних сполук. Якщо після екстракції проводять реекстракцію у невеликий об’єм кислого розчину, то це ще додатково підвищує концентрацію визначуваного іона.
Групове екстракційне відділення важких металів. Використовують реакції комплексоутворення низки органічних реагентів з іонами важких металів. Їхні комплекси малополярні, стійкі у різних діапазонах рН. Застосування деяких, найважливіших з них, реагентів наведено нижче.
1. Відділення діетилдитіокарбамінатом у хлороформі. Діетилдитіокарбамінат взаємодіє з декількома десятками важких металів. У присутності ЕДТА селективність екстракції підвищується. Лише деякі комплекси забарвлені: з бісмутом жовтого кольору, з купрумом – коричневого, з кобальтом – зеленого.

Стійкість комплексів різних металів залежить від рН:
при pH 3 в органічну фазу переходять комплекси Ag+, Cu2+, Hg2+, Mo (VI);
при рН 4,7-4,8 в органічній фазі є комплекси Mn2+, Cr3+, Se, As, а у водному розчині залишаються іони Al3+, Ti(IV), Ca2+, Mg2+, Na+, K+;
при pH 6-9 в органічній фазі є лише комплекси Bi3+, Fe3+.
Відділення купфероном у хлороформі:

При рН 2 у комплекс зв’язуються іони Bi3+, Co2+, Cu2+, Fe3+, Sn2+, Mo(VI), які переходять в органічну фазу, а у водному розчині залишаються Ni2+, Co2+, Ag+, Pb2+, Mn2+, Ca2+, Mg2+, Na+, K+ і частково Al3+, Bi3+, Cu2+. Екстрагують 3-4 рази.
У нейтральному середовищі зв’язуються в комплекси іони Cd2+, Hg2+, Mn2+, Ni2+, Zn2+ і переходять в органічну фазу.
Відділення 8-оксихіноліном у хлороформі:

Для екстракції використовують 1-5% розчин оксихіноліну. Це один із найбільш універсальних реагентів, він утворює комплекси з більше як 50 металами. Для більш селективного розділення поряд з регулюванням рН додають маскуючі реагенти ( ЕДТА, ціанід).
У слабколужному середовищі в органічну фазу переходять комплекси іонів Al3+, Cd2+, Mn2+, Ag+, Ni2+, Pb2+, Zn2+, Sr2+.
4 .
Відділення дитизоном
у CCl4,
метилізобутилкетоні або амілацетаті:
.
Відділення дитизоном
у CCl4,
метилізобутилкетоні або амілацетаті:
У кислому середовищі екстрагують комплекси дитизону з Ag+, Bi3+, Cu2+,Hg2+. В нейтральному середовищі стійкими є комплекси з Fe3+, Sn2+, Zn2+, Ni2+, Co2+. У слаболужному середовищі екстрагують дитизонати Cd2+, Ag+, Cu2+, Hg2+, Ni2+, Pb2+, Co2+, Mn2+ (табл.11.1).
Послідовне екстракційне розділення іонів металів. Екстракцію катіонів важких металів проводять послідовно з одного розчину. Таке екстракційне розділення та концентрування мікроелементів вимагає меншої затрати часу і дозволяє усю процедуру провести з одної порції розчину, а, отже, витратити меншу кількість проби. Часто для розділення важких металів використовують дитизонати (рис.11.1б).
Якщо з обзоленої ґрунтової витяжки або з проби води хочуть відділити і розділити послідовно декілька мікроелементів, то спочатку маскують іони Fe3+, Al3+, Ca2+, Mg2+ додаванням цитрату натрію, а Mn2+ – гідроксиламіну. Тоді до водного розчину додають розчин дитизону в CCl4 і, регулюючи кислотність, поступово відділяють спочатку купрум, а потім решту іонів. Деякі іони маскують тіосульфатом.
Схема розділення іонів Cu2+, Zn2+, Ni2+, Pb2+, Co2+ у розчині:
 водний
розчин: Zn2+,
Ni2+,
Pb2+,
Co2+,
Cd2+,
Pb2+
водний
розчин: Zn2+,
Ni2+,
Pb2+,
Co2+,
Cd2+,
Pb2+
р Н=2 (відбувається екстракція)
розчин CCl4: дитизонат Cu2+
рН=8,2 (екстракція) розчин CCl4: дитизонати Zn2+, Ni2+, Pb2+, Co2+, Cd2+
водний розчин Zn2+, [Pb(S2O3)22-] і [Cd(S2O3)22-]
дія 0,02 М HCl (реекстракція)
i S2O32- розчин CCl4: дитизонати Ni2+, Co2+
водний розчин: Ni2+
повторна
д ія 0,02 М HCl (реекстракція)
розчин CCl4: дитизонати Co2+
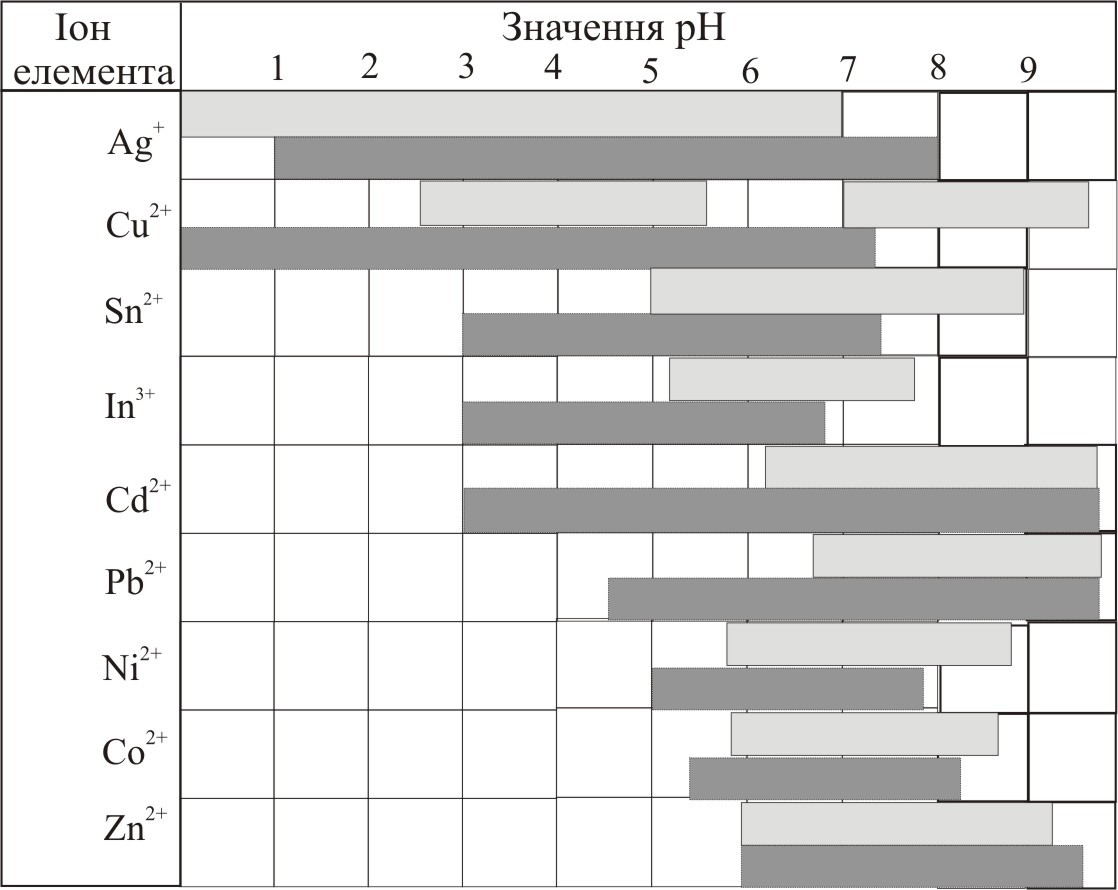
Діапазони рН, в яких можна екстрагувати іони важких металів, наведені у табл. 11.1.
Таблиця
11.1. Значення рН, за яких існують дитизонати
металів при екстракції (![]() ) та при співосадженні з 2,4-динітроаніліном
(
) та при співосадженні з 2,4-динітроаніліном
(![]() )
)
|
Екстракційне розділення за ступенем окиснення елементів.
Cr2O72- екстрагують діетилдитіокарбаматом Na у метилізобутилкетоні або хлороформі, а у водному розчині залишається Cr3+.
AsО33- екстрагують піролідиндитіокарбаматом в метил-ізобутилкетоні, а AsО43- залишається у водному розчині;
SeО32- екстрагується піролідиндитіокарбаматом в CCl4, а SeО42- залишається у водному розчині.
Екстракція окремих іонів застосовується лише у випадку селективних реакцій. Найчастіше одержані продукти є забарвлені і їх визначають фотометрично. Приклади таких визначень описані в розділі 10.1. Можливе також титриметричне завершення аналізу.
Визначення меркурію з дитизоном у CНCl3. Іони Hg2+ та інших металів попередньо зв’язують у слабокислому середовищі з ЕДТА:
Hg2++H2Y2-=HgY2-+2H+,
Ме2++H2Y2-=МеY2-+2H+.
Комплекс меркурію HgY2- малостійкий і може легко перейти в дитизонат. Тому одержаний розчин комплексів з ЕДТА титрують розчином дитизону в CHCl3 до переходу жовто-оранжевого (дитизонат) до зеленого (дитизон) забарвлення:
HgY2-+2Н2Dt= [Hg(НDt)2]+H2Y2-.
Кріоекстракція. Повністю уникнути нагрівання, яке згубне для багатьох речовин, дозволяє метод холодової екстракції, яким концентрують органічні речовини. Кріоекстракція здійснюється розчинниками, які киплять за низьких температур, а за кімнатної перебувають у газуватому стані. При наступному обережному нагріванні до 0С киплячий розчинник випаровується і речовина, яку екстрагували, залишається в чистому вигляді.
Органічні кислоти, у тому числі тверді, є малорозчинні у воді. Вони можуть бути вилучені із замороженого зразка рідким аміаком у вигляді солей амонію.
Кріоекстракція може використовуватись у поєднанні з кріоконсервуванням речовин.
Різновидом кріоекстракції є надкритична екстракція, коли як екстрагент використовують зріджений СО2. Метод характеризується високою універсальністю щодо більшості органічних сполук, але не є високоселективним. Регулювати розчинення речовин з екстракту в СО2 можна, змінюючи швидкість охолодження екстракту.
Ультразвукова екстракція. Метод використовується для вилучення нелетких і напівлетких сполук з твердих фаз, наприклад, з ґрунту, мулу, твердих відходів, гірських порід, листя.
Поряд з рідким екстрагентом, наприклад дихлорметаном, суміші бензолу з метанолом, тонко подрібнений твердий зразок додатково піддають впливу ультразвукових коливань, що сприяє кращому протіканню екстракції. Це запобігає утворенню диспергованою речовиною густої маси, в якій контакт фаз є утруднений.
Спочатку приблизно годину перемішують тверду речовину з розчинником, а потім поміщають склянку з суспензією в ультразвукову камеру на декілька хвилин.
Використання як розчинника суміші бензолу з метанолом виключає можливість утворення небажаних домішок внаслідок розкладу розчинника під дією звукової енергії.