
- •«Вятский государственный университет»
- •Биоорганическая химия в технологии защиты биосферы
- •Оглавление
- •3. Реакция присоединения галогенов за счёт двойных связей в остатках непредельных кислот. 80
- •Биоорганическая химия Предмет биоорганической химии
- •Углеводы
- •Моносахариды
- •Генетический d-ряд альдотриоз, тетроз, пентоз
- •Пентозы с5н10о5
- •Получение моносахаридов
- •Физические свойства моносахаридов
- •Химические свойства моносахаридов
- •Дисахариды (биозы)
- •Общие химические свойства дисахаридов
- •Собственно полисахариды
- •Крахмал
- •Химические свойства
- •Целлюлоза (клетчатка)
- •Химические свойства
- •Химическая переработка целлюлозы
- •Аминокислоты
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Пептиды, белки
- •Химические свойства
- •Ферменты
- •Понятие о нуклеиновых кислотах
- •Моноглицериды
- •Диглицериды
- •Триглицериды
- •Предельные жирные кислоты
- •Непредельные жирные кислоты
- •Физические свойства
- •Химические свойства
- •Сложные жиры
- •Стерины
- •Гормоны и медиаторы
- •Лабораторный практикум Моносахариды Реакции на гидроксильные группы в моносахаридах
- •Реакции на карбонильные группы в моносахаридах
- •Осмоление моносахаридов
- •Цветные реакции на моносахариды
- •Дисахариды Реакции на гидроксильные группы дисахаридов
- •Реакции дисахаридов по карбонильным группам (сравнение свойств восстанавливающих и невосстанавливающих дисахаридов)
- •Гидролиз (инверсия) сахарозы
- •Реакции сахарозы с сульфатами никеля и кобальта
- •Высшие полисахариды Качественные реакции на углеводы
- •Кислотный гидролиз крахмала
- •Свойства целлюлозы
- •Некоторые свойства хлопкового и искусственных волокон
- •Аминокислоты Свойства аминокислот
- •Свойства шерсти и синтетических волокон
- •Цветные рекции на белки
- •Биуретовая реакция
- •Ксантопротеиновая реакция
- •Реакция на триптофан (реакция Шульце-Распайля)
- •Реакция Адамкевича
- •Реакция на серусодержащие аминокислоты
- •Реакция Фоля на серусодержащие аминокислоты
- •Библиографический список
- •Биоорганическая химия в технологии защиты биосферы
Генетический d-ряд альдотриоз, тетроз, пентоз
Альдотриозы


Альдопентозы
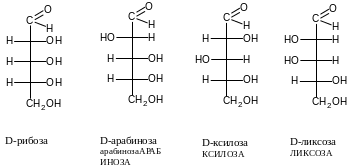
В

Введение этой группы в молекулу D-глицеринового альдегида приводит к двум тетрозам – D-эритрозе и D-треозе. Каждая полученная тетроза, а далее и пентоза при введении в их молекулу ещё одного углеродного атома тоже дают два диастереомерных сахара. Диастереомеры – это стереоизомеры, отличающиеся конфигурацией одного или нескольких асимметрических атомов углерода.
Таким образом, был получен D-ряд сахаров из D-глицеринового альдегида. Все члены приведенного ряда сохранили конфигурацию последнего асимметрического атома углерода.
Каждой альдозе D-ряда соответствует стереоизомер L-ряда. Молекулы стереоизомеров соотносятся между собой как предмет и несовместимое с ним зеркальное изображение. Такие стереоизомеры называются энантиомерами.
Приведенный ряд альдопентоз не исчерпывается четырьмя изображенными. Из D-рибозы и D-ксилозы можно получить ещё две пары диастереомерных сахаров. Однако альдопентозы имеют наибольшее распространение в природе, поэтому они будут рассмотрены более подробно.
Строение и изомерия моносахаридов представлены на примере глюкозы, которая по химическому строению относится к альдогексозам:

В молекуле глюкозы имеется четыре асимметрических атома углерода, следовательно, этой структуре должно соответствовать N = 2n =16 оптических изомеров. Все эти изомеры выделены в виде восьми пар оптических антиподов, например:


Строение глюкозы было установлено Фишером, который доказал существование неразветвлённой цепочки одной карбонильной группы и пяти спиртовых групп. Однако позднее Толленс обнаружил, что D (+) глюкоза представляет собой сложную равновесную смесь таутомерных форм, имеющих, в основном, циклическое строение:

α-D-глюкопираноза
β-D-глюкопираноза
Карбонильная
формула
D
(+) глюкоза
α-D-глюкофураноза
β-D-глюкофураноза
Образование циклических форм происходит за счёт присоединения к карбонильному кислороду водорода гидроксильной группы, расположенной у пятого или у четвёртого атома углерода. При этом образуется циклический полуацеталь с пяти- или шестичленным циклом. Такая циклизация происходит беспрепятственно, так как в пространстве реагирующие группы близко расположены друг к другу. Переход водорода может осуществляться и от четвёртого, и от пятого атома углерода, так как в обоих случаях образуются наименее напряжённые циклы – пятичленный (фуранозный) или шестичленный (пиранозный). При разрыве двойной связи у карбонильного углерода теряется его симметрия и вновь образующийся полуацетальный (гликозидный) гидроксил может двояко расположиться в пространстве, в результате чего возникает либо α-форма, либо β-форма. Если полуацетальный гидроксил располагается по ту же сторону цепи, где был гидроксил, дающий водород, это α-форма, если наоборот, то β-форма.
В обычном кристаллическом состоянии (вне организма) глюкоза существует в пиранозной форме. При перекристаллизации из разных растворителей она может быть выделена либо в виде α-D-глюкозы, либо в виде
β-D-глюкозы.
При перекристаллизации из воды получается α-D-глюкоза, которая имеет угол удельного вращения α = +110º . При перекристаллизации из пиридина или уксусной кислоты выделяется β-D-глюкоза α = +19º. При растворении этих кристаллов в воде свежеприготовленный раствор будет иметь указанный выше угол вращения, но при стоянии в обоих растворах угол постепенно изменяется, пока не достигает постоянной величины +52,5º. Этой средней величине вращения и соответствует установившееся равновесие α-D и β-D форм и нециклической карбонильной формы.
Способность свежеприготовленных растворов моносахаридов изменять угол удельного вращения до достижения равновесия различных форм и постоянного угла удельного вращения носит название мутаротации. Мутаротировать могут только такие соединения, которые имеют свободный полуацетальный гидроксил.
Переход циклических форм одна в другую происходит только через карбонильную форму. Карбонильная форма глюкозы мало устойчива, её концентрация при установившемся равновесии не превышает 0,024 %, поэтому водные растворы глюкозы не дают всех реакций на альдегидную группу, а только некоторые (например, реакцию «серебряного зеркала»), но не реагируют с NaHSO3 и NH3.
Циклические формулы моносахаридов принято изображать с помощью перспективных формул Хеуорса. При написании таких формул учитывают следующие правила: в формуле D-изомера углерод, связанный с полуацетальным гидроксилом, располагают в правом углу кольца, эфирный кислород – за плоскостью. Заместители, расположенные в проекционной формуле с правой стороны, ставят под кольцом, левосторонние заместители и группы – над кольцом. Углеводородные атомы обычно не изображают. Формула Хеуорса более наглядна, она совпадает с формулой Фишера-Толленса. Отличие только в том, что группа СН2ОН, связанная с пятым атомом углерода, частично повёрнута относительно оси, так как такой поворот действительно происходит при циклизации.

Хотя формулы Хеуорса и более наглядны, однако они не совсем точно передают истинное строение моносахаридов. Кольцо тетрагидропирана, как и кольцо циклогексана, не плоское, а изогнутое в пространстве. Причём наиболее устойчивой конформацией является конформация кресла: тогда α-D-глюкопираноза должна существовать в виде конформации 2а, 3е, 4е, 5е-тетраокси-6е-оксиметилпиранозы.
Всё вышеизложенное о строении и таутомерии глюкозы имеет место и в отношении всех других моносахаридов.
Следующим по распространённости представителем гексоз является D (-) фруктоза (фруктовый сахар).

D
(-) фруктоза
β-D
(-) фруктофураноза
α-D
(-) фруктофураноза
Существуют также пиранозные полуацетальные формы. Пространственное расположение Н и ОН у трёх асимметричных атомов углерода фруктозы такое же, как у глюкозы, поэтому фруктоза при определённых условиях может превращаться в глюкозу, и наоборот. Такие соединения называются эпимерами. Всего фруктозе соответствует 23 = 8 оптических изомеров открытого строения и 24 = 16 оптических изомеров циклического строения.
