
- •«Вятский государственный университет»
- •Биоорганическая химия в технологии защиты биосферы
- •Оглавление
- •3. Реакция присоединения галогенов за счёт двойных связей в остатках непредельных кислот. 80
- •Биоорганическая химия Предмет биоорганической химии
- •Углеводы
- •Моносахариды
- •Генетический d-ряд альдотриоз, тетроз, пентоз
- •Пентозы с5н10о5
- •Получение моносахаридов
- •Физические свойства моносахаридов
- •Химические свойства моносахаридов
- •Дисахариды (биозы)
- •Общие химические свойства дисахаридов
- •Собственно полисахариды
- •Крахмал
- •Химические свойства
- •Целлюлоза (клетчатка)
- •Химические свойства
- •Химическая переработка целлюлозы
- •Аминокислоты
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Пептиды, белки
- •Химические свойства
- •Ферменты
- •Понятие о нуклеиновых кислотах
- •Моноглицериды
- •Диглицериды
- •Триглицериды
- •Предельные жирные кислоты
- •Непредельные жирные кислоты
- •Физические свойства
- •Химические свойства
- •Сложные жиры
- •Стерины
- •Гормоны и медиаторы
- •Лабораторный практикум Моносахариды Реакции на гидроксильные группы в моносахаридах
- •Реакции на карбонильные группы в моносахаридах
- •Осмоление моносахаридов
- •Цветные реакции на моносахариды
- •Дисахариды Реакции на гидроксильные группы дисахаридов
- •Реакции дисахаридов по карбонильным группам (сравнение свойств восстанавливающих и невосстанавливающих дисахаридов)
- •Гидролиз (инверсия) сахарозы
- •Реакции сахарозы с сульфатами никеля и кобальта
- •Высшие полисахариды Качественные реакции на углеводы
- •Кислотный гидролиз крахмала
- •Свойства целлюлозы
- •Некоторые свойства хлопкового и искусственных волокон
- •Аминокислоты Свойства аминокислот
- •Свойства шерсти и синтетических волокон
- •Цветные рекции на белки
- •Биуретовая реакция
- •Ксантопротеиновая реакция
- •Реакция на триптофан (реакция Шульце-Распайля)
- •Реакция Адамкевича
- •Реакция на серусодержащие аминокислоты
- •Реакция Фоля на серусодержащие аминокислоты
- •Библиографический список
- •Биоорганическая химия в технологии защиты биосферы
Химические свойства
1. Некоторые свойства аминокислот, в частности высокая температура плавления, объясняются их своеобразным строением. Кислотная (-COOH) и основная (-NH2) группы в молекуле аминокислоты взаимодействуют друг с другом, образуя внутренние соли (биполярные ионы). Например, для глицина:
H2N-CH2-COOH H3N+-CH2-COO- |
2. Вследствие наличия в молекулах аминокислот функциональных групп кислотного и основного характера -аминокислоты являются амфотерными соединениями, т.е. они образуют соли как с кислотами, так и со щелочами:
-
H2N–
CH–COOH + HCl I R
[H3N+–CH–COOH]Cl-
I
R
хлористоводородная соль -аминокислоты
H2N– |
CH–COOH + NaOH I R |
H2N–CH–COO-Na+ + H2O I R натриевая соль -аминокислоты |
3. В реакции со спиртами образуются сложные эфиры:

4. -аминокислоты можно ацилировать, в частности ацетилировать, действуя уксусным ангидридом или хлористым ацетилом. В результате образуются N-ацильные производные -аминокислот (символ «N» означает, что ацил связан с атомом азота):


5. -аминокислоты вступают друг с другом в реакцию поликонденсации, что приводит к образованию амидов кислот. Продукты такой конденсации называются пептидами. При взаимодействии двух аминокислот образуется дипептид:
H2N– |
H I CH– |
O II C–OH + NH2 – |
CH3 I CH– |
O II C–OH → |
|
глицин |
аланин |
||
H2N– |
H I CH– |
O II C–NH– |
CH3 I CH– |
O II C–OH + H2O |
|
глицилаланин |
|
||
При конденсации трёх аминокислот образуется трипептид и т.д.
Связь - |
O II C–NH – называется пептидной связью. |
Пептиды, белки
Пептиды и белки представляют собой высокомолекулярные органические соединения, построенные из остатков -аминокислот, соединенных между собой пептидными связями.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами для живых организмов, регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д. Таким образом, функции белков в природе универсальны. Белки входят в состав внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником -аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают -аминокислоты. Многие -аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков -аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин, триптофан и др. (см. табл. 1). При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.
Протяженные амиды, образовавшиеся в результате взаимодействия некоторого числа аминокислот, называются пептидами. Амидные связи, находящиеся в составе пептидов, называют пептидными связями. Пептиды и белки различают в зависимости от величины молекулярной массы. Условно считают, что пептиды содержат в молекуле до 100 (соответствует молекулярной массе до 10000), а белки – свыше 100 аминокислотных остатков (молекулярная масса от 10000 до нескольких миллионов). При этом в пептидах различают олигопептиды, содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, содержащие до 100 аминокислотных остатков.
Конструкция полипептидной цепи одинакова для всего многообразия пептидов и белков. Эта цепь имеет неразветвленное строение и состоит из чередующихся метиновых (CH) и пептидных (CONH) групп. Различия такой цепи заключаются в боковых радикалах, связанных с метиновой группой и характеризующих ту или иную аминокислоту. Та часть молекулы, в которой сохранилась не включенная в пептидную связь аминогруппа, называется N-концевой, а несущая ее аминокислота – N-концевым аминокислотным остатком, или N-концом пептида. Часть пептида, в которой осталась свободная карбоксильная группа, называется С-концевой, а аминокислота, включающая такую группу, представляет собой С-концевой аминокислотный остаток, или С-конец. При изображении формулы пептида N-конец располагают слева, а С-конец – справа:

Название пептида формируется путем последовательного перечисления входящих в его состав аминокислот начиная, с N-конца. При этом суффикс «-ин» заменяется на суффикс «-ил» для всех аминокислот, кроме С-концевой, например:
фенилаланил | глицил | метионин — трипептид.
N-конец С-конец
Из пептидов важнейшее значение имеют полипептиды – б е л к и.
В образовании полипептидных цепей белков принимает участие
n = 102 – 105 молекул аминокислот. Некоторые гигантские молекулы белков способны к самостоятельному существованию как живые организмы (фильтрующийся вирус). Они делятся на белки, состоящие только из остатков аминокислот (простые белки, или протеииы), и на белки, в состав которых помимо аминокислот входят остатки соединений небелковой природы (сложные белки, или протеиды). Небелковая часть молекулы называется простетической группой и определяет подразделение белков на:
а) гликопротеиды (аминокислоты + углеводы);
б) нуклеопротеиды (аминокислоты + нуклеотиды);
в) липопротеиды (аминокислоты + липиды);
г) фосфопротеиды (аминокислоты + фосфорная кислота);
д) металлопротеиды (аминокислоты + ионы металлов).
Отнесение белка к тому или иному классу делается на основе определения его первичной структуры, т. е. последовательности аминокислот, отсутствия или наличия простетической группы, состава простетической группы.
Для полипептидов и белков характерны четыре уровня пространственной организации, которые принято называть первичной, вторичной, третичной и четвертичной структурами.
Первичная структура белка – специфическая аминокислотная последовательность, т.е. порядок чередования -аминокислотных остатков в полипептидной цепи.
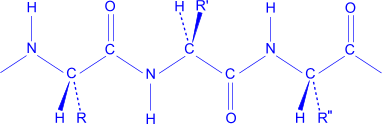
Вторичная структура белка – конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве. Характер пространственной структуры обусловлен образованием пяти типов связей между аминокислотными остатками:
1) дисульфидные мостики;
2) водородные связи;
3) ионные связи;
4) гидрофобные связи;
5) гидратируемые группы.
Дисульфидные мостики образуются между остатками цистеина за счет окисления тиольных групп в дисульфидные:

Водородные связи могут образовываться между карбонильной группой одной пептидной связи и группой NН другой связи. Наиболее стабильной оказывается структура, допускающая образование максимального числа таких связей.
Полипептидной цепи могут существовать в нескольких видах: -форма; -спираль; неупорядоченная структура.
Для межцепочечного связывания характерна -форма. В ней полипептидные цепи расположены в плоскости и слегка изогнуты. Несколько цепей образуют слой, изгибы которого похожи на складки ткани или бумаги. Соседствующие цепи ориентированы антипараллельно и связаны между собой водородными связями. Структура -складчатого слоя встречается в белках типа шёлка или кератина.
За счёт внутрицепочечного образования водородных связей возникает -спираль. Это возможно только в том случае, если основная цепь сворачивается в спираль с шагом в 3,6 аминокислотных остатка. Поскольку все природные аминокислоты принадлежат к L-ряду (имеют S-конфигурацию), спираль является правой. Как правило, -спиральной структурой обладает только часть (от 5 до 80 %) полипептидной цепи. Например, цепь миоглобина спирализована лишь на 75 %.
Неупорядоченная структура характерна только для отдельных фрагментов цепи, которые появляются обычно между спирализованными и складчатыми участками в ходе формирования третичной структуры белка.
Ионные связи являются результатом электростатического взаимодействия и появляются в тех случаях, когда в боковой цепи имеются заряженные группы
(-аминогруппы лизина, гуанидиновая группировка аргинина, основные атомы азота имидазольного кольца гистидина, - и -карбоксилатанионы аспарагиновой и глутаминовой кислот).
Гидрофобная связь – это результат несвязанного взаимодействия неполярных алкильных групп в боковых цепях аминокислот (аланин, валин, лейцин, изолейцин) за счет сил притяжения Ван-дер-Ваальса.
Гидратируемые группы оказывают влияние на формирование вторичной структуры белка тогда, когда молекулы воды, окружающие белковую молекулу, могут образовывать структуру, подобную структуре льда. В этом случае водный слой способствует стабильности именно той формы белковой молекулы, которая обеспечивает указанную возможность.
Из всех перечисленных вариантов внутри- и межмолекулярных взаимодействий при изменениях рН, ионной силы и полярности растворителя неизменными остаются только дисульфидные мостики. Они разрушаются только под действием восстановителей.
Компактная, плотная структура, образующаяся при укладке организованной во вторичную структуру молекулы белка, называется третичной структурой. Различают белки фибриллярные (нитевидные), не растворимые в воде, водных растворах кислот, оснований, солей, и глобулярные, третичная структура которых имеет вид компактных клубочков. Глобулярные белки растворимы в воде, кислотных, основных и солевых растворах.
Примером фибриллярных белков могут служить кератины, коллаген, эластин, миозин, фиброин. К глобулярным относятся ферменты, гормоны, глобулины, альбумины и др.
У ряда белковых соединений несколько полипептидных цепей белка могут интегрироваться вместе, создавая более сложный комплекс определенного строения, называемый четвертичной структурой белка. Каждая полипептидная цепь такого комплекса называется субъединицей и сохраняет свойственную ей первичную, вторичную и третичную структуры. Фиксация четвертичной структуры обеспечивается водородными связями и гидрофобными взаимодействиями между субъединицами.
Наличие четвертичной структуры характерно, например, для гемоглобина и других металлопротеидов, а также для иммуноглобулинов.
При образовании пептида из аминокислот с отщеплением воды (реакция поликонденсации) идёт одновременный гидролиз пептидной связи, т. е. реакция обратима. В обычных условиях равновесие смещено в сторону гидролиза, поэтому для синтеза пептидов используют не сами аминокислоты, а их более реакционноспособные производные (такой прием называют активированием аминокислот). Обычно используют хлорангидриды, азиды, сложные эфиры, карбодиимиды, содержащие группировку — N=С=N —. Во всех этих соединениях электронная плотность у карбонильного углерода понижена.
Синтез пептида с заданной последовательностью аминокислот возможен лишь при условии, что те аминные или карбоксильные группы, которые не должны участвовать в реакции, будут заранее защищены. Для защиты аминогруппы используют её ацилирование бензиловым эфиром хлоругольной кислоты С6Н5СН2ОСОС1; образование N-n-толуолсульфопроизвод-ных при действии п-толуолсульфохлорида СН3С6Н5 S02Cl; образование трифенилметилпроизводных и др. Карбоксильную группу обычно защищают путём этерификации.
Изменение условий, в которых находится молекула белка: изменение рН среды, повышенная температура, облучение УФ-светом, рентгеновскими лучами, повышенное давление, ультразвук, сильное механическое воздействие, соли тяжелых металлов – приводят к разрушению связей, обеспечивающих сохранение четвертичной, третичной и даже вторичной структур. Этот процесс называют денатурацией белка. Денатурация может быть обратимой (если изменение структуры устранимо) и необратимой.
