
Учебник Органическая химия Щеголев 2016
.pdf
пространения. В естественном свете такие колебания происходят в разных плоскостях, а в поляризованном — только в одной плоскости.
поляризованный свет неполяризованный свет (стрелками обозначена плоскость электромагнитных колебаний)
При прохождении луча плоскополяризованного света через раствор оптически активного вещества плоскость поляризации этого луча отклоняется на некоторый угол , то есть происходит поворот луча плоскополяризованного света.
Оптическая активность веществ связана с наличием в их молекулах атомов углерода, имеющих четыре разных заместителя и называющихся
асимметрическими или хиральными (от греческого — рука). Оптиче-
ская изомерия обусловлена различным расположением в пространстве заместителей при асимметрическом атоме углерода. Например, в молекуле
H
X C Y
Z
атом углерода связан -связями с четырьмя различными заместителями, то есть он находится в центре тетраэдра. Но такой структурной формуле могут соответствовать две разных пространственных:
H |
|
|
|
H |
X |
Y |
Y |
|
X |
|
|
|||
|
|
|
||
Z |
и |
|
Z |
|
Они не идентичны друг другу, поскольку их невозможно совместить, но они являются зеркальным отображением друг друга. Молекулы, имеющие такие пространственные формулы, называются энантиомерами или зеркальными изомерами, или антиподами. Энантиомеры поворачивают луч плоскополяризованного света на один и тот же угол, но в разные стороны. Для обозначения правовращающего изомера используют знак (+), левовращающего — знак (–).
61

Хиральный атом углерода в составе молекулы иногда обозначают звѐздочкой «*», например, C*HXYZ. Молекулы, имеющие в своем составе хиральный атом углерода, также называются хиральными.
Итак, необходимым условием появления таких пространственных
изомеров является наличие четырѐх различных заместителей у тетраэд-
рического углерода. Если среди окружения атома углерода будут хотя бы две одинаковые атомные группировки
H
X









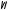

 Y
Y
H ,
то молекула не будет хиральна, так как зеркальное изображение еѐ в пространстве можно совместить с оригиналом, оптическая изомерия отсутствует.
Для различия названий пространственных изомеров Р. Кан*, К. Ингольд* и В. Прелог* в 1951 году разработали удобную систему обозначения конфигурации хиральных центров молекул. В этой системе первоначально определяют порядок старшинства заместителей у хирального центра. Чем больше порядковый номер химического элемента в Периодической таблице, тем старше заместитель. Затем располагают модель молекулы так, чтобы самый младший заместитель был удалѐн от наблюдателя, а остальные три — приближены к нему. Если атомные номера этих трѐх заместителей убывают по часовой стрелке, конфигурацию обозначают буквой R (от латинского rectus – правый), если против часовой стрелки — буквой S (от латинского sinister – левый). Например, для энантиомеров бромфторхлорметана CHBrFCl это будет выглядеть так:
|
F |
|
F |
|
H |
|
H |
Cl |
Br |
Br |
Cl |
(R)-бромфторхлорметан |
(S)-бромфторхлорметан |
||
В случае более сложных заместителей их старшинство определяется порядковым номером первого атома (т.е. непосредственно связанного с хиральным центром). Если же первые атомы одинаковы, то старшинство между этими заместителями устанавливается по сумме вторых атомов и т.д.
Таким образом, по системе Кана–Ингольда–Прелога можно установить R- или S-конфигурацию любого оптического изомера, в том числе и среди углеводородов. Например, для простейшего из алканов, молекулы которого
62

обладают хиральностью, пространственное расположение заместителей вокруг асимметрического атома углерода может быть таким:
CH2CH2CH3
H
CH3CH2  CH3
CH3
(S)-3-метилгексан
Данная система определения конфигурации (R- или S-) является абсолютной. Существует ещѐ система определения относительной конфигурации (D- или L-) по конфигурации соответственно D- или L-глицеринового альдегида. Но она пригодна далеко не для всех веществ и широко применяется для аминокислот, сахаров, гидроксикислот, родственных им соединений, природных веществ, обладающих оптической активностью.
Для этого строение молекулы данного оптического изомера изображают при помощи проекционных формул, предложенных в 1890 году немецким химиком Э. Фишером* первоначально для углеводов. Для перевода тетраэдрических изображений в плоскостные руководствуются следующими правилами.
Наиболее длинную углеродную цепь молекулы (но обязательно содержащую хиральный центр) располагают вертикально, при этом наиболее окисленный атом углерода должен быть наверху, или более строго — чтобы нумерация атомов в этой цепи по заместительной номенклатуре осуществлялась сверху вниз.
Два других заместителя хирального атома углерода, находящиеся в тетраэдрическом изображении на переднем плане, располагают горизонтально.
Тетраэдр проецируют на плоскость, то есть как бы сплющивают.
Применим эти правила для изображения проекционной формулы одного из оптических изомеров молочной кислоты CH3-*CHOH-COOH
|
COOH |
|
|
COOH |
|
|
COOH |
|
|||||||||
|
|
H |
|
|
|
OH |
|
H |
|
|
|
* |
|
OH |
|||
|
|
|
|
|
|
|
|
||||||||||
|
* |
|
OH |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
H |
|
|
CH3 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
CH3 |
|
||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
Для отнесения к D- или L-ряду сравнивают расположение атома водорода и гидроксигруппы у хирального центра с расположением этих же групп
63
в молекуле D- или L-глицеринового альдегида, взятого за своеобразный стандарт:
|
HC=O |
|
|
HC=O |
|
||||||
H |
|
|
|
* |
OH |
HO |
|
|
|
* |
H |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
CH2OH |
|
CH2OH |
||||||||
D-глицериновый альдегид |
L-глицериновый альдегид |
||||||||||
В нашем примере, таким образом, оптический изомер молочной кислоты относится к D-ряду. Соответственно, может существовать и другой оптический изомер, имеющий иное расположение атома водорода и ОН-группы относительно асимметрического центра:
|
COOH |
|
|
COOH |
||||||||
H |
|
|
|
* |
|
OH |
HO |
|
|
|
* |
H |
|
|
|
|
|
|
|
||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
CH3 |
и |
|
CH3 |
|
|||||||
D-молочная кислота |
L-молочная кислота |
|
||||||||||
Формулы Фишера можно как угодно поворачивать в плоскости листа, но нельзя вынимать из плоскости и переворачивать. Этим они отличаются от обычных структурных формул.
Смесь равных количеств двух энантиомеров называется рацемической смесью или рацематом. Рацемат, в отличие от антиподов, не обладает оптическими свойствами, то есть он оптически не активен; можно представить, что оптическая активность одного антипода нейтрализуется противоположной оптической активностью другого.
При наличии в молекуле нескольких асимметрических атомов число оптических изомеров увеличивается. При этом при числе асимметрических центров n максимальное количество оптических изомеров N вычисляется по формуле: N = 2n. В качестве примера оптически активного соединения с несколькими хиральными атомами углерода можно взять 2,3-дигидрокси- бутановую кислоту CH3-*CHOH-*CHOH-COOH. Здесь два хиральных центра и, следовательно, должно быть четыре оптических изомера. Изобразим их с помощью проекционных формул Фишера.
64
|
|
COOH |
|
|
COOH |
|
|
COOH |
|
|
COOH |
||||||||||||||||||||
H |
|
|
|
|
* |
|
OH |
HO |
|
|
|
|
* |
|
H |
H |
|
|
|
|
* |
|
OH |
HO |
|
|
|
|
* |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
* |
|
|
|
|
|
* |
|
|
|
|
* |
|
|
|
|
* |
|||||||||||
|
|
|
|
||||||||||||||||||||||||||||
H |
|
|
|
|
|
OH |
HO |
|
|
|
|
H |
HO |
|
|
|
|
|
H |
H |
|
|
|
|
|
OH |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
||||||||||||
|
(1) |
|
|
|
|
(2) |
|
|
|
(3) |
|
|
|
(4) |
|
|
|||||||||||||||
Изомеры 1 и 2 по отношению друг к другу, а также 3 и 4 по отношению друг к другу являются антиподами, то есть зеркальным отображением друг друга. А оптические изомеры 1 и 3, 1 и 4, 2 и 3, 2 и 4 не являются оптическими антиподами. Такие оптические изомеры называются диастереомерами. Диастереомеры – это оптические изомеры, содержащие хотя бы одну пару асимметрических атомов с одинаковой конфигурацией, в отличие от энантиомеров, в молекулах которых конфигурации всех хиральных атомов противоположны. В отличие от антиподов диастереомеры имеют различные между собой физические свойства, так как в их молекулах отдельные фрагменты по-разному располагаются относительно друг друга, и их взаимное влияние различно.
Для различия стереоизомеров, содержащих два хиральных центра, используют также названия эритро-форма и трео-форма. Эритро-изомерами называются те, в проекционных формулах которых боковые неводородные заместители находятся на одной стороне; трео-изомеры имеют боковые заместители на разных сторонах проекционных формул. Так, из вышеприведѐнных примеров стереоизомерных 2,3-дигидроксибутановых кислот формулы 1 и 2 относятся к эритро-изомерам, a формулы 3 и 4 — к трео- изомерам.
Поскольку диастереомеры различаются по физическим свойствам, разделение их смесей обычно не вызывает затруднений. Для этого используют различия в растворимости (разделение кристаллизацией), различие в температурах кипения (разделение перегонкой), различия в адсорбционной способности (разделение с помощью различных хроматографических методов). В отличие от этого энантиомеры различаются только направлением вращения луча плоскополяризованного света, ни по каким другим свойствам они не различимы и, следовательно, никакими обычными физическими методами разделить пару оптических антиподов непосредственно нельзя.
В основе почти всех современных методов разделения рацематов лежат классические работы Л. Пастера. Эти работы дали следующие основные методы разделения рацемических смесей:
65

1.Механический способ применим, если при кристаллизации энантиомеры образуют кристаллы различной формы. Разделение проводят при помощи лупы и пинцета. Путѐм механического отбора кристаллов Пастер в 1848 году впервые выделил оптически активное вещество.
2.Биологический способ заключается в преимущественном разрушении микроорганизмами только одного из оптических антиподов. При этом если действию микроорганизмов подвергается рацемат, то за счѐт разрушения одного антипода другой энантиомер остаѐтся в чистом виде. В 1857 году Пастер наблюдал поглощение D-винной кислоты плесневым грибком Penicillum glaucum.
3.Химический способ заключается в образовании диастереомеров или, как вариант, молекулярных комплексов. Практически наиболее важным является способ разделения через диастереомеры. Сущность этого метода может быть выражена схемой:
D1 . L1 + D2 
 D1 . D2
D1 . D2
L1 . D2
Рацемическая смесь D1 L1 подвергается действию оптически активного реагента D2. При этом образуется новая пара веществ D1 D2 и L1 D2, являющихся диастереомерами по отношению друг к другу. Диастереомеры можно разделить на основании различия их физических свойств (см. выше).
Примером может служить расщепление рацемической смеси D- и L- молочных кислот с помощью оптически активного амина:
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
COO- |
|
|
|
|
|
|
CH3 |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* |
|
|
|
|
|
|
|
|
|
|
|
|
|
* |
|
+ |
|
|
H |
|
|
|
|
OH |
|
CH3 |
|
|
|
|
|
|
H |
|
|
|
|
OH |
|
|
H |
|
|
|
|
NH3 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
+ H |
|
|
|
* |
|
NH2 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
|
||||||||||||||||
|
COOH |
|
|
|
|
|
|
|
|
|
COO- |
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
C2H5 |
|
|
|
+ |
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
* |
|
|
|
|
|
|
|
|
* |
|
|
|
|
|
|
|
|
|
|
|
|
|
* |
|
|
|
|||||||||||||
HO |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
H |
|
H |
|
|
|
|
NH3 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
Образующиеся соли диастереомерны, обладают разной растворимостью, на основании чего и могут быть разделены.
66
1.7.2. ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
Геометрическая изомерия — разновидность стереоизомерии, которая определяется различием пространственного расположения в молекулах пары заместителей относительно плоскости двойной связи или цикла. Геометрическая изомерия возможна только в том случае, когда каждый из атомов углерода, образующих двойную связь (или цикл), имеет разные между собой заместители. Так, в структуре бут-2-ена у каждого из двух атомов углерода двойной связи разные заместители (СН3 и Н):
СН3-СН=СН-СН3
Геометрическая изомерия ещѐ называется цис-транс-изомерией. В наиболее простых случаях цис-изомером является соединение, в котором оба атома водорода располагаются по одну сторону плоскости двойной связи, а транс-изомером — соединение с расположением атомов водорода по разные стороны двойной связи. Например, для стереоизомеров бут-2-ена
CH3 |
CH3 |
H |
CH3 |
C = C |
|
C = C |
|
H |
H |
CH3 |
H |
цис-бут-2-ен |
|
транс-бут-2-ен |
|
Однако в общем случае, например, |
|
||
|
Cl |
H |
|
C = C |
|
CH3 |
C2H5 , |
для того, чтобы определить, является ли данное соединение цис- или транс- изомером, необходимо использовать систему старшинства заместителей Ка- на–Ингольда–Прелога (см. оптическую изомерию — гл. 1.7.1). Если старшие заместители расположены по разные стороны плоскости двойной связи, то это — транс-изомер или конфигурацию называют Е (Entgegen — напротив), а если по одну сторону — цис-изомер или Z-конфигурация (Zusammen — вместе). В приведѐнном примере изображѐн транс-изомер (транс-2- хлорпент-2-ен или Е-2-хлорпент-2-ен), так как старшими заместителями являются заместители Cl (старше, чем СН3) и С2Н5 (старше, чем Н).
В молекулах геометрических изомеров атомы по-разному расположены в пространстве относительно друг друга. Этим обусловлены различия их физических и химических свойств.
67

1.7.3.КОНФОРМАЦИОННАЯ ИЗОМЕРИЯ
Вмолекулах отдельные структурные элементы (атомы и атомные группировки) совершают вращательные и колебательные движения относительно друг друга, в том числе возможно свободное вращение вокруг угле-
род-углеродных -связей. Таким образом, молекулы алканов могут иметь множество положений атомов в пространстве, что является следствием такого вращения. Конформационная изомерия как вид стереоизомерии связана с различным пространственным расположением атомов в молекуле, обусловленным таким вращением. Поэтому конформационная изомерия характерна для всех органических соединений (за исключением наиболее простых), в том числе и для насыщенных углеводородов, начиная с этана C2Н6.
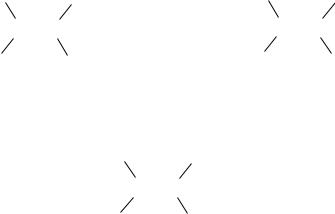
Различные положения атомов и атомных группировок в пространстве, возникающие в результате их вращения вокруг -связей, называются конформациями данной молекулы. Те состояния, которые отвечают минимумам (а иногда считается, и максимумам) на энергетической диаграмме, именуются конформационными изомерами или конформерами. Их взаимные переходы обозначаются как конформационные переходы. В реальности жидкие и газообразные вещества существуют в виде смесей конформеров, среди которых преобладают энергетически более выгодные.
Для лучшего рассмотрения этих конформаций модели молекул проецируются на плоскость (проекции Ньюмена*). На рисунке наблюдатель смотрит вдоль оси связи C–C (относительно которой рассматриваются конформации) и видит, что один атом углерода находится за другим. Ближайший к наблюдателю атом углерода изображают точкой; от него идут три связи к трѐм другим атомам. Более удаленный атом углерода изображают в виде круга; принадлежащие ему заместители как бы «высовываются» из-за круга.
Рассмотрим внутримолекулярное вращение этана H3C–CH3 вокруг связи C–C. В этом процессе одна из метильных групп молекулы может занимать относительно другой метильной группы множество положений, из которых два (А и В)
(А) (В)
представляют особый интерес. Изобразим их проекционными формулами Ньюмена:
68

|
|
H |
|
|
H H |
H |
|
H |
|
|
|
|
|
|
|
||
|
|
|
|
|
H |
H |
|
|
H |
H |
H |
|
|
H |
|
|
H |
|
|
|
|
|
|
|
(А) |
|
|
(В) |
|
Угол поворота одной атомной группировки относительно другой обозначается и называется торсионным углом. При значениях = 0° (360°), 120° и 240° (–120°) атомы водорода находятся один за другим (максимально сближены в пространстве). Такую конформацию (В) называют заслонѐнной. За счѐт ван-дер-ваальсового отталкивания атомов и отталкивания спаренных электронов химической связи эта конформация обладает максимальной конформационной энергией (наименее стабильна). При значениях = 60°, 180° и 300° (–60°) атомы водорода максимально удалены один от другого. Эта конформация (А), которую называют заторможенной, скошенной или гош- конформацией, обладает минимальной конформационной энергией (наиболее стабильна). В случае этана три энергетические ямы при заторможенной конформации и три энергетических барьера при заслонѐнной конформации одинаковы.
Между двумя экстремальными случаями существуют промежуточные конформации. Вращение от устойчивой и до неустойчивой конформации требует определѐнной энергии. Величина энергетического барьера, затрудняющего превращение заторможенного конформера в заслонѐнный, называ-
ется поворотной или торсионной энергией, или торсионным напряжением.
Для этана эта энергия составляет 12 кДж/моль, что при обычных условиях соответствует частоте перехода из одной гош-конформации в другую, равной 1010 с-1 (каждую секунду происходит 1010 переходов). В то же время на 10 000 молекул этана, обладающих заторможенной конформацией, приходится лишь одна, обладающая заслонѐнной конформацией. Энергетическая диаграмма внутримолекулярного вращения этана изображена на рисунке 1.1.
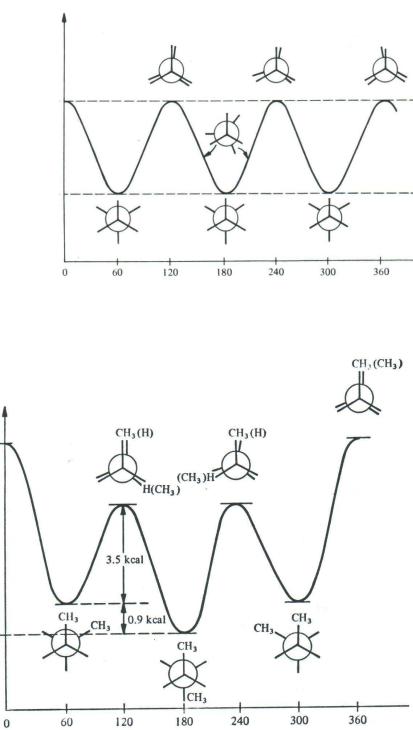
Сложнее обстоит дело с соединениями типа RCH2-CH2R. Рассмотрим конформации бутана (R = CH3), возникающие при его внутримолекулярном вращении относительно центральной C–C связи (рис.1.2).
69
Энергия |
|
|
Рис. 1.1. Энергетическая диаграмма внутримолекулярного вращения этана Энергия
Рис.1.2. Энергетическая диаграмма внутримолекулярного вращения бутана относительно связи С2–С3
Зависимость конформационной энергии от торсионного угла 1,2-ди- замещѐнных этанов в принципе схожа с энергетической кривой незамещѐнного этана. Однако глубина энергетических ям и высота энергетических барьеров в этом случае различны. Самый глубокий минимум принято называть глобальным, остальные — локальными. Свободному вращению вокруг-связи препятствуют громоздкие заместители у атомов углерода. Таким об-
70
