
Учебник Органическая химия Щеголев 2016
.pdf
пример, гексадец-1-ен окисляется до гексадекан-1,2-диола через 1,2- эпоксипроизводное:
CH2=CH-(CH2)13-CH3 |
|
|
CH2-CH-(CH2)13-CH3 |
|
|
|
CH2-CH-(CH2)13-CH3 |
||
|
|
|
|
|
|||||
|
|
||||||||
|
|
|
O |
|
OH OH |
||||
Этилен — бесцветный газ со слабым запахом. Незначительно растворяется в воде, лучше — в этаноле; хорошо растворим в диэтиловом эфире, горит коптящим пламенем. В промышленности получают из газов пиролиза и крекинга нефти, которые содержат до 20% этилена.
Этилен служит исходным сырьѐм для множества синтезов (например, для синтеза этанола, этиленгликоля, уксусного альдегида, полиэтилена и др.).
Полиэтилен (-СН2-СН2-)n, получающийся при полимеризации этилена,
— простейший углеводородный полимер. Полимеризацией под высоким давлением получают полиэтилен низкой плотности. Он нерастворим в большинстве органических кислот, устойчив к действию кислот и щелочей. Обладает большой эластичностью, плавится в интервале 110 125 С. Плѐнку из полиэтилена низкой плотности используют для упаковки медикаментов, пищевых продуктов, для литья бутылок; из полиэтилена данной модификации изготавливают шприц-тюбики для упаковки глазных капель.
Пропилен — бесцветный газ со слабым запахом. В промышленности получают из газов крекинга и пиролиза при переработке нефтяных продуктов, которые содержат 5 8% пропилена. Чистый пропен получают при дегидрировании пропана.
Используется в органическом синтезе для получения изопропилового спирта, глицерина, ацетона, полипропилена и др.
Полипропилен получают при полимеризации пропилена.
CH CH2
CH3 n
Он превосходит полиэтилен по химической стойкости, прочности на разрыв и теплостойкости. Из него изготавливают детали и узлы аппаратов искусственного кровообращения, упаковочные плѐнки, волокна, трубопроводы, резервуары для хранения жидкостей.
4.3. ДИЕНОВЫЕ (И ПОЛИЕНОВЫЕ) УГЛЕВОДОРОДЫ
Синоним диеновых углеводородов — алкадиены. Диеновые углеводороды содержат в своѐм составе две двойные связи, в молекулах полиеновых
211
углеводородов — несколько двойных связей. Строением и свойствами очень похожи на этиленовые углеводороды, однако из-за различного взаимного расположения двойных связей у них имеются и особенности.
4.3.1. КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА
Диеновые углеводороды в зависимости от взаимного расположения двойных связей делятся на несколько групп:
1)диены с кумулированными двойными связями (кумулированные диены, аллены) — углеводороды, в молекулах которых один из атомов углерода образует две двойные связи. Первым представителем этой группы явля-
ется аллен Н2C=C=CН2 ;
2)диены с - -сопряжѐнными двойными связями (сопряжѐнные диены) — углеводороды, в молекулах которых двойные связи разделены только одной -связью. Родоначальником ряда сопряжѐнных диенов является ди-
винил Н2C=CH-CH=CН2 ;
3)диены с изолированными двойными связями — углеводороды, в молекулах которых двойные связи разделены более чем одной -связью. В таких
молекулах между атомами углерода двойных связей может быть один или несколько sp3-гибридизованных атомов углерода, например:
Н2C=CH-CН2-CH=CН2 |
Н2C=CH-CН2-CН2-CH=CН2 |
пент-1,4-диен |
гекс-1,5-диен |
Тривиальные названия некоторых диеновых и полиеновых углеводородов применяются достаточно широко. Это аллен (см. выше), эритрен, дивинил, изопрен, пиперилен и др.
|
|
CH3 |
|
|
|
|
|
Н2C=CH-CH=CН2 |
CH2=C-CH=CH2 |
Н2C=CH-CH=CН-CH3 |
|
эритрен, дивинил |
изопрен |
пиперилен |
|
Среди систематических названий наибольшее распространение получила заместительная номенклатура ИЮПАК. Для кумулированных диенов распространены названия и по рациональной номенклатуре — как производные аллена. При этом названия любых диеновых (и полиеновых) углеводородов строятся аналогично этиленовым; для обозначения нескольких двойных связей в молекуле используются суффиксы -диен, -триен и т.д., где ди-, три- — числовые приставки.
212

4.3.2. ОСОБЕННОСТИ СТРОЕНИЯ И СВОЙСТВ АЛЛЕНОВ
В аллене у центрального атома углерода атомные орбитали sp-гибридизованы. Все три атома углерода находятся на одной прямой, а плоскости -связей взаимно перпендикулярны. Длина C=C-связи меньше, чем в алкенах, и это
объясняется меньшей протяжѐнностью sp-гибридной орбитали центрального атома углерода, за счѐт которой образуется эта связь.
Благодаря такому строению для замещѐнных алленов характерна стереоизомерия. Например, приведѐнные ниже структуры являются зеркальными отображениями друг друга:
H |
CH3 |
|
H |
|
CH3 |
||
C = C = C |
|
|
C = C = C |
CH3 |
H |
H |
CH3 |
|
|
В молекулах таких алленов нет центров хиральности. Их асимметрия определяется характером расположения заместителей относительно оси
C—C—C, называемой осью хиральности.
Из-за образования одним атомом углерода двух -связей в молекулах алленов возникает дополнительное напряжение, делающее их менее стабильными по сравнению с другими диеновыми углеводородами. По этой причине реакции, являющиеся общими для углеводородов с двойными связями, для алленов протекают несколько легче.
Гидратация приводит к получению кетонов:
|
|
+ |
H O |
: |
|
|
|
O |
|
||
H |
|
|
|
|
= |
|
|||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||
CH2 = C = CH2 + H2O |
|
|
|
CH = C - CH |
|
|
|
CH - C - CH |
|
||
|
|
|
|
3 |
|
|
3 |
||||
|
|
|
|
|
2 |
|
|
3 |
|||
Здесь наблюдается быстрая изомеризация непредельного спирта (енола) в ацетон.
Изомеризация
Под действием оснований аллены изомеризуются в ацетиленовые углеводороды — более устойчивые соединения:
H |
|
- |
|
- |
|
|
- |
|
ROH |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||
R-C=C=CH |
RO |
|
R-C=C=CH |
|
|
|
R-C=C-CH |
|
R-C |
C-CH3 |
||
|
|
2 |
|
|
2 |
-RO- |
||||||
|
2 -ROH |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
213
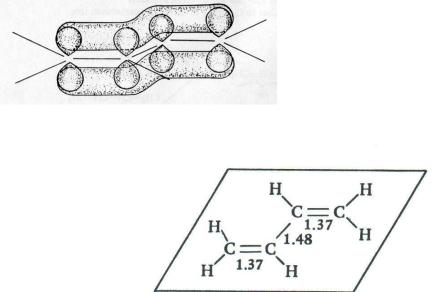
4.3.3. СТРОЕНИЕ И СВОЙСТВА СОПРЯЖЁННЫХ ДИЕНОВ
Электронное строение сопряжѐнных диенов является примером неполярного - -сопряжения, которое было рассмотрено ранее (гл. 1.4). В связи с этим сопряжѐнный фрагмент в молекулах этих углеводородов планарен, двойные связи имеют бóльшую длину, чем углерод-углеродная связь в этилене, а связь между вторым и третьим атомами углерода в этом сопряжѐнном
фрагменте, напротив, короче обычной ординарной связи:
Сравните с длинами связей в этилене и этане (гл. 1.2).
Кроме того, энергетический барьер вращения вокруг связи С2–С3 в бут- 1,3-диене ( 21 кДж/моль) значительно больше, чем в этане ( 12.6 кДж/моль). Поэтому бут-1,3-диен по сравнению с этаном может дольше находиться в форме энергетически выгодных конформеров.
Химические реакции сопряжѐнных диенов, как правило, затрагивают общую систему -связей. Поэтому при протекании реакций, являющихся общими для непредельных углеводородов, необходимо учитывать некоторые особенности, обусловленные наличием сопряжѐнного фрагмента.
Гидрирование
Присоединение водорода на катализаторах (гл. 4.1.4.4) приводит к получению насыщенных углеводородов (гидрируются сразу две двойных связи), при этом выделяется значительно меньше тепловой энергии в расчѐте на одну связь, чем при гидрировании этилена, что говорит о низкой потенциальной энергии таких молекул и, соответственно, их стабильности вследствие сопряжения.
Восстановление атомарным водородом (водородом в момент выделения), то есть при использовании для восстановления металлического натрия в спирте или цинка в серной кислоте, протекает более избирательно. Взаимодействие диена здесь происходит не с атомом водорода, как это иногда представляют, а с активным металлом:
214

|
|
|
|
. |
. |
2Na. |
|||||
- |
CH2=CH-CH=CH2 |
|
|
|
|
CH2-CH=CH-CH2 |
|
|
|||
|
|
|
|
|
|
||||||
- |
|
+ |
|
2ROH |
CH3-CH=CH-CH3 |
||||||
|
|
||||||||||
|
|
|
|
||||||||
CH2-CH=CH-CH2 |
|
Na2 |
|
|
|
|
|
||||
|
-2RONa |
||||||||||
|
|
|
|
|
|
|
|||||
Аналогично происходит восстановление сопряжѐнных триенов. Так, при взаимодействии гекс-1,3,5-триена с цинком в серной кислоте первоначально образуется сопряжѐнный диен, который затем гидрируется до этиленового углеводорода:
Zn/ H2 SO4 |
|
Н2C=CH-CН=СН-CH=CН2 Н3C-CH=CН-СН=СН-CH3 |
|
Zn/ H2 SO4 |
|
Н3C-CH2-CН=СН-CH2-CН3 |
|
Электрофильное присоединение
Направление присоединения электрофилов к сопряжѐнным диенам имеет некоторые особенности. В качестве примера рассмотрим взаимодействие бут-1,3-диена с бромоводородом. Реакция начинается с атаки протоном одной из связей субстрата и после -комплекса образуется -комплекс, представляющий собой карбокатион аллильного типа (от назв. соответствующего радикала «аллил»), стабилизированный р- -сопряжением:
Н2C=CН-СН=СН2 + Н+ Н3C-+CH-СН=СН2
Однако вследствие сопряжения возможна и другая граничная структура такого катиона с переносом положительного заряда:
[Н3C-+CH-СН=СН2 Н3C-CH=СН-+СН2]
Поскольку в карбокатионе положительный заряд распределѐн главным образом между двумя атомами углерода, то карбокатион может атаковаться бромид-ионом по двум направлениям:
|
|
|
|
|
|
|
|
|
Br |
|
4 |
|
|
|
|
|
|
- |
|
a |
1 |
2 |
|
3 |
|
|
|
|
|
|
|
|
||||||
|
1/2+ |
|
1/2+ |
|
|
CH3 |
- CH - CH=CH2 |
|||||
CH3-CH CH |
CH2 |
+ |
Br |
|
b |
1 |
2 |
3 |
4 |
|||
|
||||||||||||
1 |
2 |
3 |
4 |
|
|
|
|
CH3 |
- CH=CH - CH2Br |
|||
|
|
|
|
|
|
|
|
|||||
Первое направление (а) именуют 1,2-присоединение, так как реагент (бромоводород) присоединяется к первому и второму атомам в сопряжѐнном фрагменте диенового углеводорода; второе направление (b) называют 1,4-присоединение — в этом случае реагент (бромоводород) присоединяется
кпервому и четвѐртому атомам в сопряжѐнном фрагменте.
Вобщем случае реакция может идти как по направлению а, так и по направлению b. Однако 1,2-присоединение протекает легче, с большей скоростью, но при этом образующийся продукт малоустойчив и может распадаться на исходные вещества. В противоположность этому 1,4-при-
215
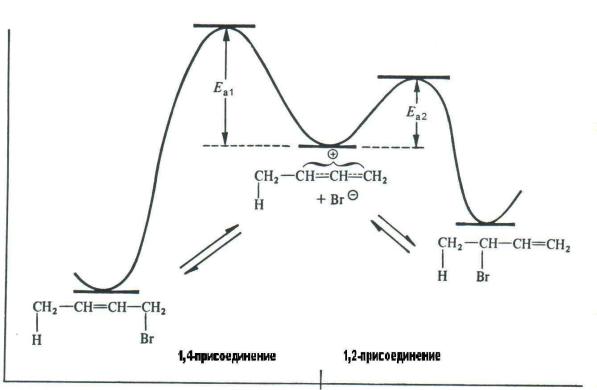
соединение протекает медленнее, но продукт реакции термодинамически более стабилен.
На энергетической диаграмме показана потенциальная энергия субстрата при превращении по пути а и по пути b (см. рис. 4.1).
Энергия
Рис. 4.1. Энергетическая диаграмма реакции бут-1,3-диена с бромоводородом
Таким образом, при низких температурах, когда равновесие ещѐ не достигнуто, образуется преимущественно продукт 1,2-присоединения (его называют кинетически контролируемым), а при обычных или повышенных температурах, то есть при установлении равновесия (чем выше температура, тем быстрее устанавливается равновесие) — продукт 1,4-присоединения (его называют термодинамически контролируемым).
Образовавшийся 1,2-продукт постепенно, через стадию образования карбокатиона, превращается в более устойчивый 1,4-продукт.
Аналогично присоединению бромоводорода преимущественное направление 1,4-присоединения характерно и для других реакций электрофильного присоединения.
При использовании избытка реагента реакция присоединения может идти дальше до полного насыщения кратных связей.
Образование стабильных аллильных катионов при протонировании сопряжѐнных диенов даѐт возможность протекания реакций алкилирования непредельных углеводородов (алкенов, алкадиенов) и их производных, приводящих к наращиванию углеродной цепи. Этот процесс важен в биосинтезе
216

терпенов и стероидов (о терпенах и стероидах — гл. 8.5, 8.7). Механизм реакции можно рассматривать как типичное электрофильное присоединение:
|
|
H3C |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
C |
|
CH |
CH2 + H2C |
|
|
C CH2-CH2-X |
|
|
|
|
|||||||
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
H3C |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H3C |
+ |
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|||||
C |
|
CH CH2CH2-C-CH2CH2X |
|
|
|
|
|
|
C |
|
CH CH2CH2-C=CHCH2X |
||||||||
|
|
|
+ |
|
|
|
|||||||||||||
|
|
|
|
|
|
||||||||||||||
H3C |
|
|
|
-H |
|
H3C |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
CH3 |
||||||||||
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|||||
Радикальное присоединение
Присоединение галогенов, галогеноводородов и других реагентов в условиях гомолитического разрыва ковалентной связи, а значит, по механизму AR, также сопровождается преимущественным образованием продукта 1,4-присоединения. Например:
h
R-CН=CН-СН=СН2 + Br2 R-CHBr-СН=СН-CH2Br
Избыток брома приводит к полному насыщению кратных связей.
Диеновый синтез
Реакции диенового синтеза часто называют реакциями Дильса*– Альдера* по имени учѐных, внѐсших существенный вклад в их изучение. Эти реакции представляют также 1,4-присоединение к диеновым углеводородам с образованием циклических систем. В роли реагента здесь выступает другой непредельный углеводород или, что чаще бывает, его функциональное производное с электроноакцепторными группами. Такие реагенты, взаимодействующие с диенами, в этой реакции называются диенофилами.
Наиболее вероятным здесь является синхронный механизм. Реакция протекает через образование циклического переходного состояния, в котором происходит частичное перекрывание р-орбиталей диена и диенофила:
|
|
|
CH2 |
|
X |
|
|
|
|
CH2 |
X |
|
|
|
|
CH2 |
X |
||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
HC |
|
= |
CH |
|
|
HC |
= |
CH |
|
|
|
HC |
CH |
|
|||||
|
|
|
+ |
= |
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
HC |
= |
CH |
|
|
HC |
= |
CH |
|
|
|
HC |
CH |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
CH2 |
|
Y |
|
|
|
|
CH2 |
Y |
|
|
|
|
CH2 |
Y |
||
|
|
диен |
диенофил |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
CH2 |
CH |
X |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
HC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC CH2 |
CH Y |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
217 |
|
|
|
|
|
|
|
|
|
Удаѐтся осуществить диеновый синтез и с этиленом, но при повышенных температуре и давлении:
|
|
CH2 |
|
|
|
|
|
CH2 |
|
HC |
= |
CH |
|
HC |
|
CH2 |
|||
|
|
|
|||||||
|
|
+ |
= |
2 |
|
|
= |
|
|
|
|
|
|
|
|
|
|||
|
|
|
CH2 |
|
HC |
|
CH2 |
||
HC |
= |
|
CH2 |
||||||
|
|
CH2 |
|
|
|
|
|
|
|
Реакция Дильса–Альдера применяется на первых стадиях синтеза морфина (гл. 12.6), разработанного М. Гейтсом:
O |
CH2 |
CN |
O |
CN |
|
|
|
CH2 |
|
|
|
+ CH2=CH-CH=CH2 |
|
|
O |
OCH3 |
O |
OCH3 |
|
|
OCH3 |
|
OCH3 |
|
За |
открытие и развитие метода диенового |
синтеза |
К. Альдер и |
|
О. Дильс были удостоены Нобелевской премии по химии в 1950 году. Реакция Дильса–Альдера может использоваться для характеристики
1,3-диенов.
Реакции полимеризации также протекают преимущественно по направлению 1,4-присоединения. При этом образуются ненасыщенные полимерные углеводороды, обладающие многими ценными качествами, в том числе эластичностью. При полимеризации бут-1,3-диена образуется эластичный материал, по многим характеристикам близкий к натуральному каучуку; он был назван бутадиеновым синтетическим каучуком. Возможно образование как цис-, так и транс-структур:
|
|
|
|
|
|
|
H |
H |
|
|
|
|
|
|
|
|
|
|
C = C |
|
|
|
|
|
|
|
|
|
|
|
-CH2 |
CH2- |
|
|
n |
|
|
|
|
|
|
|
|
|
|||
n CH =CH-CH=CH |
|
|
|
|
|
цис- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
CH2- |
|
|||
|
|
|
|
|
|
|
C = C |
|
|
|
|
|
|
|
|
|
|
-CH2 |
H |
|
n |
||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
транс- |
||||
|
|
|
218 |
|
|
|
|
|
|
|
|
Полимеризация изопрена также может приводить к получению разных стереоизомерных продуктов. В процессе полимеризации по радикальному механизму образуются полимеры с нерегулярной структурой. Однако в присутствии катализаторов Циглера*–Натта* (алюминий- и титанорганические соединения) образуются почти исключительно продукты цис-1,4- присоединения:
|
CH3 |
|
|
|
CH3 |
H |
|
CH3 |
H |
|
R3Al/TiCl4 |
C = C |
|
|
|||||
n CH =C-CH=CH |
2 |
|
|
C = C |
|
||||
|
|
|
|
|
|||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
... -CH2 |
CH2-CH2 |
CH -CH |
CH -... |
|||
|
|
|
|
|
|
|
2 |
2 |
2 |
|
|
|
|
|
|
C = C |
|
|
|
|
|
|
|
|
|
CH3 |
H |
|
|
Такой полимер почти идентичен натуральному каучуку. Высокая его эластичность определяется цис-конфигурацией. В природе также встречается транс-полиизопрен, называемый гуттаперчей, который имеет худшие механические свойства, в частности, не проявляет высоких эластических свойств.
Дж. Натта и К. Циглер за открытия в области химии и технологии полимеров в 1963 году удостоены Нобелевской премии.
4.3.4. ОСОБЕННОСТИ ХИМИЧЕСКОГО ПОВЕДЕНИЯ ДИЕНОВ
СИЗОЛИРОВАННЫМИ ДВОЙНЫМИ СВЯЗЯМИ
Вмолекулах диеновых (и полиеновых) углеводородов с изолированными двойными связями отсутствует сколько-нибудь существенное взаимодействие между кратными связями (по причине их разделения друг от друга насыщенными атомами углерода). Поэтому в преобладающем большинстве реакций эти углеводороды ведут себя как этиленовые.
Однако особенности поведения могут проявляться в реакциях радикального замещения, и прежде всего для тех из них, в молекулах которых двойные связи разделены только одним тетраэдрическим атомом углерода.
Для таких углеводородов легче протекают SR-реакции вследствие более полной мезомерной стабилизации промежуточного радикала. Например, для пент-1,4-диена:
CH2=CH-CH2-CH=CH2 + Cl CH2=CH-ĊH-CH=CH2 + HCl
219

4.3.5. СПОСОБЫ ПОЛУЧЕНИЯ
Способы получения диеновых (и полиеновых) углеводородов аналогичны этиленовым. Это каталитическое дегидрирование алканов (а значит, и алкенов), дегидратация спиртов (многоатомных), дегидрогалогенирование и дегалогенирование полигалогеналканов и некоторые другие. Так, например, аллен можно получить из пропилена по схеме:
CН2=CН-СН3 |
Cl / 500 С |
|
Cl |
/ CCl |
|
|
CН2=CН-СН2Сl |
||||
|
2 |
|
2 |
|
4 |
CН2Cl-CНCl-СН2Сl |
NaOH / ROH |
|
CН2=CCl-СН2Сl |
Zn |
|
|
|
||||
CH2=C=CH2
Один из промышленных способов получения изопрена заключается в димеризации пропилена с последующим отщеплением молекулы метана:
CH = CH + |
CH =CH |
(C3H7)3Al CH =C-CH-CH |
||||||||||
2 |
|
2 |
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
CH |
|
|
|
H C H |
CH3 |
||||||
3 |
3 |
3 |
|
|
|
|
|
|||||
CH2=C-CH=CH2 + CH4
CH3
4.3.6. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ
Дивинил (эритрен, бут-1,3-диен) — бесцветный газ со слабым запахом. Незначительно растворяется в воде, растворим в этаноле, в диэтиловом эфире, хлороформе, ацетоне. В промышленности получают из бутана и по методу С.В. Лебедева дегидратацией и дегидрированием этанола при температуре 430 450 С на катализаторе Al2O3+ZnO.
Основное количество вырабатываемого дивинила расходуется на получение искусственного каучука и резины.
Изопрен — жидкость со слабым запахом и температурой кипения 34 С. Растворим в этаноле, в диэтиловом эфире. Используется в производстве каучука и резины.
В промышленности получают дегидрированием изопентанизопентеновой фракции нефти, а также димеризацией пропилена (см. выше).
Каучуки — полимеры сопряжѐнных диенов. Они обладают высокой эластичностью. В промышленности производится много видов искусственных каучуков, и они применяются повсеместно.
220
