
Учебник Органическая химия Щеголев 2016
.pdf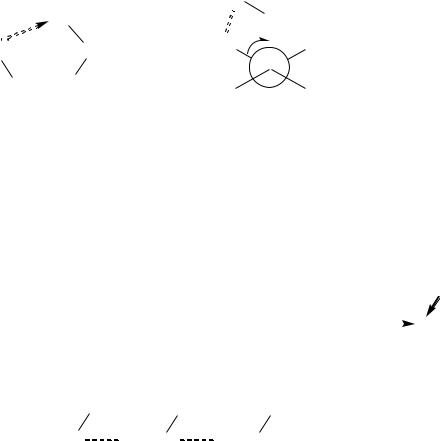
|
|
|
|
H |
|
|
|
|
H |
|
O |
||
Cl |
|
O |
Cl |
60o |
H |
|
|
|
|||||
CH2 |
|
|
CH2 |
H |
|
H |
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
2-хлорэтан-1-ол |
|
|
3.3.2. СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА
Спирты — соединения, полярные из-за наличия сильнополярных свя-
зей C–О и О–Н, с одной стороны, и, с другой стороны, из-за |
|
|
|
|
'+ |
||||||||
наличия валентного угла C–О–Н, близкого к 106 . (Спирты |
|
|
|
|
|||||||||
|
|
|
|
H |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
можно рассматривать как производные воды, в молекуле ко- |
|
|
|||||||||||
торой, как известно, угол между связями равен 104.5 .) |
R |
|
|
O |
|||||||||
|
|
||||||||||||
Аналогично воде для спиртов характерно образование межмолекуляр- |
|||||||||||||
ных водородных связей (гл. 1.3.3): |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
R |
|
|
R |
|
|
R |
|
|
|
|
|
H |
|
O: |
H |
|
O : |
H |
|
O : |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Образование водородных связей ответственно за аномально высокие температуры кипения спиртов по сравнению с соответствующими алканами и галогеналканами. Так, например, все спирты с числом атомов углерода от 1 до 11 — жидкости, а высшие спирты — твѐрдые вещества. Соединения с разветвлѐнной углеродной цепью кипят при более низких температурах, чем их изомеры нормального строения. Спирты, содержащие в молекулах не более трѐх атомов углерода, смешиваются с водой в любых соотношениях, что объясняется образованием водородных связей между молекулами спиртов и воды. Растворимость спиртов уменьшается по мере усложнения углеводородного радикала.
Спирты — бесцветные соединения. Низшие спирты обладают характерным алкогольным запахом и жгучим вкусом, бутиловые и амиловые спирты — сивушным запахом, а высшие спирты имеют ароматный запах.
3.3.3. ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства спиртов обусловлены наличием функциональной группы -ОH, а значит, полярных связей С–О и О–H. Как и для галогеналка-
131

нов, для спиртов должны быть характерны реакции нуклеофильного замещения и отщепления. Но для спиртов характерны и другие свойства.
3.3.3.1. Примеры реакций нуклеофильного замещения
1. Межмолекулярная дегидратация спиртов — это реакция образования простых эфиров из спиртов. Она протекает при нагревании в присутствии концентрированной серной кислоты, которая является и катализатором, и акцептором отщепляющейся молекулы воды. Одна молекула спирта в этой реакции является субстратом, а другая — нуклеофилом:
R-CH2-OH + H+ 
 R-CH2-OH+2
R-CH2-OH+2
|
|
|
+ |
|
|
|
|
|
|
|
+ |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
R'-O: + |
CH |
|
|
OH2 |
|
|
|
R'-O: . . . CH2 . . . :OH2 |
|
|
|
|
R'-O-CH -R |
||||
|
2 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
2 |
||
H |
R |
|
|
|
|
|
H |
R |
|
|
- H |
+ |
|
||||
|
|
|
|
|
|
|
|
||||||||||
Реакция нуклеофильного замещения здесь сопровождается элиминированием с образованием алкена (см. далее), роль которого усиливается при увеличении разветвлѐнности углеводородного радикала, то есть при увеличении стабильности карбокатиона.
2. Взаимодействие спиртов с галогеноводородами. В этих реакциях также используется предварительная активация спиртов путѐм их протонирования чаще всего концентрированной серной кислотой или взаимодействием с кислотами Льюиса:
|
|
|
+ |
|
+ |
|
|
|
|
|
|
|||||||||
|
R - O: + H |
|
|
|
|
|
|
|
R |
|
|
O - H |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
H |
|
HCl |
R - Cl |
|||||
|
|
|
|
|
|
|
|
|
||||||||||||
R - O: + ZnCl2 |
|
|
+ |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
R |
|
|
O: ZnCl2 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
В зависимости от структуры субстрата механизм реакции SN1 или SN2. При этом скорость реакции по SN2-механизму (для первичных спиртов) значительно ниже, чем скорость реакции по SN1-механизму (для вторичных и для третичных спиртов), так как протеканию реакции по мономолекулярному механизму способствуют кислая среда и кислотный катализатор (гл. 3.1.1).
Различия в скоростях реакций нуклеофильного замещения первичных, вторичных и третичных спиртов позволяют легко распознать природу спирта с использованием пробы Лукаса. Для этого спирт взбалтывают на холоду с раствором хлорида цинка в концентрированной соляной кислоте. Первичные спирты реагируют очень медленно (при нагревании), вторичные — в течение
132

нескольких минут, а третичные — моментально. Об образовании хлоралкана свидетельствует сильное помутнение раствора.
3. Взаимодействие спиртов с тионилхлоридом. Эта реакция также приводит к получению хлоралканов, часто используется в лабораторной практике. При этом на первой стадии образуется алкилхлорсульфит, который в силу своей малой стабильности легко превращается в соответствующий хлороалкан.
Cl |
|
|
Cl |
|
|
|
|
|
Cl |
|
|
|
|
|
Cl |
||||
|
+ |
|
|
|
|
|
|
|
|
|
|
|
R+ |
|
|
|
|
||
R-OH + S=O |
|
R-O-S O |
|
|
|
|
|
R-O-S O |
|
|
O |
S |
O |
||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
- HCl |
|||||||||||||||
|
|
|
|
|
|
||||||||||||||
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
H Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
RCl + SO2
4. Взаимодействие спиртов с аммиаком с образованием аминов протекает уже значительно труднее. Проведение реакции требует высокой температуры (300 400 С) и применения кислотных катализаторов (Н+, Al2O3, WO3, MgO) для активирования молекулы спирта, но катализатор частично и дезактивирует молекулу аммиака, превращая еѐ в катион аммония. Реакция протекает по схеме:
R-OH + Н+ R-OН2+
R-OН2+ + NH3 R-NН3+ + H2O
R-NH2
Рассмотренные здесь реакции нуклеофильного замещения спиртов могут использоваться для получения других функциональных производных алканов: простых эфиров, галогеналканов, аминов.
3.3.3.2. Пример реакции отщепления
Внутримолекулярная дегидратация спиртов. Эта реакция, как и реакция межмолекулярной дегидратации, протекает в присутствии концентрированной серной кислоты.
R-CH2-CH2OH + Н+ R-CH2-CH2-OН2+
R-CH2-CH2-OН2+ R-CH2-CН2+ + H2O
R-CH2-CН2+ R-CH=CH2 + Н+
133

Механизм реакции — только Е1, поэтому первичные спирты дегидратируются с трудом, в жѐстких условиях, а третичные — напротив, уже при небольшом нагревании с концентрированной серной кислотой с хорошим выходом превращаются в алкен. Поэтому данная реакция может быть использована как способ получения алкенов. Отщепление происходит по правилу Зайцева.
3.3.3.3. Кислотно-оснόвные свойства
Присутствие в молекулах спиртов сильно полярной связи О–H отражается, в первую очередь на наличии у них кислотных свойств. Это связано с
возможностью отрыва катиона H+ под действием основа- |
|
|
|
' |
|
ний. Спирты являются менее сильными кислотами, чем |
|
||||
R |
|
O |
|
H |
|
|
|
||||
вода. Причина этого — электронодонорный индуктивный |
|
|
|
|
|
эффект углеводородного радикала, увеличивающий эффективный отрицательный заряд на атоме кислорода и уменьшающий полярность связи О–H. Однако кислотность метанола близка к кислотности воды.
Следовательно, со щелочами спирты не взаимодействуют:
ROН + NaOH 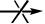 (RONa + H2О);
(RONa + H2О);
а если этот процесс рассматривать как равновесный с возможным образованием алкоголята RONa и воды H2О, то такое равновесие будет полностью смещено влево, то есть в сторону образования менее сильной кислоты ROH:
ROН + NaOH RONa + H О
2
Кислотные свойства уменьшаются в гомологическом ряду насыщенных спиртов и по мере разветвления углеводородного радикала:
H2О CH3OH > C2H5OH > CH3CH2CH2OH > (CH3)2CHOH > (CH3)3COH
Значение рКа для CH3OH составляет 15.1, рКа(C2H5OH) = 15.9, рКа((CH3)3СОH) 19. Положительный индуктивный эффект радикала в этом ряду увеличивается, а полярность связи O–Н поэтому уменьшается, значит, уменьшаются и кислотные свойства.
Однако с активными металлами спирты, как и все протонные кислоты, взаимодействуют, давая алкоголяты:
ROН + Na RONa + 1 2 H2
Примером проявления кислотных свойств спиртами является и реакция Чу- гаева*–Церевитинова*, в которой происходит отщепление протона от молекулы спирта и образование более слабой кислоты — метана:
RO-Н + CH3-MgI RO-MgI + CH4
134
С ослаблением кислотных свойств в ряду спиртов усиливаются оснóвные свойства, так как, с одной стороны, с возрастанием положительного индуктивного эффекта увеличивается полярность связи С–О, что способствует отщеплению иона OН, а, с другой стороны, на атоме кислорода увеличивается эффективный отрицательный заряд и, таким образом, облегчается присоединение протона при взаимодействии с кислотой. В действительности диссоциация в отсутствие кислотных катализаторов, то есть с образованием гидроксид-иона, практически не наблюдается даже для третичных спиртов и в сильнополярном растворителе. Как проявление оснóвных свойств более вероятно для спиртов протонирование. В целом спирты — слабые основания, но, например, с концентрированными кислотами, сухим хлороводородом могут довольно легко, особенно третичные, образовывать оксониевые (алкилоксониевые) соли. Например, пентан-1-ол, не растворяющийся в воде, растворяется в концентрированной соляной кислоте вследствие образования оксониевой соли:
СН3СН2СН2СН2СН2-ОH + HCl [СН3СН2СН2СН2СН2-OH2]+Cl
Таким образом, возможность проявления и кислотных, и оснóвных свойств говорит об амфотерности спиртов. Амфотерность можно проиллюстрировать и в межмолекулярном протонном обмене, например:
С2Н5-ОH + Н-О-С2Н5 С2Н5-ОH2+ + О-С2Н5
Такой процесс называется автопротолизом.
3.3.3.4. Нуклеофильность
Нуклеофильные свойства связаны с наличием электроотрицательного атома кислорода с неподелѐнной парой электронов. Сюда относятся рассмотренные в главе 3.3.3.1 реакция межмолекулярной дегидратации спиртов, в которой одна из спиртовых молекул является нуклеофилом, а другая — субстратом, а также первая стадия взаимодействия спиртов с тионилхлоридом с образованием алкилхлорсульфитов. Это также реакции образования сложных эфиров при взаимодействии спиртов с карбоновыми кислотами, которые будут рассмотрены позже (гл. 6.4.4.2).
Спирты в целом более нуклеофильны, чем вода. Но ещѐ более нуклеофильны алкоголят-ионы RO за счѐт большей локализации электронной плотности и, значит, отрицательного заряда на атоме кислорода. Электронодонорная способность такой частицы, то есть еѐ нуклеофильная активность, выше, чем у незаряженной и чем у частиц, не имеющих донорных заместителей у атома кислорода.
135

3.3.3.5. Реакции окисления и восстановления
Реакции окисления по-разному протекают для первичных, вторичных и третичных спиртов, и отличить эти спирты можно по продуктам окисления.
1. Первичные спирты окисляются (дегидрируются) до альдегидов и далее до карбоновых кислот:
R-CH2-OH R-CH=O R-COOH
Процесс дегидрирования осуществляют при пропускании нагретых паров спирта над металлическими катализаторами (Cu, Pt или Pd):
CH3-CH-O  CH3-CH=O + H2
CH3-CH=O + H2
H H
Или возможно окисление кислородом при строгом температурном контроле:
R-CH2-OH + 1 2 О2 R-CH=O + H2О
иприменении таких катализаторов, как Cu, CuО
2.Вторичные спирты окисляются до кетонов
R-CH(OH)-R R-CO-R
В лабораторной практике окисление первичных и вторичных спиртов проводят соединениями хрома (VI) в кислой среде.
3. Третичные спирты в обычных условиях устойчивы к окислителям, но могут быть окислены в жѐстких условиях, что приводит к разрыву углеродной цепи и окислению фрагментов исходной молекулы:
CH3 |
|
|
|
R-CH2-C-CH3 |
R-COOH + CH -C-CH |
3 |
|
|
3 |
= |
|
OH |
|
O |
|
Все предельные спирты могут быть восстановлены до алканов; это можно осуществить с помощью йодоводорода:
R-OH + 2HI RH + I2 + H2O
Этот процесс включает в себя две реакции. Первая — это обычное нуклеофильное замещение с образованием йодоалкана:
R-OH + HI R-I + H2O ;
а вторая — взаимодействие йодоалкана с избытком йодоводорода (гл.
3.2.2.3):
R-I + HI RH + I2
136
3.3.4.СПОСОБЫ ПОЛУЧЕНИЯ
1.Одним из способов получения спиртов является гидролиз галогенал-
канов:
R-Х + Н2О R-ОН + HX
Эти реакции, относящиеся к нуклеофильному замещению в галогеналканах, рассмотрены в главе 3.2.2.1.
2. Может быть использована гидратация алкенов:
R-СН=СН2 + Н2О R-СНOH-СН3,
осуществляющаяся в присутствии кислотных катализаторов (Н2SО4, Н3PО4, Al2О3 или др.). Подробнее эти реакции будут рассмотрены в свойствах алке-
нов (гл. 4.1.1, 4.2.3.1).
В промышленности присоединение воды осуществляется в газовой фазе при пропускании смеси алкена и воды над катализатором.
3.Спирты могут быть получены восстановлением альдегидов, кетонов,
ипроизводных карбоновых кислот:
R-СН=О R-СН2-OH
R-СО-R R-СНOH-R
R-СОOR R-СН2-OH + R -OH
Реакция может протекать как каталитическое гидрирование водородом карбонильных соединений на Ni, Pt или Pd. Восстановление может осуществляться и мягкими реагентами гидрирования, такими как NaBH4 или LiAlH4. И, наконец, возможно использование атомарного водорода (водород в момент выделения), образующегося при растворении металлического натрия в спиртах.
Подробнее эти реакции также будут рассмотрены в свойствах соответствующих классов соединений (гл. 6.1.4, 6.4.4.8).
4.Для получения вторичных и третичных спиртов из карбонильных соединений может быть использован реактив Гриньяра (гл. 6.1.4.1, п.6).
5.Для получения первичных спиртов реактивы Гриньяра подвергают окислению с последующим гидролизом:
+ RMgX + HOH
R-MgX [R-O-O-MgX] 2 ROMgX 2 ROH
6. Этанол в промышленности получают из природных объектов, содержащих полисахариды (древесина, картофель, зерна хлебных злаков и др.), которые предварительно гидролизуют до моносахаридов (т.е. до глюкозы), а затем подвергают брожению. Химизм процесса можно свести к схеме:
С6Н12O6 2 С2H5ОН + 2 Н2О
137

7. Метанол в промышленности получают из монооксида углерода и водорода:
СO + 2 Н2 СH3ОН
Реакцию проводят при повышенных давлении (5 30 МПа) и температуре (250 380 С) в присутствии катализатора (обычно оксиды цинка, хрома).
При изменении условий (температуры, катализатора, соотношения реагентов) может получаться смесь различных спиртов.
3.3.5. МНОГОАТОМНЫЕ СПИРТЫ
Многоатомными спиртами называют соединения, в молекулах которых содержится несколько гидроксильных групп. Для таких соединений справедливы все основные положения номенклатуры, изомерии, строения и свойств, что и для одноатомных спиртов, но у них есть и свои особенности.
1. Двухатомные спирты по радикало-функциональной номенклатуре именуют гликолями. Тогда для полного названия такого спирта необходимо назвать двухвалентный углеводородный радикал. В общем случае это достаточно затруднительно, и поэтому такие названия применимы только для гликолей, имеющих наиболее простое строение. Например:
CH2-CH2 |
CH3-CH-CH2 |
CH2-CH2-CH2-CH2 |
||
|
|
|
|
|
OH OH |
OH OH |
OH |
OH |
|
этиленгликоль |
пропиленгликоль |
тетраметиленгликоль |
||
Из тривиальных названий наиболее распространѐнными являются гли-
коль, глицерин и пинакон:
|
|
|
|
|
|
CH3 |
CH3 |
|
CH2-CH2 |
CH -CH-CH |
CH -C-C-CH |
|
|||||
|
|
2 |
|
|
2 |
3 |
|
3 |
OH OH |
OH OH OH |
HO |
OH |
|
||||
гликоль |
|
глицерин |
|
пинакон |
|
|||
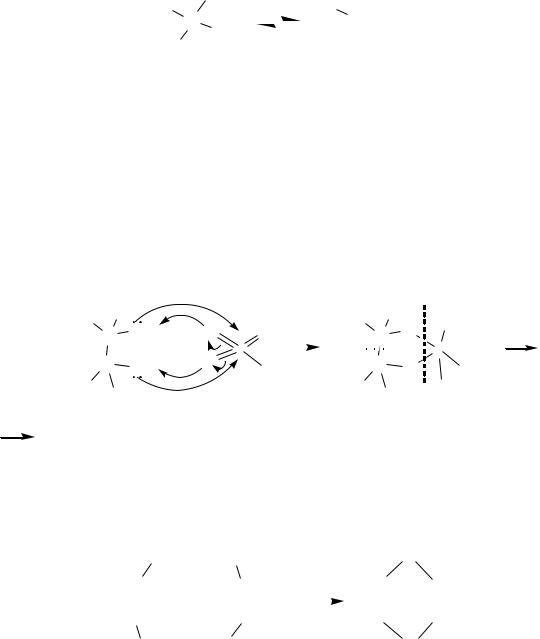
2. Двухатомные и трѐхатомные спирты с геминальным расположением гидроксогрупп неустойчивы и существуют только в водном растворе в равновесии с соответствующим карбонильным соединением:
R |
OH |
|
|
|
R |
|
|
|
|
||
|
C |
|
|
|
C=O + H2O |
|
|
|
|||
|
|
|
|
||
|
R(H)OH |
|
|
|
R(H) |
138
R |
|
OH |
|
|
|
R C=O + H2O |
C |
|
|
|
|
||
|
OH |
|
|
|||
|
|
|
|
|||
|
OH |
|
|
|
OH |
Это связано лѐгкостью отрыва катиона водорода от одной из гидроксильных групп под действием электроноакцепторного влияния соседней ОН-группы, то есть кислотные свойства этих соединений выражены сильнее, чем у одноатомных спиртов.
3.По физическим свойствам многоатомные спирты — это вязкие жидкости или кристаллические вещества, хорошо растворимые в воде (из-за образования большего числа водородных связей как между самими молекулами спирта, так и между спиртом и водой).
4.Для вицинальных диолов характерен специфический метод окисления — йодной кислотой или периодатами по схеме:
R |
|
|
R' |
|
|
|
|
|
|
R |
|
|
|
|
R' |
|
OH |
||||||
C OH |
O |
O |
|
|
|
|
|
O |
|
||||||||||||||
|
|
|
|
C |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
+ |
I |
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
C |
OH |
O |
OH |
|
|
|
C |
|
O |
|
|
|
|
OH |
||||||||
R" |
|
|
|
R" |
|
|
|
|
|
|
|
|
|
||||||||||
|
R"' |
|
|
|
|
|
|
|
|
R"' |
OH |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
R - C - R' |
+ |
R" - C - R"' |
+ |
|
|
|
|
|
|
[H3IO4] |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
5. При нагревании этиленгликоля с кислотами происходит межмолекулярная дегидратация и образуется циклический эфир — диоксан:
|
OH |
|
HO |
|
|
O |
|
|
|
|
CH2 |
+ |
CH2 |
H + CH2 |
CH2 |
+ 2 H2O |
|||||
|
|
|
|
|
|
|
|
|
||
CH2 |
CH2 |
|
CH2 |
CH2 |
||||||
|
|
|
||||||||
|
OH |
|
HO |
|
|
O |
|
|
|
|
|
|
|
|
|
|
диоксан |
|
|||
6. Гликоли способны подвергаться внутримолекулярной дегидратации. При этом в зависимости от взаимного расположения гидроксильных групп и структуры углеродного скелета возможно образование соединений различных классов (альдегидов, кетонов, циклических простых эфиров). Например: а) для - и -гликолей дегидратация — это внутримолекулярное нуклеофильное замещение:
139

|
|
|
|
|
|
||
CH2-CH2-CH2-CH2 |
|
CH2-CH2 |
+ H2O |
||||
|
|
|
|
|
|
|
|
OH |
:OH |
|
CH2 CH2 |
||||
|
|
||||||
|
|
|
|
|
|
O |
|
тетраметиленгликоль |
тетраметиленоксид (тетрагидрофуран) |
||||||
б) -гликоли (вицинальные диолы) могут, дегидратируясь, претерпевать секстетные перегруппировки:
R- |
CH-CH-R' |
|
|
R-CH2-C-R' + H2O |
|
|
|
||||
|
|
|
|
= |
|
OH OH |
|
O |
|||
Реакция начинается с протонирования одной из гидроксогрупп (более оснóвной), затем отщепляется молекула воды. Образовавшийся карбокатион обладает малой стабильностью и перегруппировывается в другой, более стабильный. При этом происходит перемещение гидрид-иона от одного атома углерода к другому, имеющему секстет электронов:
R-CH-CH-R' + H+ |
|
|
|
|
|
|
+ |
|
|||||
R- |
CH-CH-R' |
|
|
|
R-CH-CR'-OH |
||||||||
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|||
|
OH OH |
|
HOH OH |
|
|
H |
|||||||
+ |
|
|
|
|
|
|
|
|
|
|
|||
|
|
R-CH2-C-O-H |
|
|
R - CH - |
C=O |
|
|
|||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
- H+ |
2 |
|
|
|
|
|
||
|
|
|
R' |
|
|
|
R' |
|
|
||||
|
|
|
|
|
|
|
|
|
|||||
Возможность такой перегруппировки определяется лѐгкой делокализацией положительного заряда в образующемся катионе благодаря р-р-взаимо- действию атома кислорода, с одной стороны, и положительно заряженного углерода, с другой стороны. После отрыва протона замыкается -связь C–O и образуется карбонильное соединение.
Особенно интересно аналогичное превращение пинаконов (двутретичных -гликолей). В этом случае перемещение гидрид-иона невозможно, и карбокатион претерпевает скелетную перегруппировку:
|
|
CH3 |
CH3 |
+ |
|
|
CH3 CH3 |
|
|
|
CH3 CH3 |
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
+ H |
|
|
|
|
|
|
|
|
|
|
CH3-C - C-CH3 |
|
CH3-C - C-CH3 |
|
|
|
CH3-C - C-CH3 |
|||||||||||||
|
|
|
|
|
- H2O |
||||||||||||||
|
|
|
|
|
+ |
|
|
|
+ |
||||||||||
|
HO OH |
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|||||
|
|
|
|
|
|
|
|
HO OH2 |
|
|
|
||||||||
|
|
пинакон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
+ |
CH3 |
|
|
|
|
|
|
CH3 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
CH3-C - C-CH3 |
|
||||||||||
|
|
|
CH3-C - C-CH3 |
|
|
|
|
||||||||||||
|
|
|
|
+ |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
- H |
|
= |
|
|
|
|
||
|
|
|
|
HO: |
CH3 |
|
|
|
O CH3 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
пинаколин
140
