
Учебник Органическая химия Щеголев 2016
.pdf
положены в одной плоскости, а неспаренный электрон находится на чистой (негибридной) р-орбитали. Радикал неустойчивый и высокореакционноспособный. Поэтому легко протекает следующая стадия — взаимодействие этого радикала с молекулой галогена.
Однако образовавшийся в результате хлорметан может сам вступать с хлором в реакцию замещения оставшихся у него атомов водорода, в результате чего образуются продукты более глубокого замещения:
СН4 СН3Сl CH2Cl2 CHCl3 CCl4
Таким образом, реакция хлорирования метана не селективна, хотя в настоящее время разработаны условия для промышленного получения из метана монохлорметана и тетрахлорметана.
Для высших алканов схема реакции хлорирования аналогична. Однако следует обратить внимание на то, что всегда разрывается связь С–Н, но не С–С, несмотря на то, что энергия связи С–Н больше, чем С–С.
CH3 - CH3 + Cl |
|
CH 2CH3 + HCl |
|
CH3Cl +  CH3
CH3
При образовании молекулы HCl выделяется значительно больше энергии, чем при образовании связи C–Cl (как и в случае галогенирования метана), образуются термодинамически более стабильные продукты. За счет этого происходит компенсация энергии на разрыв связи С–Н.
Кроме того, начиная с пропана углеводороды содержат разные по природе атомы водорода. Поэтому возможны (для пропана) два направления протекания реакции замещения водорода:
CH3-CH2-CH3 + .X |
|
|
. CH2-CH2-CH3 |
+ HX |
|
|
|
|
|||
|
|
. |
|
|
|
|
|
|
CH3-CH2-CH3 + |
HX |
, |
что приводит к образованию двух разных изомерных продуктов:
X X
CH2 - CH2 - CH3 и CH3 - CH - CH3
Преимущественное направление замещения в общем случае определяется влиянием нескольких факторов.
1. Учитывая статистический фактор, можно было ожидать, что реакция преимущественно пойдѐт по метильным группам, так как в молекуле пропана шесть метильных атомов водорода и только два метиленовых. Так и происходит на самом деле в реакции хлорирования при высокой температу-
91

ре, когда хлор-радикал очень активен и реагирует с любым атомом, с которым он сталкивается. В этих условиях образуется 75% 1-хлорпропана и 25% 2-хлорпропана.
2. Однако при низкой температуре, когда активность атакующих радикальных частиц в реакции хлорирования значительно ниже, главенствую-
щую роль играет стабильность образующихся углеводородных радика-
лов. Относительная устойчивость углеводородных радикалов связана с проявляющимися электронными эффектами. Для первичного пропильного радикала смещение электронной плотности к радикальному атому и за счѐт индуктивного эффекта, и за счѐт эффекта сверхсопряжения меньше, чем для вторичного пропильного радикала.
|
H |
|
|
H |
H |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
C |
|
CH3 |
H |
|
C |
|
CH |
C |
|
H |
|||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
H |
|
|
|
H |
H |
|
|
|||||||
Поэтому при низкой температуре при хлорировании пропана образуется 55% 2-хлорпропана и 45% 1-хлорпропана:
CH3-CH2-CH3 + Cl |
|
h |
CH3-CH2-CH2Cl |
+ |
HCl |
||
2 |
|
|
|
||||
|
|
|
|
45% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3-CHCl-CH3 |
+ |
HCl |
|
|
|
|
|
|||
|
|
|
|
|
55% |
|
|
В общем случае относительная устойчивость насыщенных углеводородных радикалов уменьшается в ряду: третичные > вторичные > первичные. Но присутствие электроноакцепторных атомов или групп оказывает ингибирующее действие на процесс радикального галогенирования. Например, для 1-хлорбутана Cl-CH2CH2CH2CH3 вероятность замещения водорода (т.е. введения второго атома хлора в молекулу бутана) у третьего углеродного атома в 3 раза выше, чем у второго, и в 17 раз выше, чем у первого.
Но в наибольшей степени этот фактор (устойчивость образующихся углеводородных радикалов) проявляется при взаимодействии алканов с бромом. Эта реакция в принципе аналогична хлорированию, но протекает менее энергично, что связано с очень низкой активностью бром-радикалов, и более избирательно.
CH3-CH2-CH3 + Br2 h 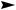 CH3-CH2-CH2Br + HBr
CH3-CH2-CH2Br + HBr
3%
CH3-CHBr-CH3 + HBr
97%
92

3. Ещѐ один фактор, определяющий направление (и скорость) реакций радикального замещения, — это доступность реакционного центра алкана для атаки реагентом. Однако этот фактор обычно не играет существенной роли, и только в пространственно сильнозатруднѐнных субстратах она может либо значительно замедлить скорость реакции замещения, либо определить иное направление еѐ протекания.
Среди других случаев радикального замещения, характерных для насыщенных углеводородов, можно отметить реакции нитрования и сульфохлорирования.
Нитрование алканов в газовой фазе при температуре 450 С или в жидкой фазе по М.И. Коновалову* при температуре 100–150 С осуществляется разбавленной азотной кислотой (12 20%-й), содержащей диоксид азота NO2
R-H + HNO3 R-NO2 + H2O ,
а механизм реакции с участием стабильного радикала NO2 можно представить следующим образом:
R-H + NO2 |
|
R + HNO2 |
HNO2 + HNO3 |
|
2 NO2 + H2O |
R + NO2 |
R-NO2 |
|
нитроалкан
Таким образом, функция азотной кислоты заключается в том, чтобы быть источником диоксида азота.
Жидкофазное нитрование достаточно селективно: из гексана при 150 С образуется 2-нитрогексан с выходом 63%.
Сульфохлорирование алканов протекает по схеме:
RH + SO2 + Cl2 RSO2Cl + HCl
Эта реакция по механизму похожа на хлорирование, за исключением того, что здесь имеются две главные стадии роста цепи:
O
R + SO2  R - S O
R - S O
RSO2 + Cl2 RSO2Cl + Cl
алкансульфохлорид
93
И сульфохлорирование осуществляется преимущественно по первичным, наиболее доступным, атомам углеродной цепи (из-за большого пространственного объѐма частицы SO2).
Возможно также сульфоокисление алканов, приводящее к образованиию алкансульфокислот и протекающее по схеме:
RH + SO2 + ½ О2 RSO3Н
В общем случае с учѐтом направления радикального замещения все эти реакции могут использоваться для получения разнообразных функциональных производных углеводородов: галогеналканов, нитроалканов, алкансульфокислот и их производных.
Окисление алканов по связи C–H под действием атмосферного кислорода — реакция крайне медленная. Молекула кислорода, хоть и является бирадикалом, но слишком малореакционноспособна, чтобы быть той частицей, которая отрывает водород. Но если за счѐт какого-либо процесса инициирования образуются следы свободного радикала X , он реагирует с кислородом, давая X–O–O , и последний действительно отрывает водород, поэтому цепная реакция имеет вид:
X–O–O + RH |
|
R + X–O–OH |
||
|
R + O2 |
|
R–O–O |
|
R–O–O + |
RH |
R |
+ R–O–OH и т.д. |
|
Напротив, веществами, замедляющими или предотвращающими окисление органических соединений, являются антиоксиданты (антиокислители, ингибиторы окисления). Антиоксиданты добавляют в количестве от 0,001% до 3%; при этом окисление замедляется в десятки раз. Действие антиоксидантов основано на их способности обрывать разветвлѐнное цепное окисление. При этом возможны два механизма: 1) молекула антиоксиданта, содержащего подвижный атом водорода (Z–Н), реагирует с пероксирадикалом ROO с образованием малоактивного радикала (Z ): ROO + ZHZ + R–O–OH ; 2) молекула антиоксиданта взаимодействует с промежуточным продуктом окисления — гидропероксидом ROOH, в результате чего образуются стабильные продукты: ROOH + ZH ROH [+ ZOH].
По первому механизму действуют производные вторичных ароматических аминов и фенолов, по второму — органические производные фосфитов и сульфидов.
Промышленное окисление высших алканов используется в ограниченном масштабе. Процесс осуществляется кислородом воздуха при 100 150 С в присутствии солей марганца (II) как катализатора. Окисление происходит при продувании тока воздуха через расплавленный парафин, содержащий
94

соль марганца. Реакция протекает с разрывом углерод-углеродной связи, и образуется смесь карбоновых кислот:
RCH2CH2R + O2 R-COOH + R -COOH
2.4.2. РЕАКЦИИ ДЕГИДРИРОВАНИЯ И РАЗЛОЖЕНИЯ
Дегидрирование обычно протекает при температуре 500 600 С на поверхности таких металлов, как платина, палладий, никель, или на оксиде хрома (III) по схеме:
R-СH2-СН3 R-CH=CH2 + H2
Механизм включает в себя адсорбцию алкана на поверхности катализатора, взаимодействие электронов -связей с вакантными d-орбиталями металла и, таким образом, внедрение атома металла в -связь С–Н :
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
||||
R |
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
C |
|
CH2 |
|
|
C |
|
CH2 |
- Me |
|
C CH2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
H |
H |
|
|
|
Me |
Me |
- H2 |
|
|
H |
||||||||
|
|
|
|
|
|
|
|||||||||||||
Me . . . . . . Me |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
H |
H |
|
|
|
|
|
||||
При этом при отщеплении одной молекулы водорода от молекулы высшего алкана обычно образуется смесь алкенов, являющихся изомерами как структурными, так и геометрическими.
Каталитическое дегидрирование алканов часто используют в промышленности. Этот процесс может сопровождаться разрывом С–С-связей (крекингом, пиролизом). При этом образуется смесь непредельных и предельных углеводородов с меньшей молекулярной массой:
CH3CH2CH2CH3  CH 3 + CH 2CH2CH3
CH 3 + CH 2CH2CH3  CH 4 + CH2=CHCH3
CH 4 + CH2=CHCH3
CH3CH2 + CH2CH3 |
|
|
CH 3CH 3 + CH2=CH2 |
|
|
Промежуточными частицами являются свободные радикалы. Они образуются в результате гомолиза алканов как по связям С–С, так и по связям
С–Н.
H
CH3 - CH - CH2CH3  H + CH3CHCH2CH3
H + CH3CHCH2CH3
Алкильные радикалы (обычно разветвлѐнного строения) не только диспропорционируют с образованием алкана и алкена, но и претерпевают расщеп-
95

ление с разрывом углерод-углеродной связи (как правило, у разветвлѐнного атома углерода):
CH3
|
|
|
|
|
|
CH3 - CH - CH2 |
|
|
CH 3 + CH3CH=CH2 |
||
|
|
||||
(Такое превращение иногда называют -распадом, так как осколочный радикал отрывается от -углеродного атома по отношению к радикальному центру.)
Радикалы также способны рекомбинировать, изомеризоваться или отщеплять атомы водорода от углеводородов. В таких реакциях образуется, как правило, смесь продуктов.
В промышленности крекингу (термическому или каталитическому) подвергают нефть, получая из неѐ топливо для двигателей внутреннего сгорания и другие ценные соединения.
2.4.3. РЕАКЦИИ ИЗОМЕРИЗАЦИИ
Металлы некоторых переходных элементов способствуют отщеплению гидрид-ионов от алканов при повышенных температурах.
|
|
H |
Pt |
|
|
+ |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||
CH3-CH-CH2CH3 |
H + CH3CHCH2CH3 |
||||||||||||
|
|||||||||||||
|
|||||||||||||
Образующийся карбокатион, отщепляя катион водорода, превращается в бут-2-ен. Такой процесс имеет место при каталитическом дегидрировании. Однако наряду с этим направлением реакции может происходить нуклеофильная перегруппировка — перемещение метильной группы с электронной парой связи из -положения к положительному атому углерода этого карбокатиона:
|
CH |
|
CH |
|
|
|
CH3 |
|||
|
|
|
|
|
||||||
+ |
3 |
|
|
|
3 + |
|
H |
CH3-CH-CH3 |
||
|
|
|
|
|
||||||
CH3-CH-CH2 |
|
|
CH3-CH-CH2 |
|
|
|
|
|||
|
|
|
|
|
|
|||||
Получающийся изобутил-катион, присоединяя гидрид-ион, превращается в изобутан. При отщеплении от данного карбокатиона катиона водорода образуется в качестве побочного стабильного продукта изобутилен:
H |
|
|
|
|
+ |
|
|
|
C=CH2 + H+ |
CH3-C-CH2 |
|
CH3- |
|
|
|
|
|||
|
||||
CH3 |
|
CH3 |
||
96
В данном случае процесс изомеризации бутана в изобутан сопровождается дегидрированием алканов. В зависимости от условий проведения реакции можно осуществить изомеризацию и (или) дегидрирование алкана, что широко используется в промышленном органическом синтезе.
2.5. СПОСОБЫ ПОЛУЧЕНИЯ И ПРИРОДНЫЕ ИСТОЧНИКИ
Важнейшими природными источниками алканов являются нефть и природный газ. Нефть — не только топливо, но и ценное химическое сырьѐ для органического синтеза. Однако она относится к невозобновляемым ресурсам. Кроме того, алканы входят в состав природного горючего газа, попутного нефтяного газа, озокерита, горючих сланцев.
При разгонке нефти получаются различные смеси алканов, которые используются в виде следующих фракций: бензин (углеводороды С5—С11), лигроин (углеводороды С8—С14), керосин (углеводороды С12—С18), дизельное топливо (углеводороды С14—С25), смазочные масла (углеводороды С20— С34), вазелин, твѐрдый парафин, гудрон. Высшие фракции разгонки нефти подвергают крекингу для получения высокосортных бензинов.
Попутными нефтяными газами являются, главным образом, растворѐнные в нефти метан, этан, пропан, бутан и пентан примерно в равных количествах, но обычно с преобладанием метана (иногда до 50%).
Метан встречается в природе также в виде болотного газа и рудничного газа. Наибольшее содержание метана в природном горючем газе (от 60% до 99%), а этан, пропан и бутан встречаются в нѐм в качестве примеси.
Перспективным источником получения метана и ряда других веществ, представляющих интерес как топливные материалы, является микробиологический способ переработки, в том числе и биоотходов. Ежегодный прирост биомассы на Земле составляет более 200 млрд т. При воздействии анаэробных микробов (развивающихся без доступа кислорода), например на целлюлозу, образуется в качестве одного из продуктов метан:
(C6H10O5)n + n H2O 3n CO2 + 3n СН4
Алканы могут быть получены из метана, который подвергают конверсии с водяным паром на никелевом катализаторе при температуре
700 750 С.
CH4 + H2O CO + 3 H2
Образующийся при этом синтез-газ в более мягких условиях (в присутствии никелевого или кобальтового катализатора при температуре 200 250 С) превращается в углеводороды и водяной пар:
97

n CO + (2n+1) H2 CnH2n+2 + n H2O
Этот метод используется в технике для получения синтетического бензина. Другими синтетическими способами получения алканов являются:
восстановлением йодоводородом при нагревании производных алканов (йодалканов, спиртов — гл. 3.2.2.3, 3.3.3.1):
R–I + HI RH + I2
R–OH + 2 HI RH + I2 + H2O
из галогеналканов (гл. 3.2.2.3):
а) через магнийорганические соединения
R–Br + Mg R–MgBr
их гидролизом с сохранением углеродного скелета:
R–MgBr + H2O RH + Mg(OH)Br
или по реакции Вюрца* Гриньяра* с удлинением углеродного скелета:
R–MgBr + R’–Br R R’ + MgBr2
б) по реакции Вюрца (с удвоением углеродного скелета)
2 R–Br + 2 Na R–R + 2 NaBr
При этом использование реакции Вюрца возможно только для селективного получения симметричных алканов, в противном случае (при использовании смеси исходных галогеналканов) образуется трудноразделимая смесь трѐх алканов. Другая особенность получения алканов реакцией Вюрца заключается в невозможности использования для этих целей третичных алкилгалогенидов — вместо алкана с удвоенным числом атомов углерода образуется смесь алкана и алкена с исходным углеродным скелетом, например, для трет-бутилбромида:
CH3 |
|
|
|
|
CH3 |
CH3 |
||
2 CH3 C |
|
Br + 2 Na |
|
|
|
|
CH3 CH |
+ CH2 C |
|
- 2 NaBr |
|||||||
CH3 |
|
|
|
|
CH3 |
CH3 |
||
при сплавлении солей карбоновых кислот со щелочами в лабораторных условиях можно получить метан:
|
O |
|
|
o |
|
|
= |
|
200-300C |
CH4 |
|
||
CH3 - C |
ONa |
+ NaOH |
|
|
+ Na2CO3, |
|
|
|
|
98 |
|
|
|

но эта реакция может быть использована и для получения других низших алканов (подробнее будет рассмотрена в свойствах карбоновых кислот — гл. 6.4.4.4);
гидролиз карбида алюминия удобный способ получения метана
влаборатории:
Al4C3 + H2O CH4 + Al(OH)3
электролиз натриевых и калиевых солей монокарбоновых кислот по Кольбе* способ получения алканов с чѐтным числом атомов углерода в молекуле:
RCOO - |
|
|
RCOO |
|
|
R + CO 2 |
|
- e - |
|
|
R + R R–R ;
из альдегидов и кетонов а) по реакции Кижнера* Вольфа*:
|
O |
|
|
N - NH2 |
- |
|
||
|
|
|
OH, Pt |
|||||
R - C |
= |
+ H2N - NH2 |
|
= |
|
|
|
R - CH2 - R' |
R' |
|
R - C |
|
|
|
|||
|
|
|
R' |
- N2 |
||||
б) по реакции Клемменсена* (восстановление альдегидов и кетонов амальгамой цинка в соляной кислоте):
R–CO–R |
Zn/ Hg/ HCl |
R–CH2–R |
(эти реакции также будут рассмотрены позже, в свойствах карбонильных соединений — гл. 6.1.4.1 и 6.1.4.3).
99
2.6. ПРИМЕНЕНИЕ И ФИЗИОЛОГИЧЕСКАЯ РОЛЬ
Алканы используются, главным образом, как топливо и сырьѐ для химической промышленности. Кроме того, твердые углеводороды используются как сырьѐ для производства белково-витаминных концентратов, которые добавляют в корм животным. При этом любые алканы могут служить питательной средой для некоторых одноклеточных организмов, вырабатывающих кормовой белок. Использование микроорганизмов для получения сложных органических веществ из алканов является перспективным направлением, обеспечивающим дальнейший прогресс человечества.
Алканы физиологически малоактивны, но обладают наркотическим действием. Углеводороды с С5—С8 оказывают умеренное раздражающее действие на дыхательные пути; высшие члены гомологического ряда более опасны при действии на кожу. Длительный контакт с алканами вызывает вегетативные нарушения — гипотонию, брадикардию, повышенную утомляемость, бессонницу. Отмечаются гормональные нарушения у женщин.
Углеводороды, не содержащие в молекулах заместителей, из-за отсутствия выраженной фармакологической активности почти не используются в медицинской практике. Некоторые алканы обладают наркотическим действием.
Основное направление метаболизма углеводородов в организме человека и животных — это окисление.
Скорости реакции окисления алканов незначительны. Конечными продуктами реакции являются соответствующие спирты, альдегиды (или кетоны) и далее кислоты, при этом кислород внедряется в молекулу алкана обычно по концевому атому углерода углеводородной цепи. Поэтому этот процесс носит название «алифатическое гидроксилирование». В стремлении подчеркнуть тот факт, что окисляется обычно концевая группа, его называют также -окислением, или -гидроксилированием, так как на первой стадии концевая метильная группа окисляется до гидроксиметильной. Однако на этом метаболизм алканов не останавливается. Образующиеся в этой реакции первичные спирты (так же, как и введѐнные в организм извне) подвергаются дальнейшему окислению до альдегидов и кислот:
R-СН3 R-CH2OH R-CHO R-COOH
В молекулах алканов окисление может идти и по метиленовой группе. Образующиеся в этой реакции вторичные спирты в дальнейшем окисляются до кетонов:
R-CH2-R' R-CHОH-R' R-CO-R'
100
