
Учебник Органическая химия Щеголев 2016
.pdf
Гексаметилендиамин — бесцветное кристаллическое вещество с температурой плавления 315 К и температурой кипения 204 С. Растворим в воде.
В промышленности получают из динитрила адипиновой кислоты
N C-(CH2)4-C N.
Используют для получения полиамидов и синтетического волокна (найлон).
Этаноламины H2NCH2CH2ОH, HN(CH2CH2ОH)2, N(CH2CH2ОH)3 —
бесцветные вязкие жидкости, при низких температурах — кристаллические вещества, хорошо растворимые в воде.
Этаноламины используют в органическом синтезе для получения эмульгаторов, моющих средств и косметических препаратов как адсорбенты кислых газов и как ингибиторы коррозии.
Холин [(CH3)3N+CH2CH2ОH]ОH — бесцветное гигроскопичное кристаллическое вещество. По свойствам ему более соответствует строение внутренней соли (CH3)3N+CH2CH2О H2О.
Холин широко распространѐн в животных и растительных тканях, высоко его содержание в нервной ткани. Холин играет важную роль в обмене веществ, входит в состав фосфолипидов. См. также далее, гл. 6.4.7.
3.8. НИТРОАЛКАНЫ
Нитроалканы — это производные предельных углеводородов, в молекуле которых один или несколько атомов водорода замещены нитрогруппой
-NO2.
В названиях нитросоединений по заместительной номенклатуре нитрогруппа, как заместитель, всегда присутствует в виде приставки нитро-. Ради- кало-функциональная номенклатура для названия нитросоединений не используется. Примеры:
CH3-NO2 |
CH3-CH2-CH-CH3 |
|
CH2-CH2-CH-CH2-CH-CH3 |
||
|
|
||||
|
NO2 |
NO2 |
NO2 CH3 |
||
нитрометан |
2-нитробутан |
|
5-метил-1,3-динитрогексан |
||
3.8.1.СТРОЕНИЕ
Внитрогруппе атом азота находится в состоянии sp2-гибридизации: его три -связи образованы за счѐт двух валентных электронов и неподелѐнной пары, которую атом азота предоставляет одному из атомов кислорода. Такая связь является семиполярной. В результате атом азота приобретает положительный заряд, а кислородный атом — отрицательный заряд. Электрон,
171

находящийся на негибридной рz-орбитали атома азота, участвует в образовании -связи с другим атомом кислорода.
Нитрогруппа является сопряжѐнной системой, в которой обе связи N–O выравниваются, кислородные атомы становятся одинаковыми:
|
O |
|
|
|
|
O |
|
|
|
|
|
|
1/ |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
+ |
+ |
|
|
|
+ |
O |
2 |
|
|||||||
R-N |
O |
|
|
|
R-N |
O |
|
|
|
|
|
R-N |
1/ |
- |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
2 |
|
||
Нитрогруппа содержит сильно электроотрицательные атомы (N, O) и поэтому обладает значительным электроноакцепторным эффектом.
3.8.2. СВОЙСТВА
Нитроалканы — бесцветные или желтоватые жидкости со слабым запахом или кристаллические вещества. Это высокополярные соединения ( = 3.17 3.7 D), однако обладают плохой растворимостью в воде, что можно объяснить их склонностью к самоассоциации.
Химические свойства нитроалканов определяются как реакциями нитрогруппы (восстановление, гидролиз), так и реакциями с участием -угле- родного атома.
3.8.2.1. Кислотность
В молекулах первичных и вторичных нитроалканов -атомы водорода обладают большой подвижностью и могут отщепляться в виде протона из-за акцепторного влияния нитрогруппы. Эти соединения полностью растворяются в водных растворах щелочей, образуя соли:
R |
|
|
|
+ |
O |
|
|
|
R |
|
|
|
|
|
O |
|
|
|
|
|||
|
|
|
|
|
+ NaOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na+ |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
R' |
C |
N |
O |
|
-H2O |
|
|
R' |
C N |
O |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
При нейтрализации щелочных растворов соли нитроалканов превращаются в так называемые аци-формы — нитроновые кислоты. Аци-формы быстро переходят в классические структуры. Такое явление называется динамической изомерией или таутомерией.
R |
|
|
O |
|
|
|
+ H |
+ R |
+ |
OH |
|
|
|
R |
+ |
O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
R' C |
|
|
N O |
|
|
Na |
|
|
R' C |
|
N O |
|
|
|
|
|
|
R' CH |
|
N |
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
172
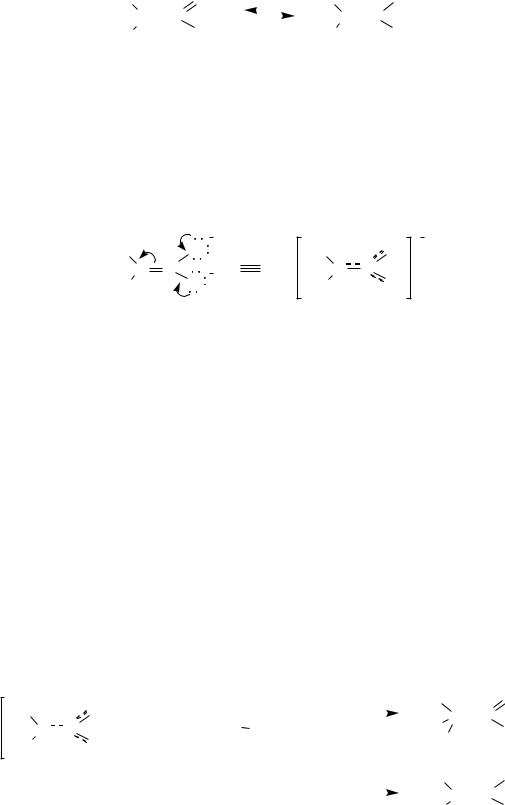
Таутомерную систему характеризуют константой таутомерного равновесия или иногда содержанием одного из таутомеров (в процентах). В растворах равновесие
R |
+ |
O |
|
|
|
R |
+ |
OH |
||||||
R' CH |
|
N O |
|
|
|
|
|
R' C |
|
N O |
|
|
||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|||||||||
обычно практически полностью сдвинуто в сторону С-формы; при 0 С доля аци-формы для нитрометана 10-5%, для нитропропана 0.3%. Аци- нитроалканы — более сильные кислоты (рКа 3 5), чем соответствующие нитроалканы (рКа 8 10).
При отрыве протона образуется анион, обладающий сопряжѐнной системой, и заряд в нѐм делокализован между кислородными и углеродным атомами:
R |
+ |
O |
R |
O |
|
|
|
|
|
R' C |
N O |
R' C |
N O |
|
Такой анион имеет три реакционных центра, и протон может присоединиться в двух принципиально разных положениях — к одному из атомов кислорода или к атому углерода. При присоединении протона к атому углерода образуется связь C–Н — кислота значительно менее сильная, менее способная к диссоциации, чем ОН-кислота, образующаяся при протонировании атома кислорода. Константы кислотности этих двух реакционных центров различаются примерно на 5 порядков, и поэтому эти соединения существуют преимущественно в классической форме нитросоединения.
3.8.2.2. Нуклеофильные свойства
Таким образом, в молекуле нитроалкана и в его анионе существует два центра нуклеофильности, то есть, он способен проявлять свои нуклеофильные свойства как за счѐт атома кислорода, так и за счѐт атома углерода, например, по отношению к галогеналканам. При этом образуются два ряда производных: эфиры нитроновых кислот (продукты О-алкилирования) и С-алкилированные нитросоединения:
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
+ |
O |
||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
Na+ + |
Hal |
|
|
|
R' |
C |
N |
|
|
|
|||||
C |
|
|
|
N |
O |
|
|
R'' |
|
|
|
O |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
R' |
|
|
|
|
|
|
|
|
|
- NaHal |
|
R'' |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
+ |
OR" |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
173 |
|
|
|
R' C |
|
N |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Это типичные реакции нуклеофильного замещения в ряду галогеналканов. Обычно алкилирование приводит к С-алкилпродуктам, но можно найти условия, в которых преимущественно образуются эфиры нитроновых кислот.
Нуклеофильные свойства могут проявляться и по отношению к галогенам, и к нитрозирующим частицам. Галогенирование (хлорирование, бромирование, йодирование) в щелочной среде протекает легко, с образованием-галогенозамещѐнных нитроалканов:
R |
|
|
|
|
|
|
|
Cl |
|
||||||
O |
|
|
|
Cl2 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
Na+ + |
|
|
|
|
|
C |
|
|
|
|
N |
|
R-C-NO |
2 |
|||||||
|
|
|
|
O |
- NaCl |
||||||||||
|
|
|
|||||||||||||
R' |
|
|
|
|
|
|
|||||||||
|
|
|
R' |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Нитрозирование первичных нитроалканов приводит к нитроловым кислотам, вторичных — к псевдонитролам, а третичные нитроалканы в эту реакцию не вступают.
+ |
R-CH-NO |
|
|
|
NO2 |
||||
|
HNO2 / H |
|
|
|
|
||||
R-CH2-NO2 |
|
|
|
2 |
|
|
|
|
R-C |
|
|
|
N=O |
|
|
|
|||
|
|
|
|
|
|
|
N-OH |
||
|
|
|
|
|
|
|
|
нитроловые кислоты |
|
R' |
|
+ |
R' |
|||
R-CH-NO2 |
HNO2 |
/ H |
|
|
||
|
|
|||||
R-C-NO2 |
||||||
|
|
|
||||
N=O
псевдонитролы
Поэтому реакцию нитрозирования можно применять для различия первичных, вторичных и третичные нитросоединений, так как растворы псевдонитролов (в эфире, хлороформе) окрашены в интенсивный синий цвет, а щелочные растворы нитроловых кислот — в тѐмно-красный.
3.8.2.3. Реакции восстановления
Реакции восстановления нитроалканов могут приводить к различным продуктам. При полном восстановлении образуются алифатические амины:
[H]
R-NO2 R-NH2
Промежуточными соединениями могут быть нитрозоалканы R-N=O, азосоединения R-N=N-R, азоксисоединения R-N=N(O)-R, гидразосоединения R-NH-NH-R. Для восстановления нитросоединений до аминов используют железные опилки, олово или цинк в присутствии кислот, каталитическое гидрирование (катализаторы: никель Ренея, палладий на активированном угле и др.), а также тетрагидроалюминат лития LiAlH4 и тетрагидроборат натрия NaBH4 в присутствии палладия, амальгамы натрия и алюминия.
174

3.8.2.4. Реакции гидролиза
Гидролиз первичных нитроалканов может приводить к образованию разных продуктов. В растворе 80 95%-й серной кислоты образуются карбоновые кислоты и соли гидроксиламина:
R-CH2-NO2 + H2SO4 + H2O RCOOH + [NH3OH]+ HSO4
Реакция протекает, вероятнее всего, по следующему механизму:
+ |
O |
|
|
|
|
|
+ |
OH |
H |
+ |
|
|
|
|
|
|
|
|
|
|
+ |
OH |
|
H+ |
||||||||||||||||||||||||||||
R-CH2-N |
|
|
|
|
|
|
|
|
|
|
R-CH=N |
|
|
|
|
|
|
|
R-CH=N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
O |
O |
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
+ |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
2+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
OH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
R-CH=N |
|
|
|
|
|
|
|
|
|
|
|
|
|
R-CH=N-OH |
|
|
|
|
|
|
|
R-CH=N=O |
|
|
|
|
|
|||||||||||||||||||||||||
OH |
-H2O |
|
- H+ |
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
H |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
R-CH-N=O |
|
|
|
|
R-CH-N=OH |
|
|
|
|
|
|
R-C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
N-OH |
|
|
|
|
|
|
+ |
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
OH2 |
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
+ |
OH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
R-C=N-OH H+ |
|
|
|
|
R-C-NH-OH H2O |
|
R-C |
|
|
NH-OH |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
||||||||
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
R-C |
|
NH2-OH |
|
|
|
|
|
|
R-C + |
+ NH2-OH |
|
|
|
|
|
|
|
R-C |
+ NH3-OH |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|||
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
А в разбавленных водных растворах кислот образуются карбонильные соединения (альдегиды или кетоны) и оксид азота (I) (реакция Нефа*):
R |
|
|
|
+ O |
|
|
|
|
R |
|
|
|
|
|
|
+ OH |
|
|
H+ |
|
|
R |
|
|
+ |
OH H O |
|||||||||||||||||||||||
R' CH |
|
N O |
|
|
|
|
|
|
|
R' C |
|
|
|
N O |
|
|
|
|
|
|
|
R' C |
|
|
N |
2 |
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
R |
|
|
|
|
|
OH |
|
|
|
|
R |
|
|
|
|
|
+ |
|
OH |
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
C |
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
C |
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
N=O |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
R' |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
-H2O, -H |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
R' + |
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
OH2 |
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
R |
|
|
|
|
|
|
|
|
|
|
[N-O-H]; |
|
|
(2 NOH |
|
|
|
N2O + H2O). |
|||||||||||||||||||||||||||||||
R' |
C O + |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
175 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

3.8.3. СПОСОБЫ ПОЛУЧЕНИЯ
Нитроалканы получают нитрованием алканов, нуклеофильным замещением галогена в галогеналканах или окислением других азотсодержащих соединений.
1.Нитрование алканов рассмотрено подробно в свойствах алканов (гл. 2.4.1). Жидкофазное и парофазное нитрование алканов применяется в промышленности. Объѐм мирового производства важнейших алифатических нитросоединений — десятки тысяч тонн.
2.Замещение атома галогена при взаимодействии галогеналканов с неорганическими нитритами — типичное нуклеофильное замещение в молекулах галогеналканов — гл. 3.2.2.1.
3.Окисление аминов (гл. 3.7.3.7) также может быть использовано для получения нитроалканов. Однако для получения геминальных ди- и тринитросоединений нашѐл применение способ окисления оксимов:
|
|
N2O4 |
R-CH-NO |
H O / HNO |
|
|
||
R-CH=NOH |
|
|
2 |
2 |
2 |
3 |
R-CH(NO2)2 |
+ R-C(NO2)3 |
|
|
N=O |
|
|
|
|||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
3.8.4. ФИЗИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ И ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ
Нитроалканы обладают сильным местным раздражающим действием и являются токсичными веществами. Они относятся к клеточным ядам общего действия и особенно опасны для печени. Хлорированные и непредельные в 5 10 раз токсичнее.
Нитрометан — бесцветная жидкость, малорастворим в воде; температура кипения 84 С. Ядовит. В промышленности получают парофазным нитрованием пропана.
Используется в качестве растворителя и как исходное вещество для дальнейших синтезов.
3.9. КРЕМНИЙ-, ФОСФОР- И МЫШЬЯКОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Органические соединения кремния, фосфора, мышьяка и других элементов относятся к элементорганическим соединениям. Здесь рассмотрены только некоторые из них.
176

3.9.1. КРЕМНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Кремний и углерод расположены в одной группе Периодической таблицы. По сравнению с углеродом кремний менее электроотрицателен, он не образует многих типов соединений, известных для углерода. Кратные связи Si=Si, Si=C, Si=O, Si=S для него неизвестны. Атомы кремния могут соединяться между собой, образуя цепи небольшой длины, но связи Si–Si чрезвычайно непрочны и легко могут претерпевать как гомолитическое, так и гетеролитическое расщепление.
Все кремнийорганические соединения могут быть представлены в виде следующих групп веществ:
замещѐнные силаны, например:
Cl |
|
|
|
|
|
H |
|
|
|
|
|
|
CH3 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C Si Cl |
|
|
|
|
|
C2H5 Si C2H5 |
|
|
H3C Si CH2-Cl |
|||||||||
Cl |
|
|
|
|
|
H |
|
|
|
|
|
|
CH3 |
|||||
метилтрихлорсилан |
|
|
|
диэтилсилан |
хлорметилтриметилсилан |
|||||||||||||
органосилоксаны |
— |
соединения, включающие структурный фрагмент |
||||||||||||||||
Si–O–Si, например, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|
|
|
|
|
CH3 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
H3C |
Si O |
|
Si CH3 |
|
|
|
|
Si O |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
CH3 |
|
|
CH3 |
|
|
|
|
CH3 |
|
n |
||||||
|
|
|
|
|
|
|
|
|
||||||||||
гексаметилдисилоксан |
диметилполисилоксан |
|||||||||||||||||
органосилазаны — соединения, имеющие связи Si–N–Si, например:
CH3 CH3
H3C Si NH Si CH3
CH3 CH3
и другие.
Кремнийорганические соединения являются бесцветными жидкостями, реже — кристаллическими веществами. Обычно они не имеют запаха, не растворяются в воде.
По отношению к большинству реагентов в обычных условиях алкилсиланы проявляют химическую инертность. В этом они обнаруживают большое
сходство с углеводородами. Однако их молекулах атом кремния |
|
|
+ |
является электронодонорным заместителем, и на атоме углерода, |
|
||
C |
|
Si |
|
|
|||
связанном с кремнием, возникает частичный отрицательный за- |
|
|
|
ряд. Поэтому алкилсиланы отличаются от рассмотренных ранее производных
177
алканов распределением электронной плотности в молекулах и, конечно же, химическим поведением.
Связь Si–Cl сильнополярна, и поэтому алкилхлорсиланы легко реагируют с водой, спиртами, аминами, металлорганическими соединениями и другими основными реагентами. Гидролиз протекает энергично, причѐм образующиеся силанолы нестойки, легко теряют воду и образуют силоксаны. Например:
2(CH3)3Si-Cl +2H2O 2(CH3)3Si-OH (CH3)3Si-O-Si(CH3)3 + H2O
2HCl
триметилхлорсилан триметилсиланол гексаметилдисилоксан
|
CH3 |
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n H3C Si Cl + 2nH2O |
|
|
n H3C Si OH |
|
|
|
|
|
|
Si O |
|
|
|
|
|||
|
|
|
-nH2O |
|
|
|
|
|
|
|
|||||||
|
-2nHCl |
|
|
|
|
|
|
|
|||||||||
Cl |
OH |
|
|
|
CH3 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
n |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
диметилдихлорсилан |
диметилсиландиол |
диметилполисилоксан |
|||||||||||||||
Алкоголиз хлорсиланов приводит к алкоксисиланам, аминолиз — к силазанам, а взаимодействие с реактивами Гриньяра — к алкилсиланам. Например:
|
CH3 |
C2H5OH |
|
H3C |
|
|
- HCl |
||||
|
|
|
|
||
H3C Si Cl |
|
|
|||
|
|
|
|
||
|
|
|
|
||
|
|
|
|||
CH3 |
|
|
|
||
|
|
|
NH3 |
|
H3C |
|
|
|
- NH4Cl |
||
|
|
|
|
||
|
|
|
C2H5MgBr |
H3C |
|
|
|
|
|
|
|
|
|
|
- MgBrCl |
||
|
|
|
|
||
CH3
Si OC2H5 CH3
CH3 CH3 Si NH Si CH3
CH3 CH3
CH3
Si C2H5 CH3
Некоторые особенности имеет нуклеофильное замещение атома галогена в галогенометилтриалкилсиланах
R"
X-CH2 Si-R'
R
Эти реакции наиболее полно изучены для тех случаев, в которых замещаемой группой Х является атом хлора. Схема реакции для этих соединений, например, при взаимодействии с вторичными аминами, такая же, как и в общем случае:
178
|
|
|
R" |
R" |
||||
|
|
|
|
|
|
|
|
|
R2NH + Cl |
|
CH2 |
Si-R' |
|
|
H2N CH2 Si-R' |
||
|
|
- HCl |
||||||
|
|
|
R'" |
R'" |
||||
хлорметилтриалкилсилан |
|
|
||||||
Механизм реакции здесь, как и следовало ожидать, близок механизму бимолекулярного замещения, но первоначальная атака нуклеофила происходит по атому кремния, и образование переходного состояния происходит не сразу, а через промежуточный комплекс, который затем претерпевает перегруппировку с переносом реакционного центра на атом углерода:
|
|
R" |
|
|
|
R' |
||||
|
|
|
|
|
R" Si CH2 |
|
|
|||
|
|
|
|
|
|
|
|
Cl |
||
R2NH + Cl |
|
CH2 Si-R' |
||||||||
|
|
|
||||||||
|
|
R |
|
|
R"' |
NHR2 |
||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
|
|
H |
H |
|
|
|
|
|
R" |
|
|
|
|
|
|
|
R NH |
|
|
|
|
|
|
|
|
|
|
|
|
|||
R2HN |
|
C |
Cl |
|
|
2 |
|
|
H2N CH2 Si-R' |
|
|
|
|
||||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
- R NH Cl- |
|
|
|||
|
R' Si R'" |
|
2 |
2 |
|
R'" |
||||
|
|
|
|
|
|
|||||
|
|
R" |
|
|
|
|
|
|
|
|
Координационная связь силанов с нуклеофилом осуществляется за счѐт вакантных d-орбиталей кремния и наиболее вероятна для соединений, содержащих небольшие по объему алкильные (и алкоксильные) заместители у кремния (-CH3, -C2H5, -OCH3, -OC2H5). При этом промежуточный комплекс нуклеофила с кремнием образуется быстро, а лимитирующей стадией является его перегруппировка и превращение в продукты реакции. Из-за образования этого комплекса реакция нуклеофилов с низшими хлорметилсиланами протекает почти в 10 раз быстрее, чем с соответствующими углеродными аналогами, и ускоряется электроноакцепторными заместителями у атома кремния, способствующими образованию этого комплекса. Однако наличие двух и трѐх алкоксильных групп у кремния приводит к значительному увеличению электронной плотности на нѐм, вызванному положительными мезомерными эффектами алкоксигрупп за счѐт взаимодействия неподелѐнных электронных пар кислорода с вакантными орбиталями кремния, и электростатическому отталкиванию молекул нуклеофила атомами кислорода заместителей. Поэтому скорость взаимодействия с нуклеофилом ди- и триалкоксихлорметилсиланов почти не отличается от скорости аминирования моноалкоксихлорметилсиланов.
179
Из всех кремнийорганических соединений наиболее широкое применение получили полисилоксаны. Они представляют собой бесцветные вязкие жидкости или эластичные массы. Они термически и химически очень стабильны. Полисилоксаны («силиконы») используют в качестве смазочных масел, каучуков (силиконовые эластомеры), тормозных жидкостей и др. Резины на основе кремнийорганических каучуков применяются преимущественно как электроизоляционные материалы, и благодаря биоинертности, тромборезистентности и хорошей тканесовместимости их используют в медицине для изготовления различных эндопротезов (суставов, мягких тканей) длительного пользования.
3.9.2.ФОСФОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Кфосфорорганическим соединениям, в отличие от эфиров фосфорной (гл. 3.5.2) и фосфористой кислот, принято относить такие, в молекулах которых содержится хотя бы одна фосфор-углеродная связь (Р–С). Таковыми являются:
1) алкилфосфины, например:
СН3РН2 |
(СН3)2РН |
(С2Н5)3Р |
метилфосфин |
диметилфосфин |
триэтилфосфин |
2) фосфонистые и фосфинистые кислоты, например:
СН3Р(ОН)2 |
(СН3)2РОН |
метилфосфонистая кислота |
диметилфосфинистая кислота |
3) катионы алкилфосфония, например:
[(С2Н5)4Р]+Cl
хлорид тетраэтилфосфония
4) фосфоновые, фосфиновые кислоты и фосфиноксиды, например:
CH3 |
CH3 |
CH3 |
||||||
HO P |
|
O |
CH3 P |
|
O |
CH3 P |
|
O |
|
|
|
||||||
|
|
|
||||||
HO |
HO |
CH3 |
||||||
180
