
- •Понятие о гомеостазе и гомеокинезе. Саморегуляторные принципы поддержания постоянства внутренней среды организма.
- •2. Основные формы регуляции физиологических функций. Взаимоотношение нервных и гуморальных механизмов регуляции.
- •2. Биологические мембраны, их строение и функциональные особенности.
- •Виды транспорта веществ через биологические мембраны.
- •2.2. Типы транспорта веществ через мембрану
- •3.Мембранный потенциал покоя. Современные представления о механизме его происхождения. Метод его регистрации.
- •4. Потенциал действия, его фазы. Современное представление о механизме его генерации.
- •Механизм возникновения
- •Механизм возникновения
- •Механизм возникновения
- •7. Законы раздражения. Закон силы. Закон «все или ничего» и его относительный характер.
- •8. Законы раздражения. Закон «силы времени». Понятие о реобазе и хронаксии. Хронаксиметрия и ее клиническое значение.
- •10.Законы раздражения. Закон градиента. Аккомодация, скорость аккомодации и ее мера. Закон градиента
- •9. Законы раздражения. Полярный закон. Физиологический электротон. Като-дическая депрессия.
- •Современное представление о механизме мышечного сокращения и расслабления.
- •2. Виды и режимы мышечного сокращения. Одиночное мышечное сокращение и его фазы. Сила и работа мышц. Правило средних нагрузок
- •Одиночное мышечное сокращение
- •Сила и работа мышц
- •Правило средних нагрузок
- •Виды тетануса, механизм возникновения различных видов тетануса:
- •Морфо-функциональные особенности гладких мышц.
- •Мионевральный синапс. Механизм передачи возбуждения в нем. Потенциал концевой пластинки.
- •Потенциал концевой пластинки
- •Классификация нервных волокон. Распространения возбуждения по безмиелиновым и миелиновым нервным волокнам. Характеристика их возбудимости и лабильности. Законы проведения возбуждения по нерву.
- •3. Учение п.К.Анохина о функциональных системах и саморегуляции
- •Узловые механизмы функциональной системы.
- •4. Строение, классификация и функциональные свойства синапсов. Морфо-функциональные особенности электрических и химических синапсов.
- •5. Возбуждающие синапсы, их медиаторы и рецепторы к ним. Особенности передачи возбуждения. Механизмы развития возбуждающего остсинаптического потенциала (впсп). Свойства синапсов.
- •Механизмы развития возбуждающего остсинаптического потенциала (впсп).
- •Свойства синапсов.
- •6. Тормозные синапсы и их медиаторы. Механизм развития тормозного постсинаптического потенциала (тпсп). Взаимодействие тормозных и возбуждающих синапсов.
- •7. Нервный центр. Анатомическое и физиологическое понятие нервного центра. Свойства нервных центров.
- •Основные свойства нервных центров
- •8. Торможение в цнс (и.М.Сеченов). Его роль. Виды торможения.
- •9. Первичное торможение. Его виды. Механизм возникновения
- •Структурно-функциональные особенности соматической и вегетативной нервной системы.
- •Отличия внс от соматической нервной системы
- •2. Вегетативная нервная система. Структурно – функциональные особенности.Синапсы, медиаторы и рецепторы внс.
- •Механизмы синаптической передачи в вегетативной нервной системе Постганглионарные или периферические синапсы
- •2.1. Симпатические синапсы
- •А) Медиатор симпатических синапсов — норадреналин
- •Б) Механизмы выделения норадреналина в синаптическую щель
- •В) Судьба выделившегося в синаптическую щель норадреналина
- •2.2. Парасимпатические синапсы а) Медиатор симпатических синапсов – ацетилхолина
- •Б) Механизм регуляции освобождения ацетилхолина в синаптическую щель
- •В) Судьба выделившегося в синаптическую щель ацетилхолина
- •Взаимосвязи симпатической и парасимпатической регуляции функций
- •2. Структурно – функциональная основа условного рефлекса. Современные представления о механизмах формирования временных связей.
- •4. Особенности внд человека. Учение и.П.Павлова о типах высшей нервной деятельности и о 1-й и 2-й сигнальных системах.
- •5. Эмоции, их генез, классификация и значение в целенаправленной деятельности человека. Эмоциональный стресс и его роль в формировании психосоматических заболеваний.
- •Традиционная "чикагская семерка" психосоматических заболеваний
- •6. Сон, его электрофизиологическая характеристика и значение для организма. Фазы сна. Теории сна.
- •2. Ответы на частную физиологию
- •1. Биоэнергетика организма. Методы определения энергетического обмена. Основной обмен и факторы, влияющие на его величину. Клиническое значение основного обмена.
- •1.Прямая калориметрия
- •2.Непрямая калориметрия
- •3. Исследование валового обмена
- •Для общего развития: теория обмена белков жиров и углеводов
- •Функции белков
- •Азотистый баланс
- •Регуляция белкового обмена
- •3. Температура тела человека. Температура кожных покровов и внутренних органов. Теплопродукция и теплоотдача и их механизмы. Изотермия и ее регуляция.
- •Физиология пищеварения
- •2. Пищеварение в желудке. Состав и свойства желудочного сока. Фазы отделения желудочного сока. Регуляция желудочной секреции. Приспособительный характер секреторной деятельности желудка.
- •Приспособительный характер желудочной секреции.
- •3. Пищеварение двенадцатиперстной кишке. Состав и свойства секрета поджелудочной железы. Регуляция панкреатической секреции. Пищеварение в тонкой кишке
- •Секреция поджелудочной железы
- •Фазы секреции поджелудочной железы.
- •4.Роль печени в пищеварении. Состав и свойства желчи. Регуляция образования желчи и выделения ее в двенадцатиперстную кишку.
- •5. Полостное и пристеночное пищеварение. Всасывание питательных веществ. Моторная деятельность тонкой кишки и ее регуляция.
- •Моторная деятельность тонкой кишки
- •Всасывание питательных веществ в тонкой кишке
- •6. Функциональные особенности нейрогуморальной регуляции пищеварения. Гормоны желудочно-кишечного тракта.
- •Физико-химические свойства крови
- •Регуляция постоянства осмотического давления крови.
- •2.Белки плазмы крови, их физиологическое значение. Онкотическое давление крови его роль. Скорость оседания эритроцитов, факторы, влияющие на ее величину. Клиническое значение соэ.
- •3. Эритроциты, строение, количество функций. Гемоглобин, количество, его виды, соединения и их физиологическое значение.
- •4. Лейкоциты, строение, количество, виды, функции. Лейкоцитарная формула и
- •Сдвиг лейкоцитарной формулы влево
- •Сдвиг лейкоцитарной формулы вправо
- •Функции тромбоцитов.
- •Взаимодействие свертывающей и противосвертывающей систем крови.
- •Фибринолиз
- •6. Группы крови. Система ав0. Определение группы крови у человека. Правила переливания крови.
- •Определение группы крови
- •2.Определение группы крови двойной реакцией (по стандартным сывороткам и стандартным эритроцитам) (перекрестный способ)
- •Правила переливания крови. Значение групповой принадлежности при гемотрансфузии
- •Правило Оттенберга
- •Особенность совместимости по резус-фактору
- •Переливание резус-несовместимой крови
- •Современные правила переливания крови
- •7. Резус-фактор. Учет резус-принадлежности крови в клинике. Резус-конфликт между матерью и плодом
- •2. Современные представления о структуре и локализации дыхательного центра. Автоматия дыхательного центра.
- •3. Газообмен в легких и тканях. Основные закономерности перехода газов че-
- •4Транспорт газов кровью. Кривая диссоциации оксигемоглобина, ее характе-
- •Транспорт газов кровью
- •Кислородная емкость крови.
- •5. Рефлекторно-гуморальные механизмы регуляции дыхания. Механизм первого вдоха новорожденного.
- •6.Дыхание в условиях пониженного и повышенного барометрического давления.
- •2. Автоматия сердца. Анатомический субстрат и природа автоматии. Проводя-
- •Ведущая роль синусового узла в автоматии.
- •Анатомический субстрат и природа автоматии.
- •Градиент автоматии
- •Особенности рефрактерного периода сердечной мышцы.
- •5.Сердечный цикл и его фазы. Давление крови в полостях сердца в различные фазы кардиоцикла. Работа клапанного аппарата сердца.
- •Сосудистый тонус и его компоненты.
- •Происхождение сосудистого тонуса
- •Иннервация сосудов
- •9. Давление крови в различных отделах сосудистой системы. Артериальное давление и факторы, определяющие его величину.
- •10.Сосудодвигательный центр. Рефлекторная регуляция системного артериального давления. Значение сосудистых рефлексогенных зон.
- •Рефлекторная регуляция системного артериального давления.
- •Значение сосудистых рефлексогенных зон
- •Способы регистрации.
- •1. Учение и. П.Павлова об анализаторах. Структура и функции анализаторов. Механизм возникновения возбуждения в рецепторах. Рецепторный и генераторный потенциалы.
- •Nb!!!! Анализаторы при ответе описываем по схеме: ПереферическийПроводниковый- Корковый отделы
- •2. Физиология зрительного анализатора. Рецепторный аппарат. Фотохимические процессы в сетчатке глаза при действии света. Теории цветного зрения (м.Ломоносов, г.Гельмгольц, п.Лазарев).
- •3. Слуховой анализатор. Звукоулавливающий и звукопроводящий аппарат органа слуха. Электрофизиологическая характеристика рецепторного отдела. Теории восприятия звука (г.Гельмгольц, г.Бекеши).
- •1. Реобаза, хронаксия и их значение в клинической практике. Хронаксиметрия.
- •2.Рецепторы: понятия, классификация, основные свойства и особенности возбуждения.
- •3. Утомление. Утомление изолированной мышцы, нервно-мышечного препарата и нейро-моторной единицы в условиях целостного организма. Теории утомления.
- •4. Особенности умственного труда. Переутомление. Профилактика утомления. Активный и пассивный отдых.
- •5. Кожные и сухожильные рефлексы человека и их клиническое значение.
- •6. Чувствительные и двигательные нарушения при полном и частичном пересечении спинного мозга (спинальный шок, синдром Броун-Секара).
- •7. Электроэнцефалография. Ритмы ээг и их характеристика.
- •8. Сон, его физиологическое значение. Фазы сна, теории сна. Характеристика электроэнцефалограммы человека в условиях естественного сна и бодрствования.
- •9. Обмен белков. Белковый оптимум и минимум. Азотистый баланс, его виды. Белковое голодание.
- •10.Физиологические основы голода и насыщения.
- •12. Анализ типичных кривых желудочной секреции на хлеб, мясо и молоко.Приспособительный характер желудочной секреции к разным видам пищи.
- •13. Методы изучения секреторной и моторной функций желудка человека.Запальный (аппетитный) сок и его значение.
- •14 Обмен углеводов. Нормо-, гипо- и гипергликемия. Механизм поддержания постоянства уровня глюкозы в крови.
- •15. Эндокринная функция поджелудочной железы и роль ее в регуляции обмена веществ.
- •16. Эндокринная роль щитовидной железы и ее роль в обмене веществ.
- •17. Эндокринная функция надпочечников.
- •18.Эндокринная функция половых желез.
- •19. Гипоталамо- гипофизарная система и ее роль в регуляции функций организма.
- •20.Регуляция уровня кальция в крови. Роль щитовидной и паращитовидной желез.
- •21.Минутный объем дыхания, его определение. «Мертвое пространство» и вентиляция альвеол, эффективность ее в зависимости от частоты и глубины дыхания.
- •22. Давление в плевральной полости, изменение его в разные фазы дыхательного цикла и роль в механизме внешнего дыхания. Пневмоторакс.
- •23. Парциальное давление газов о2 и со2 в альвеолярном воздухе и напряжение их в крови. Газообмен в легких.
- •24. Физиологические основы искусственного дыхания. Действие смеси 96 % о2 и 4 % со2.
- •26. Дыхание в измененных условиях внешней среды. Горная (высотная) болезнь, водолазная и кессонная болезнь, их физиологические механизмы.
- •27. Функции дыхательных путей. Защитные дыхательные рефлексы. Роль ирритантных и юксткапиллярных рецепторов в регуляции дыхания.
- •28. Кислотно-щелочное равновесие крови и механизмы, обеспечивающие его постоянство.
- •29.Скорость оседания эритроцитов, факторы, влияющие на ее величину. Клиническое значение соэ.
- •30. Правила переливания крови.
- •31.Кровезамещающие растворы. Классификация и показания к использованию.
- •32.Физиологические основы иммунитета. Т- и в-лимфоциты.
- •33.Нервная и гуморальная регуляция гемопоэза. Понятие о гемопоэтинах.
- •34.Изменение возбудимости сердечной мышцы в различные фазы сердечного цикла. Экстрасистолия.
- •35. Биофизические основы электрокардиографии. Основные отведения экг. Клиническое значение.
- •36.Тоны сердца и их происхождение. Компоненты первого и второго тона. Фонокардиография.
- •37. Физиологические механизмы регуляции деятельности пересаженного сердца.
- •39. Физиологические основы гипертензии.
- •40. Особенности легочного кровоснабжения.
- •41. Особенности коронарного кровообращения.
- •42. Особенности мозгового кровообращения.
- •43.Особенности почечного кровотока. Роль гидростатического давления крови в ультрафильтрации.
- •44.Ренин-ангиотензин-альдостероновая система и ее роль в регуляции артериального давления.
- •45. Биологическое значение боли. Виды боли. Современные представления о болевой рецепции.
- •46 Физиологические основы обезболивания и наркоза.
5.Сердечный цикл и его фазы. Давление крови в полостях сердца в различные фазы кардиоцикла. Работа клапанного аппарата сердца.


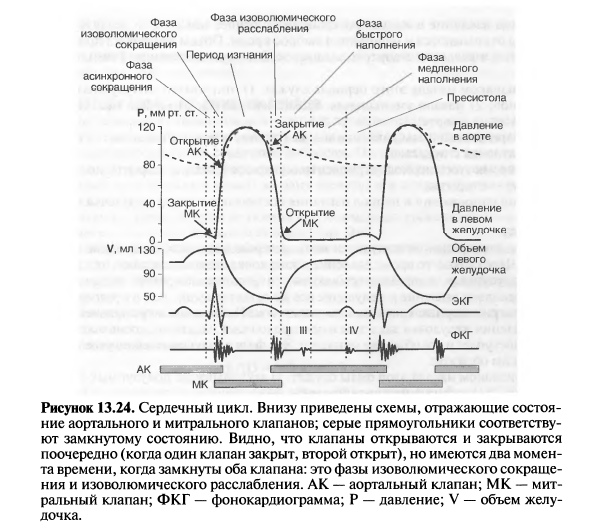



6. Интеркардиальная регуляция деятельности сердца. Внутриклеточная, межклеточная и внутрисердечная нервная регуляция.
Сердце человека, непрерывно работая, даже при спокойном образе жизни нагнетает в артериальную систему около 10 т крови в сутки, 4000 т в год и около 300 000 т за всю жизнь. При этом сердце всегда точно реагирует на потребности организма, поддерживая постоянно необходимый уровень кровотока.
Приспособление деятельности сердца к изменяющимся потребностям организма происходит при помощи ряда регуляторных механизмов. Часть из них расположена в самом сердце — это внутрисердечные регуляторные механизмы. К ним относятся внутриклеточные механизмы регуляции, регуляция межклеточных взаимодействий и нервные механизмы — внутрисердечные рефлексы. В ткани сердца кроме интрамуральных парасимпатических нейронов обнаружены и нервные клетки, относящиеся к симпатической НС, поскольку возбуждение через них передается адренэргическим путем. Интрамуральные нейроны образуют в сердце не только обычные вегетативные рефлекторные дуги, но и местные рефлекторные дуги, подобно тем, какие известны для стенки кишечника. По этим дугам возбуждение со стенок предсердий передается на мышцы желудочков и они подготавливаются к приему большего количества крови (меняется упругость, эластичность, сила сокращения миокарда). Это - проявление саморегуляции на органном уровне. Она работает даже в трансплантированном сердце.
Внутриклеточные механизмы регуляции. Электронная микроскопия позволила установить, что миокард не является синцитием, а состоит из отдельных клеток — миоцитов, соединяющихся между собой вставочными дисками. В каждой клетке действуют механизмы регуляции синтеза белков, обеспечивающих сохранение ее структуры и функций. Скорость синтеза каждого из белков регулируется собственным ауторегуляторным механизмом, поддерживающим уровень воспроизводства данного белка в соответствии с интенсивностью его расходования.
При увеличении нагрузки на сердце (например, при регулярной мышечной деятельности) синтез сократительных белков миокарда и структур, обеспечивающих их деятельность, усиливается. Появляется так называемая рабочая (физиологическая) гипертрофия миокарда, наблюдающаяся у спортсменов.
Внутриклеточные механизмы регуляции обеспечивают и изменение интенсивности деятельности миокарда в соответствии с количеством притекающей к сердцу крови. Этот механизм получил название «закон сердца» (закон Франка—Старлинга): сила сокращения сердца (миокарда) пропорциональна степени его кровенаполнения в диастолу (степени растяжения), т. е. исходной длине его мышечных волокон. Более сильное растяжение миокарда в момент диастолы соответствует усиленному притоку крови к сердцу. При этом внутри каждой миофибриллы актиновые нити в большей степени выдвигаются из промежутков между миозиновыми нитями, а значит, растет количество резервных мостиков, т. е. тех актиновых точек, которые соединяют актиновые и миозиновые нити в момент сокращения. Следовательно, чем больше растянута каждая клетка миокарда во время диастолы, тем больше она сможет укоротиться во время систолы. По этой причине сердце перекачивает в артериальную систему то количество крови, которое притекает к нему из вен. Такой тип миогенной регуляции сократимости миокарда получил название гетерометрической (т. е. зависимой от переменной величины — исходной длины волокон миокарда)регуляции.
Под гомеометрической регуляцией принято понимать изменения силы сокращений при неменяющейся исходной длине волокон миокарда. Это, прежде всего, ритмозависимые изменения силы сокращений. Если стимулировать полоску миокарда при равном растяжении с все увеличивающейся частотой, то можно наблюдать увеличение силы каждого последующего сокращения («лестница» Боудича). В качестве теста на гомеометрическую регуляцию используют также пробу Анрепа — резкое увеличение сопротивления выбросу крови из левого желудочка в аорту. Это приводит к увеличению в определенных границах силы сокращений миокарда. При проведении пробы выделяют две фазы. Вначале при увеличении сопротивления выбросу крови растет конечный диастолический объем и увеличение силы сокращений реализуется по гетерометрическому механизму. На втором этапе конечный диастолический объем стабилизируется, и возрастание силы сокращений определяется гомеометрическим механизмом.
Регуляция межклеточных взаимодействий. Установлено, что вставочные диски, соединяющие клетки миокарда, имеют различную структуру. Одни участки вставочных дисков выполняют чисто механическую функцию, другие обеспечивают транспорт через мембрану кардиомиоцита необходимых ему веществ, третьи — нексусы, или тесные контакты, проводят возбуждение с клетки на клетку. Нарушение межклеточных взаимодействий приводит к асинхронному возбуждению клеток миокарда и появлению сердечных аритмий.
Рис.
29. Схема внутрисердечной рефлекторной
дуги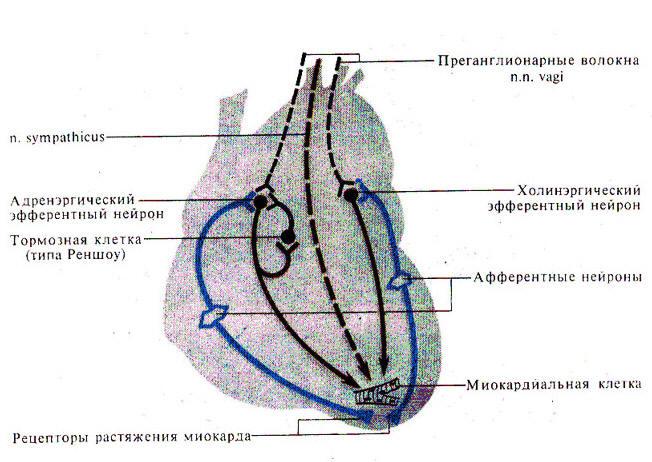
К межклеточным взаимодействиям следует отнести и взаимоотношения кардиомиоцитов с соединительнотканными клетками миокарда. Последние представляют собой не просто механическую опорную структуру. Они поставляют для сократительных клеток миокарда ряд сложных высокомолекулярных продуктов, необходимых для поддержания структуры и функции сократительных клеток. Подобный тип межклеточных взаимодействий получил название креаторных связей (Г. И. Косицкий).
Внутрисердечные периферические рефлексы. Более высокий уровень внутриорганной регуляции деятельности сердца представлен внутрисердечными нервными механизмами. Обнаружено, что в сердце возникают так называемые периферические рефлексы, дуга которых замыкается не в ЦНС, а в интрамуральных ганглиях миокарда. После гомотрансплантации сердца теплокровных животных и дегенерации всех нервных элементов экстракардиального происхождения в сердце сохраняется и функционирует внутриорганная нервная система, организованная по рефлекторному принципу. Эта система включает афферентные нейроны, дендриты которых образуют рецепторы растяжения на волокнах миокарда и венечных (коронарных) сосудах, вставочные и эфферентные нейроны. Аксоны последних иннервируют миокард и гладкие мышцы коронарных сосудов. Указанные нейроны соединяются между собой синаптическими связями, образуя внутрисердечные рефлекторные дуги.


Рис. 30. Изменение силы сокращения левого желудочка сердечно-легочного препарата кошки при растяжении стенки правого предсердия резиновым баллончиком
Внутрисердечные нейроны почти все холинергические (парасимпатические). На них, а также на МИФ клетках (малых интенсивно флюоресцирующих клетках — разновидности нейронов, находящихся практически во всех вегетативных ганглиях), заканчиваются терминали холинергических аксонов блуждающего нерва.
В экспериментах показано, что увеличение растяжения миокарда правого предсердия (в естественных условиях оно возникает при увеличении притока крови к сердцу) приводит к усилению сокращений миокарда левого желудочка. Таким образом, усиливаются сокращения не только того отдела сердца, миокард которого непосредственно растягивается притекающей кровью, но и других отделов, чтобы «освободить место» притекающей крови и ускорить выброс ее в артериальную систему. Доказано, что эти реакции осуществляются с помощью внутрисердечных периферических рефлексов (Г. И. Косицкий).
Подобные реакции наблюдаются лишь на фоне низкого исходного кровенаполнения сердца и незначительной величины давления крови в устье аорты и коронарных сосудах. Если камеры сердца переполнены кровью и давление в устье аорты и коронарных сосудах высокое, то растяжение венозных приемников в сердце угнетает сократительную активность миокарда, в аорту выбрасывается меньшее количество крови, а приток крови из вен затрудняется. Подобные реакции играют важную роль в регуляции кровообращения, обеспечивая стабильность кровенаполнения артериальной системы.
Гетерометрический и гомеометрический механизмы регуляции силы сокращения миокарда могут привести лишь к резкому увеличению энергии сердечного сокращения в случае внезапного повышения притока крови из вен или повышения артериального давления. Казалось бы, что при этом артериальная система не защищена от губительных для нее внезапных мощных ударов крови. В действительности же таких ударов не возникает благодаря защитной роли, осуществляемой рефлексами внутрисердечной нервной системы.
7. Экстракардиальная нейрогуморальная регуляция сердечной деятельности. Иннервации сердца. Влияние симпатических и парасимпатических нервов на работу сердца. Влияние гормонов, медиаторов и электролитов на сердце.
Нервы, осуществляющие экстракардиальную регуляцию деятельности сердца
Экстракардиальная нервная система представлена блуждающим и симпатическим нервами.
Блуждающий нерв - осуществляет афферентную и эфферентную иннервацию.
Эфферентная иннервация - за счёт 2-х нейронов:
1-й - преганглионарный нейрон на дне IV желудочка (ромбовидная ямка). Его аксон доходит до сердца.
2-й нейрон - расположен интрамурально. Его аксон заканчивается на:
проводящей системе сердца (правый v.vagus - синоатриальный узел, левый - атриовентрикулярный узел);
миокарде предсердий;
миокарде желудочков.
Парасимпатические нервы в 70-80 % случаев опосредуют своё влияние через местную нервную систему.
Симпатические нервы осуществляют эфферентную иннервацию.
1-й нейрон - в боковых рогах Th1 - Th5. Его аксон заканчивается в truncus sympaticus (шейные и верхний грудной ганглии).
В truncus sympaticus - 2й нейрон, отростки каждого идут в сердце:
к кардиомиоцитам желудочков;
миокарду предсердий;
проводящей системе сердца.
Симпатические нервные системы опосредуют своё действие через местную нервную систему реже, чем блуждающие нервы.
Влияние на сердце блуждающих, симпатических, парасимпатических нервов
И блуждающие, и симпатические нервы оказывают на сердце 5 влияний:
хронотропный (изменяют частоту сердечных сокращений);
инотропный (изменяют силу сердечных сокращений);
батмотропный (влияют на возбудимость миокарда);
дромотропный (влияет на проводимость);
тонотропный (влияют на тонус миокарда);
То есть они оказывают влияние на интенсивность обменных процессов.
Парасимпатическая нервная система - отрицательные все 5 явлений; симпатическая нервная система - все 5 явлений положительные.
Влияние парасимпатических нервов.
Отрицательное влияние n.vagus связано с тем, что его медиатор ацетилхолин взаимодействует с М-холинорецепторами.
Отрицательное хронотропное влияние - за счёт взаимодействия между ацетилхолином с М-холинорецепторами синоартиального узла. в результате открываются калиевые каналы (повышается проницаемость для К+), в результате уменьшается скорость медленной диастолической спонтанной поляризации, в итоге уменьшается количество сокращений в минуту (за счёт увеличения продолжительности действия потенциала действия).
Отрицательное инотропное влияние - ацетилхолин взаимодействует с М-холинорецепторами кардиомиоцитов. В результате тормозится активность аденилатциклазы и активируется гуанилатциклазный путь. Ограничение аденилатциклазного пути уменьшает окислительное фосфорилирование, уменьшается количество макроэргических соединений, в итоге уменьшается сила сердечных сокращений.
Отрицательное батмотропное влияние - ацетилхолин взаимодействует и М-холинорецепторами всех образований сердца. В резултате увеличивается проницаемость клеточной мембраны миокардиоцитов для К+. Величина мембранного потенциала увеличивается (гиперполяризация). Разность между мембранным потенциалом и Е критическим увеличивается, а эта разность показатель порога раздражения. Порог раздражения увеличивается - возбудимость уменьшается.
Отрицательное дромоторопное влияние - т. к. возбудимость уменьшается, то малые круговые токи медленнее распространяются, поэтому уменьшается скорость проведения возбуждения.
Отрицательный тонотропный эффект - под действием n.vagus не происходит активации обменных процессов. Влияние симпатических нервов.
Медиатор норадреналин взаимодействует с бетта 1-адренорецепротами синоатриального узла. в результате открываются Са2+-каналы - повышается проницаемость для К+ и Са2+. В результате увеличивается скорость мелоенной спонтанной диастолической деполяризации. Продолжительность потенциала действия уменьшается, соответственно частота сердечных сокращений увеличивается - положительный хронотропный эффект.
Положительный инотропный эффект - норадренолин взаимодействует с бетта1- рецепторами кардиоцитов. Эффекты:
активируется фермент аденилатциклаза, т. о. стимулируется окислительное фосфорилирование в клетке с образованием, увеличивается синтез АТФ - увеличивается сила сокращений.
увеличивается проницаемость для Са2+, который участвует в мышечных сокращениях, обеспечивая образование актомиозиновых мостиков.
под действием Са2+ увеличивается активность белка кальмомодулина, который обладает сродством к тропонину, что увеличивает силу сокращений.
активируются Са2+-зависимые протеинкиназы.
под действием норадреналина АТФ-азная активность миозина (фермент АТФ-аза). Это самый важный для симпатической нервной системы фермент.
Положительный батмотропный эффект: норадреналин взаимодействует с бетта 1-адренорецепорами всех клеток, увеличивается проницаемость для Na+ и Ca2+ (эти ионы поступают внутрь клетки), т. о. возникает деполяризация клеточной мембраны. Мембранный потенциал приближается к Е критическому (критический уровень деполяризации). Это снижает порог раздражения, а возбуждаемость клетки увеличивается.
Положительное дромотропное влияние - вызвано повышением возбудимости.
Положительное тонотропное влияние - связано с адаптационно-трофической функцией симпатической нервой системы. Для парасимпатической нервной системы наиболее важен отрицательный хронотропный эфект, а для симпатической нервной системы - положительное инотропное и тонотропное влияние.
Влияние гормонов, медиаторов и электролитов на сердце.
Как уже отмечалось выше, гуморальными агентами, вызывающими изменение работы сердца, могут быть медиаторы, гормоны, электролиты и продукты метаболизма. О влиянии медиаторов парасимпатической и симпатической системы говорили выше.
Гормональная регуляция работы сердца, прежде всего, осуществляется катехоламинами (адреналином и норадреналином) — гормонами мозгового вещества надпочечников). Катехоламины оказывают действие на сердце подобно симпатической нервной системе, т.е. положительное хроно-, ино -, батмо-, дромотропное. Выделение этих гормонов значительно увеличивается при боли, отрицательных эмоциях (гнев, ярость, страх), эмоциональном стрессе, физической нагрузке, гипоксии и т.д. Усиление работы сердца, повышение АД и изменение других функциональных параметров организма при этом имеют адаптационно-приспособительное значение.
В основе механизма действия катехоламинов на сердце лежит усиление медленного входящего кальциевого тока, т.е. они повышают кальциевую проницаемость и это приводит к увеличению силы сокращения. Катехоламины увеличивают частоту сердечных сокращений. При этом происходит уменьшение продолжительности как периода систолы, так и периода диастолы. Ускорение диастолы сердца связывают со стимуляцией поступления кальция во внутриклеточные депо. Катехоламины влияют на сердце за счет возбуждения адренорецепторов (преимущественно β-адренорецепторов). Эти влияния могут быть существенно ослаблены или полностью выключены β-адреноблокаторами. Это приводит к дозозависимой брадикардии, т.е. с увеличением дозы адреноблокатора степень выраженности брадикардии возрастает и синоатриальный узел может быть даже полностью заблокирован.
На сократительную функцию сердца оказывают влияние не только гормоны мозгового вещества надпочечников, но и гормоны коркового вещества. Глюкокортикоиды увеличивают силу сокращения, т.е. оказывают «кардиотоническое» влияние.
Опосредованное влияние на сердце оказывают глюкагон и инсулин, простагландины, усиливая его работу.
Гормоны щитовидной железы — тироксин и трииодтиронин вызывают учащение и усиление сокращений сердца. Такие явления четко проявляются у больных с гипертиреозом, а снижение функции щитовидной железы протекает явлениями брадикардии и ослабления силы сокращения сердца.
Существенное влияние на силу и частоту сердечных сокращений оказывают ионы калия и кальция. Повышение содержания калия в наружной среде (внеклеточный калий) приводит: а) к снижению потенциала покоя вследствие уменьшения градиента концентрации калия, б) к увеличению проницаемости возбудимых мембран для калия (как при действии ацетилхолина на миокард предсердий). Увеличение концентрации калия вдвое, т.е. до 8 ммоль/л (при норме 4 ммоль/л), приводит к незначительной деполяризации и очень слабому повышению возбудимости и скорости проведения, что вызывает подавление гетеротопных очагов возбуждения. При возрастании концентрации калия выше 8 ммоль/л возбудимость, скорость проведения и длительность потенциала действия падают, в результате чего уменьшается сила сокращения, синоатриальный узел перестает функционировать как водитель ритма сердца. Дальнейшее повышение концентрации калия сопровождается резко выраженной брадикардией и остановкой сердца в период диастолы.
Снижение концентрации внеклеточного калия ниже 4 ммоль/л приводит к повышению активности пейсмекера, активируются гетеротопные и эктопические очаги возбуждения. Все это приводит к нарушению ритма сердца (экстрасистолия, мерцание и трепетание предсердий и желудочков) и возможны очень тяжелые последствия вплоть до летального исхода из-за нарушения ритма сердца. Отсюда напрашивается вывод, что как значительное увеличение, так и уменьшение концентрации внеклеточного калия могут вызвать критическое состояние больного (особенно с патологией сердца).
Снижение возбудимости под действием растворов с высокой концентрацией калия (кардиоплегические растворы) используют в хирургии сердца, чтобы вызвать временную его остановку, а кровообращение в этих условиях поддерживается аппаратом искусственного кровообращения. При лечении ряда заболеваний сердца (в том числе аритмий) широко используются препараты (или растворы), содержащие калий. Таким больным назначается специальная диета с повышенным содержанием калия в пищевых продуктах.
Увеличение содержания кальция во внеклеточной жидкости сопровождается увеличением силы и частоты сердечных сокращений, а удаление кальция из внеклеточной жидкости (в эксперименте) вызывает прекращение сокращений сердца. Ряд веществ обладает способностью блокировать вход кальция во время потенциала действия и это сопровождается таким же эффектом, как и удаление кальция из внеклеточной жидкости. Такие вещества получили название антагонисты кальция (например, широко используется в кардиологии верапамил).
Деятельность сердца изменяется при изменении рН крови. Так, слабый ацидоз усиливает, а более выраженный ацидоз угнетает работу сердца. Алколоз сопровождается увеличением силы сокращения сердца.
Таким образом, механизмы регуляции работы сердца многокомпонентны. Вовлечение их в процесс регуляции может иметь как одновременный характер (ряда компонентов), так и последовательный характер. Благодаря этому обеспечивается высокая надежность и адаптируемость сердца к различным физиологическим и экстремальным условиям.
8. Морфо-функциональная классификация сосудов. Сосудистый тонус и его
компоненты. Иннервация сосудов. Механизмы вазоконстрикции и вазодила-
тации.
Все сосуды в зависимости от выполняемой ими функции можно подразделить на 6 групп:
1)амортизирующие сосуды (сосуды эластического типа),
2) резистивные сосуды,
3) сосуды–сфинктеры,
4) обменные сосуды,
5) емкостные сосуды,
6) шунтирующие сосуды.
К амортизирующим сосудам относятся аорта, легочная артерия и прилегающие к ним крупные артерии. Эти сосуды имеют выраженные эластические свойства, в частности аорта, и они создают амортизирующий (сглаживающий) эффект при выбросе крови из желудочков. Эти сосуды напоминают «компрессионную камеру», т.к. при изгнании крови из левого желудочка аорта и прилегающие крупные артерии растягиваются, а в момент диастолы, за счет эластичности стенки сосудов, объем их уменьшается и потенциальная энергия переходит в кинетическую, обеспечивая непрерывность кровотока.
К резистивным сосудам (сосуды сопротивления), прежде всего, относятся артериолы и концевые артерии, имеющие малый просвет и толстые гладкомышечные стенки, которые оказывают наибольшее сопротивление кровотоку. Сопротивление в них существенно нарастает при повышении тонуса (сокращении) мышц этих сосудов. Изменения просвета этих сосудов служат основным механизмом регуляции объемной скорости кровотока в органах и величины системного артериального давления.
Сосуды-сфинктеры регулируют число функционирующих капилляров. От сужения или расширения этих сосудов зависит объем поступающей крови в капилляры и общая площадь обменной их поверхности.
Обменные сосуды. К этим сосудам относятся капилляры, они не способны к сокращениям, т.к. не имеют мышечной оболочки, а просвет их изменяется в основном пассивно вслед за колебаниями давления в пре- и посткапиллярных резистивных сосудах и сосудах – сфинктерах. В капиллярах происходят важнейшие обменные процессы за счет фильтрации, диффузии, осмоса и т.д. Наибольшую роль в обмене жидкостью и веществами между кровью и межклеточным пространством играет двусторонняя диффузия. Скорость диффузии настолько высока, что при прохождении крови через капилляры жидкость плазмы успевает 40 раз полностью обменяться с жидкостью межклеточного пространства, эти жидкости постоянно перемешиваются. При этом число молекул переходящих из капилляра и в капилляр,примерно одинаково. Скорость диффузии через общую обменную поверхность (а она составляет в большом круге кровообращения около 1000 м2) равняется примерно 60 л/мин. Водорастворимые вещества (натрий, калий, глюкоза и т.д.) диффундируюют только через заполненные водой поры. Крупные молекулы через поры капилляров переносятся путем пиноцитоза. Через стенку капилляров свободно диффундируют жирорастворимые вещества, а также кислород и углекислый газ. Второй механизм, лежащий в основе обмена, фильтрационный. Интенсивность фильтрации и реабсорбции в капиллярах зависит от следующих параметров: гидростатического давления в капиллярах, гидростатического давления тканевой жидкости, онкотического давления плазмы,онкотического давления тканевой жидкости и коэффициента фильтрации. Давление в начале капилляров равна 30-35 мм рт.ст, а в конце – 13-17 мм рт.ст; давление межтканевой жидкости близко к нулю или равно около 3 мм рт.ст; онкотическое давление плазмы составляет примерно 25 мм рт.ст. и обусловлено оно белками плазмы. Из приведенных данных следует, что эффективное фильтрационное давление примерно равно 9-10 мм рт.ст. (35-25 мм рт.ст. = 10 мм рт.ст.). Эффективное реабсорбционное давление, т.е. давление способствующее поступлению жидкости из межтканевого пространства в капилляры равно примерно 8 мм рт.ст. Фильтрация происходит в артериальной части капилляра, а реабсорбция - в венозной части. Средняя скорость фильтрацци во всех капиллярах составляет около 14 мл/ мин., или 20 литров в сутки. Скорость реабсорбции примерно равна 12,5 мл/мин., т.е. 18 л в сутки и около 2 л в сутки оттекает по лимфатическим сосудам.
Емкостные сосуды – это главным образом вены. Вены обладают высокой растяжимостью и они способны вмещать и выбрасывать большие объемы крови без существенного влияния на другие параметры кровотока. Вены являются своеобразными резервуарами крови, в них содержится примерно 64% от общего объема крови. Несмотря на такой большой объем крови в норме обеспечивается стабильный венозный возврат. Венозному воврату (т.е. поступлению крови в правое предсердие) способствуют: 1) артерио-венозный градиент, а также градиент давления между начальной частью венозной системы и полыми венами (у впадения их в сердце), 2) наличие клапанов в венах, 3) мышечный насос, т.е. сокращение мышц способствует проталкиванию крови от периферии к сердцу, 4) дыхательный насос – во время вдоха давление в грудной полости падает и в результате этого внутригрудные сосуды (особенно полые вены) расширяются, а это приводит к снижению гидродинамического сопротивления и «засасыванию» крови из дистальнее расположенной части сосудов. Кроме того, происходит опускание диафрагмы и повышение давления в брюшной полости, в результате уменьшаются просвет и емкость сосудов брюшной полости. При выдохе наблюдается обратная картина, 5) присасывающее действие сердца – во время диастолы сердца давление в правом предсердии и полых венах снижается и это оказывает присасывающее влияние. Все эти факторы обеспечивают полноценный венозный возврат.
![]() Некоторые
вены обладают особенно высокой емкостью,
к таким венам относятся вены печени,
крупные вены чревной области, вены
подсосочкового сплетения. Вместе эти
вены могут удерживать до 1000 мл крови,
которая при необходимости выбрасывается
в общий кровоток и изменяет общую
гемодинамику.
Некоторые
вены обладают особенно высокой емкостью,
к таким венам относятся вены печени,
крупные вены чревной области, вены
подсосочкового сплетения. Вместе эти
вены могут удерживать до 1000 мл крови,
которая при необходимости выбрасывается
в общий кровоток и изменяет общую
гемодинамику.
Шунтирующие сосуды – это артериовенозные анастомозы, когда они открываются кровоток через капилляры либо уменьшается, либо полностью прекращается.
Общий объем крови у мужчин составляет 77 мл/кг массы, а у женщин – 65 мл/кг (10%) и составляет у мужчин около 5,4 л, а у женщин – около 4,5 л. У взрослого человека примерно 84% всей крови содержится в большом круге кровообращения, около 9% - в малом круге и около 7% - в сердце. В артериях большого круга содержится около 18%, в артериолах – около 3%, в капиллярах – около 6% от общего объема крови.
