
- •Понятие о гомеостазе и гомеокинезе. Саморегуляторные принципы поддержания постоянства внутренней среды организма.
- •2. Основные формы регуляции физиологических функций. Взаимоотношение нервных и гуморальных механизмов регуляции.
- •2. Биологические мембраны, их строение и функциональные особенности.
- •Виды транспорта веществ через биологические мембраны.
- •2.2. Типы транспорта веществ через мембрану
- •3.Мембранный потенциал покоя. Современные представления о механизме его происхождения. Метод его регистрации.
- •4. Потенциал действия, его фазы. Современное представление о механизме его генерации.
- •Механизм возникновения
- •Механизм возникновения
- •Механизм возникновения
- •7. Законы раздражения. Закон силы. Закон «все или ничего» и его относительный характер.
- •8. Законы раздражения. Закон «силы времени». Понятие о реобазе и хронаксии. Хронаксиметрия и ее клиническое значение.
- •10.Законы раздражения. Закон градиента. Аккомодация, скорость аккомодации и ее мера. Закон градиента
- •9. Законы раздражения. Полярный закон. Физиологический электротон. Като-дическая депрессия.
- •Современное представление о механизме мышечного сокращения и расслабления.
- •2. Виды и режимы мышечного сокращения. Одиночное мышечное сокращение и его фазы. Сила и работа мышц. Правило средних нагрузок
- •Одиночное мышечное сокращение
- •Сила и работа мышц
- •Правило средних нагрузок
- •Виды тетануса, механизм возникновения различных видов тетануса:
- •Морфо-функциональные особенности гладких мышц.
- •Мионевральный синапс. Механизм передачи возбуждения в нем. Потенциал концевой пластинки.
- •Потенциал концевой пластинки
- •Классификация нервных волокон. Распространения возбуждения по безмиелиновым и миелиновым нервным волокнам. Характеристика их возбудимости и лабильности. Законы проведения возбуждения по нерву.
- •3. Учение п.К.Анохина о функциональных системах и саморегуляции
- •Узловые механизмы функциональной системы.
- •4. Строение, классификация и функциональные свойства синапсов. Морфо-функциональные особенности электрических и химических синапсов.
- •5. Возбуждающие синапсы, их медиаторы и рецепторы к ним. Особенности передачи возбуждения. Механизмы развития возбуждающего остсинаптического потенциала (впсп). Свойства синапсов.
- •Механизмы развития возбуждающего остсинаптического потенциала (впсп).
- •Свойства синапсов.
- •6. Тормозные синапсы и их медиаторы. Механизм развития тормозного постсинаптического потенциала (тпсп). Взаимодействие тормозных и возбуждающих синапсов.
- •7. Нервный центр. Анатомическое и физиологическое понятие нервного центра. Свойства нервных центров.
- •Основные свойства нервных центров
- •8. Торможение в цнс (и.М.Сеченов). Его роль. Виды торможения.
- •9. Первичное торможение. Его виды. Механизм возникновения
- •Структурно-функциональные особенности соматической и вегетативной нервной системы.
- •Отличия внс от соматической нервной системы
- •2. Вегетативная нервная система. Структурно – функциональные особенности.Синапсы, медиаторы и рецепторы внс.
- •Механизмы синаптической передачи в вегетативной нервной системе Постганглионарные или периферические синапсы
- •2.1. Симпатические синапсы
- •А) Медиатор симпатических синапсов — норадреналин
- •Б) Механизмы выделения норадреналина в синаптическую щель
- •В) Судьба выделившегося в синаптическую щель норадреналина
- •2.2. Парасимпатические синапсы а) Медиатор симпатических синапсов – ацетилхолина
- •Б) Механизм регуляции освобождения ацетилхолина в синаптическую щель
- •В) Судьба выделившегося в синаптическую щель ацетилхолина
- •Взаимосвязи симпатической и парасимпатической регуляции функций
- •2. Структурно – функциональная основа условного рефлекса. Современные представления о механизмах формирования временных связей.
- •4. Особенности внд человека. Учение и.П.Павлова о типах высшей нервной деятельности и о 1-й и 2-й сигнальных системах.
- •5. Эмоции, их генез, классификация и значение в целенаправленной деятельности человека. Эмоциональный стресс и его роль в формировании психосоматических заболеваний.
- •Традиционная "чикагская семерка" психосоматических заболеваний
- •6. Сон, его электрофизиологическая характеристика и значение для организма. Фазы сна. Теории сна.
- •2. Ответы на частную физиологию
- •1. Биоэнергетика организма. Методы определения энергетического обмена. Основной обмен и факторы, влияющие на его величину. Клиническое значение основного обмена.
- •1.Прямая калориметрия
- •2.Непрямая калориметрия
- •3. Исследование валового обмена
- •Для общего развития: теория обмена белков жиров и углеводов
- •Функции белков
- •Азотистый баланс
- •Регуляция белкового обмена
- •3. Температура тела человека. Температура кожных покровов и внутренних органов. Теплопродукция и теплоотдача и их механизмы. Изотермия и ее регуляция.
- •Физиология пищеварения
- •2. Пищеварение в желудке. Состав и свойства желудочного сока. Фазы отделения желудочного сока. Регуляция желудочной секреции. Приспособительный характер секреторной деятельности желудка.
- •Приспособительный характер желудочной секреции.
- •3. Пищеварение двенадцатиперстной кишке. Состав и свойства секрета поджелудочной железы. Регуляция панкреатической секреции. Пищеварение в тонкой кишке
- •Секреция поджелудочной железы
- •Фазы секреции поджелудочной железы.
- •4.Роль печени в пищеварении. Состав и свойства желчи. Регуляция образования желчи и выделения ее в двенадцатиперстную кишку.
- •5. Полостное и пристеночное пищеварение. Всасывание питательных веществ. Моторная деятельность тонкой кишки и ее регуляция.
- •Моторная деятельность тонкой кишки
- •Всасывание питательных веществ в тонкой кишке
- •6. Функциональные особенности нейрогуморальной регуляции пищеварения. Гормоны желудочно-кишечного тракта.
- •Физико-химические свойства крови
- •Регуляция постоянства осмотического давления крови.
- •2.Белки плазмы крови, их физиологическое значение. Онкотическое давление крови его роль. Скорость оседания эритроцитов, факторы, влияющие на ее величину. Клиническое значение соэ.
- •3. Эритроциты, строение, количество функций. Гемоглобин, количество, его виды, соединения и их физиологическое значение.
- •4. Лейкоциты, строение, количество, виды, функции. Лейкоцитарная формула и
- •Сдвиг лейкоцитарной формулы влево
- •Сдвиг лейкоцитарной формулы вправо
- •Функции тромбоцитов.
- •Взаимодействие свертывающей и противосвертывающей систем крови.
- •Фибринолиз
- •6. Группы крови. Система ав0. Определение группы крови у человека. Правила переливания крови.
- •Определение группы крови
- •2.Определение группы крови двойной реакцией (по стандартным сывороткам и стандартным эритроцитам) (перекрестный способ)
- •Правила переливания крови. Значение групповой принадлежности при гемотрансфузии
- •Правило Оттенберга
- •Особенность совместимости по резус-фактору
- •Переливание резус-несовместимой крови
- •Современные правила переливания крови
- •7. Резус-фактор. Учет резус-принадлежности крови в клинике. Резус-конфликт между матерью и плодом
- •2. Современные представления о структуре и локализации дыхательного центра. Автоматия дыхательного центра.
- •3. Газообмен в легких и тканях. Основные закономерности перехода газов че-
- •4Транспорт газов кровью. Кривая диссоциации оксигемоглобина, ее характе-
- •Транспорт газов кровью
- •Кислородная емкость крови.
- •5. Рефлекторно-гуморальные механизмы регуляции дыхания. Механизм первого вдоха новорожденного.
- •6.Дыхание в условиях пониженного и повышенного барометрического давления.
- •2. Автоматия сердца. Анатомический субстрат и природа автоматии. Проводя-
- •Ведущая роль синусового узла в автоматии.
- •Анатомический субстрат и природа автоматии.
- •Градиент автоматии
- •Особенности рефрактерного периода сердечной мышцы.
- •5.Сердечный цикл и его фазы. Давление крови в полостях сердца в различные фазы кардиоцикла. Работа клапанного аппарата сердца.
- •Сосудистый тонус и его компоненты.
- •Происхождение сосудистого тонуса
- •Иннервация сосудов
- •9. Давление крови в различных отделах сосудистой системы. Артериальное давление и факторы, определяющие его величину.
- •10.Сосудодвигательный центр. Рефлекторная регуляция системного артериального давления. Значение сосудистых рефлексогенных зон.
- •Рефлекторная регуляция системного артериального давления.
- •Значение сосудистых рефлексогенных зон
- •Способы регистрации.
- •1. Учение и. П.Павлова об анализаторах. Структура и функции анализаторов. Механизм возникновения возбуждения в рецепторах. Рецепторный и генераторный потенциалы.
- •Nb!!!! Анализаторы при ответе описываем по схеме: ПереферическийПроводниковый- Корковый отделы
- •2. Физиология зрительного анализатора. Рецепторный аппарат. Фотохимические процессы в сетчатке глаза при действии света. Теории цветного зрения (м.Ломоносов, г.Гельмгольц, п.Лазарев).
- •3. Слуховой анализатор. Звукоулавливающий и звукопроводящий аппарат органа слуха. Электрофизиологическая характеристика рецепторного отдела. Теории восприятия звука (г.Гельмгольц, г.Бекеши).
- •1. Реобаза, хронаксия и их значение в клинической практике. Хронаксиметрия.
- •2.Рецепторы: понятия, классификация, основные свойства и особенности возбуждения.
- •3. Утомление. Утомление изолированной мышцы, нервно-мышечного препарата и нейро-моторной единицы в условиях целостного организма. Теории утомления.
- •4. Особенности умственного труда. Переутомление. Профилактика утомления. Активный и пассивный отдых.
- •5. Кожные и сухожильные рефлексы человека и их клиническое значение.
- •6. Чувствительные и двигательные нарушения при полном и частичном пересечении спинного мозга (спинальный шок, синдром Броун-Секара).
- •7. Электроэнцефалография. Ритмы ээг и их характеристика.
- •8. Сон, его физиологическое значение. Фазы сна, теории сна. Характеристика электроэнцефалограммы человека в условиях естественного сна и бодрствования.
- •9. Обмен белков. Белковый оптимум и минимум. Азотистый баланс, его виды. Белковое голодание.
- •10.Физиологические основы голода и насыщения.
- •12. Анализ типичных кривых желудочной секреции на хлеб, мясо и молоко.Приспособительный характер желудочной секреции к разным видам пищи.
- •13. Методы изучения секреторной и моторной функций желудка человека.Запальный (аппетитный) сок и его значение.
- •14 Обмен углеводов. Нормо-, гипо- и гипергликемия. Механизм поддержания постоянства уровня глюкозы в крови.
- •15. Эндокринная функция поджелудочной железы и роль ее в регуляции обмена веществ.
- •16. Эндокринная роль щитовидной железы и ее роль в обмене веществ.
- •17. Эндокринная функция надпочечников.
- •18.Эндокринная функция половых желез.
- •19. Гипоталамо- гипофизарная система и ее роль в регуляции функций организма.
- •20.Регуляция уровня кальция в крови. Роль щитовидной и паращитовидной желез.
- •21.Минутный объем дыхания, его определение. «Мертвое пространство» и вентиляция альвеол, эффективность ее в зависимости от частоты и глубины дыхания.
- •22. Давление в плевральной полости, изменение его в разные фазы дыхательного цикла и роль в механизме внешнего дыхания. Пневмоторакс.
- •23. Парциальное давление газов о2 и со2 в альвеолярном воздухе и напряжение их в крови. Газообмен в легких.
- •24. Физиологические основы искусственного дыхания. Действие смеси 96 % о2 и 4 % со2.
- •26. Дыхание в измененных условиях внешней среды. Горная (высотная) болезнь, водолазная и кессонная болезнь, их физиологические механизмы.
- •27. Функции дыхательных путей. Защитные дыхательные рефлексы. Роль ирритантных и юксткапиллярных рецепторов в регуляции дыхания.
- •28. Кислотно-щелочное равновесие крови и механизмы, обеспечивающие его постоянство.
- •29.Скорость оседания эритроцитов, факторы, влияющие на ее величину. Клиническое значение соэ.
- •30. Правила переливания крови.
- •31.Кровезамещающие растворы. Классификация и показания к использованию.
- •32.Физиологические основы иммунитета. Т- и в-лимфоциты.
- •33.Нервная и гуморальная регуляция гемопоэза. Понятие о гемопоэтинах.
- •34.Изменение возбудимости сердечной мышцы в различные фазы сердечного цикла. Экстрасистолия.
- •35. Биофизические основы электрокардиографии. Основные отведения экг. Клиническое значение.
- •36.Тоны сердца и их происхождение. Компоненты первого и второго тона. Фонокардиография.
- •37. Физиологические механизмы регуляции деятельности пересаженного сердца.
- •39. Физиологические основы гипертензии.
- •40. Особенности легочного кровоснабжения.
- •41. Особенности коронарного кровообращения.
- •42. Особенности мозгового кровообращения.
- •43.Особенности почечного кровотока. Роль гидростатического давления крови в ультрафильтрации.
- •44.Ренин-ангиотензин-альдостероновая система и ее роль в регуляции артериального давления.
- •45. Биологическое значение боли. Виды боли. Современные представления о болевой рецепции.
- •46 Физиологические основы обезболивания и наркоза.
Сдвиг лейкоцитарной формулы влево
Сдвиг лейкоцитарной формулы влево – появление в периферической крови повышенного количества молодых форм нейтрофилов – палочкоядерных и юных. Наблюдается при активной борьбе организма с возбудителем. Благоприятный признак течения болезни.
Сдвиг лейкоцитарной формулы вправо
Сдвиг вправо – проявление старения популяции нейтрофилов без пополнения молодыми формами. В мазке крови только сегментноядерные нейтрофилы с признаками старения (гиперсегментация ядра).
Клиническое значение
При различных патологических состояниях лейкоцитарная формула может претерпевать значительные изменения: увеличение или уменьшение содержания какого-либо вида лейкоцитов или появлении клеточных форм, в норме в периферической крови не встречающихся.
Увеличение количества базофилов обозначается как базофилия, эозинофилов – как эозинофилия, нейтрофилов – как нейтрофилия или нейтрофилез, лимфоцитов – как лимфоцитоз, моноцитов – как моноцитоз. Уменьшение соответствующих видов клеток - эозинопения, нейтропения, лимфопения и моноцитопения.
Увеличение или уменьшение количества отдельных видов лейкоцитов может быть абсолютным и относительным. Изменение процентного содержания не всегда соответствует колебанию абсолютных величин, что необходимо принимать во внимание при анализе лейкоцитарной формулы.
Базофилия - увеличение количества базофилов наблюдается при хроническом миелолейкозе, полицитемии, гипотиреозе, нефрите, сахарном диабете, при длительном рентгеновском воздействии, у женщин в начале менструаций.
Эозинофилия встречается при аллергических заболеваниях (бронхиальная астма, крапивница, отек Квинке, вазомоторный ринит), глистных инвазиях, хроническом миелолейкозе, некоторых инфекциях (скарлатина, оспа).
Уменьшение количества эозинофилов в периферической крови (эозинопения) или полное их отсутствие (анэозинофилия) наблюдается в начальном периоде острых инфекций, воспалительных процессов, инфаркта миокарда. Появление эозинофилов в крови в таких случаях является хорошим признаком.
Увеличение количества нейтрофилов в периферической крови (нейтрофилез) отмечается при острых воспалительных заболеваниях, гнойных процессах, различных интоксикациях, опухолях.
Сдвигом лейкоцитарной формулы вправо называется увеличение количества более зрелых нейтрофилов (сегментоядерных) –сегментоядерный нейтрофилез.
Сдвиг лейкоцитарной формулы влево –появление незрелых нейтрофилы с круглым ядром – метамиелоцитов (юные нейтрофилы), или их предшественников – миелоцитов. При этом степень выраженности нейтрофилеза и его характер могут указывать на тяжесть процесса, приведшего к изменению периферической крови.
Незначительный нейтрофилез с небольшим сдвигом влево обычно указывает на легкое течение заболевания, а значительный – на тяжелое. В последнем случае в периферической крови появляются нейтрофилы с токсической зернистостью и вакуолизацией цитоплазмы.
Нейтропения наблюдается при ряде инфекционных заболеваний (брюшной тиф), вирусных инфекциях (грипп), при действии ионизирующей радиации, после рентгенотерапии, при гемобластозах. Временное уменьшение количества нейтрофилов в периферической крови встречается у больных, принимающих некоторые медикаменты (бутадион, цитостатические препараты).
Лимфоцитозчасто наблюдается при заболеваниях, сопровождающихся нейтропенией, и является в таких случаях относительным.
Абсолютный лимфоцитоз встречается при инфекционном мононуклеозе, хроническом лимфолейкозе, туберкулезе и некоторых детских инфекциях (корь, краснуха, ветряная оспа, коклюш).
В раннем детском возрасте и после приема внутрь большого количества жиров может отмечаться физиологический лимфоцитоз.
Лимфоцитопения может встречаться у больных с нейтрофилезом, т. е. является относительной.
Абсолютная лимфоцитопения наблюдается при всех заболеваниях, сопровождающихся замещением лимфоидной ткани другими клеточными элементами (лимфогранулематоз, лимфосарком, острый и хронический миелоидный лейкоз), а также при уремии, тяжелых септических процессах, туберкулезе, при лучевой болезни, длительном приеме гормонов.
Моноцитозсвидетельствует о развитии патологических иммунных процессов в организме. Увеличение количества моноцитов в периферической крови с одновременным увеличением нейтрофилов наблюдается при затяжном септическом эндокардите, нагноительных процессах. Абсолютный моноцитоз характерен для инфекционного мононуклеоза, при котором он развивается как специфическая реакция на вирус.
Моноцитопения встречается при тяжелых септических заболеваниях и гипертоксических формах инфекционных процессов.
5. Понятие о гемостазе. Сосудисто-тромбоцитарный и коагуляционный гемостаз. Факторы и фазы свертывания крови. Тромбоциты и их роль в гемокоагуляции. Взаимодействие свертывающей и противосвертывающей систем крови. Фибринолиз.



Свертывание крови (гемокоагуляция) является защитным механизмом организма, направленным на сохранение крови в сосудистой системе. В результате свертывания кровь из жидкого состояния переходит в желеобразный сгусток за счет превращения фибриногена (растворимого в воде белка плазмы) в фибрин (не растворимый в воде белок). Первые шаги по раскрытию механизма свертывания крови были открыты физиологом А.А. Шмидтом (1863-1864). Он обнаружил некоторые факторы свертывания, признал ферментативную природу реакций и их фазность. По современным представлениям в процессе свертывания крови принимают участие много факторов: плазменные, тромбоцитарные, сосудистого эндотелия и субэндотелия, а также форменные элементы.
![]()
В свертывании крови принимают участие много факторов
Они получили название – факторы свертывания крови.
Содержатся в плазме крови, форменных элементах (эритроцитах, лейкоцитах, тромбоцитах) и в тканях.
По международной номенклатуре они обозначаются арабскими цифрами и
латинскими буквами (от слова пластинка). Важнейшими из них являются:

Огромное значение в адгезии тромбоцитов играет фактор Виллебранда, содержащийся в плазме и α-гранулах пластинок, а также фибронектин. Фибронектин обнаружен, как в сосудистой стенке, так и в α-гранулах тромбоцитов.
Необходимо отметить, что адгезия резко усиливается при реакции «освобождения» кровяных пластинок, когда фибронектин и фактор Виллебранда покидают тромбоциты и поступают непосредственно в плазму крови. Адгезия и агрегация тромбоцитов, как уже указывалось, зависит от соотношения тромбоксанов, выделяемых из кровяных пластинок, и простациклина, синтезируемого преимущественно эндотелием сосудистой стенки (рис. 14).
Важная роль в агрегации кровяных пластинок принадлежит фактору, активирующему тромбоциты (ФАТ), который синтезируется лейкоцитами, мононуклеарами, макрофагами, тромбоцитами, сосудистой стенкой.
Таким образом, тромбоциты, осуществляя адгезию, агрегацию и реакция «освобождения» активно участвуют в образовании и консолидации тромбоцитарной пробки, запускают процесс свертывания крови, чем способствуют остановке кровотечения.

Процесс свертывания крови и его значение.
У здорового человека кровотечение из мелких сосудов при их ранении останавливается за 1-3 мин. Этот первичный гемостаз почти целиком обусловлен сужением сосудов и
механической закупоркой их агрегатами тромбоцитов и получил название сосудисто-тромбоцитарного
гемостаза, который складывается из ряда последовательных процессов:
Сосудисто-тромбоцитарный механизм гемостаза.
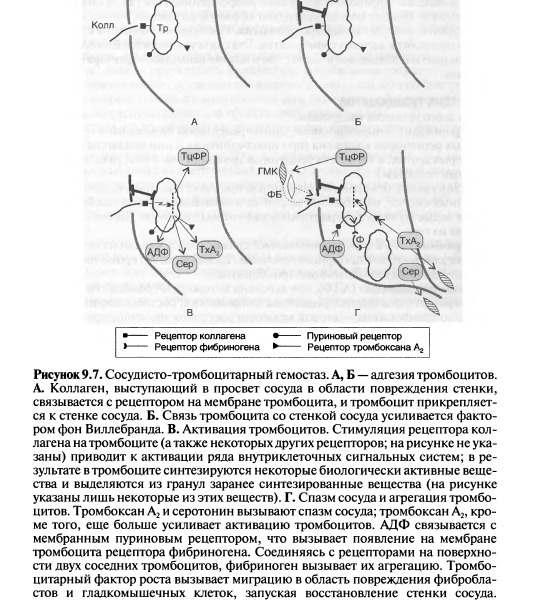
Остановка кровотечения за счет сосудисто-тромбоцитарного механизма гемостаза осуществляется следующим образом.
1) Рефлекторный спазм поврежденных сосудов. Обеспечивается сосудосуживающими веществами, освобожденными из тромбоцитов (серотонин, адреналин, норадреналин). Спазм приводит к временной остановке или уменьшению кровотечения.
• 2) Адгезия тромбоцитов (приклеивание к месту травмы). В месте повреждения стенка сосуда становится заряженной
положительно. Отрицательно заряженные тромбоциты прилипают к обнажившимся волокнам коллагена базальной
мембраны. Адгезия завершается за 3-10 сек.
• 3) Обратимая агрегация (скучивание) тромбоцитов. Стимулятором является «внешняя» АДФ, выделяющаяся из поврежденного сосуда и «внутренняя» АДФ, освобождающаяся из тромбоцитов и эритроцитов. Образуется рыхлая тромбоцитарная пробка, пропускающая через себя плазму крови.
Сосудисто-тромбоцитарные реакции обеспечивают гемостаз лишь в микроциркуляторных сосудах, однако тромбоцитарные тромбы не выдерживают высокого давления и вымываются. В таких сосудах гемостаз может быть достигнут путем образования фибринового тромба. Его образование осуществляется ферментативным коагуляционным механизмом, протекающим в 3 фазы .
Фаза I. Формирование протромбиназы.
Различают внешнюю (тканевую) и внутреннюю (кровяную) систему. Внешний путь запускается тканевым тромбопластином, который выделяется из стенок поврежденного сосуда и окружающих тканей. Во внутренней системе фосфолипиды и другие факторы поставляются самой кровью. Тканевая система (тканевая протромбиназа) образуется за 5-10 сек.
тромбоцитарная
5-10 мин. протромбиназы
эритроцитарная
Толчком для образования тканевой протромбиназы служит повреждение стенок сосудов с выделением из них в кровь тканевого тромбопластина. В формировании тканевой протромбиназы участвуют плазменные факторы VII, V, X, и Ca++.
Кровяная протромбиназа образуется медленнее. Инициатором ее образования являются обнажающиеся при
повреждении сосуда волокна коллагена. Начальной реакцией является активация фактора Хагемана при контакте с данными волокнами. После этого он с помощью активированного им калликреина и кинина активирует фактор XI, образуя с ним комплекс- продукт контактной активации. К этому времени происходит разрушение эритроцитов и тромбоцитов, на фосфолипидах, которых завершается образование комплекса фактор XII + фактор XI.
Эта реакция самая продолжительная, на нее уходит 5-7 мин. из 5-10 мин. всего времени свертывания. Под влиянием
фактора XI активизируется фактор IX, который реагирует с фактором VIII и Ca. Образующийся кальциевый комплекс, адсорбируется на фосфолипидах, образуя последний комплекс фактор X +фактор V + Ca++ и завершение образования кровяной протромбиназы.
Фаза II. Появление протромбиназы свидетельствует о начале II фазы свертывания крови – образование тромбина ( 2-5 сек.) Протромбиназа адсорбирует протромбин и превращает его в тромбин при участии факторов V, X и Ca++.
Фаза III. Превращение фибриногена в фибрин в 3 этапа.
Тромбин 1). Фибриноген → фибрин-мономер Ca 2). Фибрин-мономер → полимеризация и образование фибрин - полимера (растворимый фибрин «S» ). 3). Образуется окончательный нерастворимый фибрин «1» при участии фактора XIII и фибриназы тканей, тромбоцитов и эритроцитов. Завершается образование кровяного тромба.
Таким образом, свертывание крови представляет собой цепной ферментативный процесс, в котором на матрице фосфолипидов последовательно активируются факторы свертывания и образуются их комплексы. Фосфолипиды клеточных мембран выступают как катализаторы взаимодействия и активации факторов свертывания, ускоряя
течение гемокоагуляции.
Коагуляционный механизм гемостаза.
Процесс свертывания крови (гемокоагуляция) заключается в переходе растворимого белка плазмы крови фибриногена в нерастворимое состояние –фибрин. В результате процесса свертывания кровь из жидкого состояния переходит в студнеобразное, образуется сгусток, который закрывает просвет поврежденного сосуда.
Кровяные пластинки (тромбоциты): размеры, строение, функции, продолжительность жизни.
Тромбоциты представляют собой свободно циркулирующие в крови безъядерные фрагменты цитоплазмы гигантских клеток красного костного мозга — мегакариоцитов. Размер тромбоцитов 2—3 мкм, их количество в крови составляет 200-300х109л. Каждая пластинка в световом микроскопе состоит из двух частей: хромомера, или грануломера (интенсивно окрашенная часть), и гиаломера (прозрачная часть). Хромомер находится в центретромбоцита и содержит гранулы, остатки органелл (митохондрии, ЭПС), а также включения гликогена.
Гранулы делятся на четыре вида.
1. а-гранулы содержат фибриноген, фибропектин, ряд факторов свертывания крови, ростовые факторы, тромбоспондин (аналог актомиозинового комплекса, участвует в адгезии и агрегации тромбоцитов) и другие белки. Окрашиваются азуром, давая базофилию грануломера.
2. Второй тип гранул называется плотными тельцами, или 5-гранулами. Они содержат серотонин, гистамин (по-ступающие в тромбоциты из плазмы), АТФ, АДФ, кальцин, фосфор, АДФ вызывает агрегацию тромбоцитов при повреждении стенки сосуда и кровотечении. Серотонин стимулирует сокращение стенки поврежденного кровеносного сосуда, а также вначале активирует, а затем ингибирует агрегацию тромбоцитов.
3. λ-гранулы — типичные лизосомы. Их ферменты выбрасываются при ранении сосуда и разрушают остатки неразрешенных клеток для лучшего прикрепления тромба, а также участвуют в растворении последнего.
4. Микропероксисомы содержат пероксидазу. Их количество невелико.
Кроме гранул в тромбоците есть две системы канальцев: 1) канальцы, связанные с поверхностью клеток. Эти канальцы участвуют в экзоцитозе гранул и эндоцитозе. 2) система плотных трубочек. Образуется за счет деятельности комплекса Гольджи мегакариоцита.
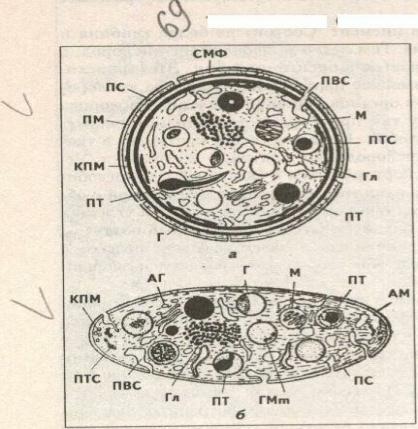
Рис. Схема ультраструктуры тромбоцита:
АГ — аппарат Гольджи, Г — А-гранулы, Гл — гликоген. ГМт — гранулярные микротрубочки, КПМ — кольцо периферических микротрубочек, ПМ — плазматическая мембрана, СМФ — субмембранные микрофиламенты, ПТС — плотная тубулярная система, ПТ — плотные тельца, ЛВС — поверхностная вакуолярная система, ПС — примембраммый слой кислых гликозаминогликанов. М — митохондрии (по Уайту).
