
- •Понятие о гомеостазе и гомеокинезе. Саморегуляторные принципы поддержания постоянства внутренней среды организма.
- •2. Основные формы регуляции физиологических функций. Взаимоотношение нервных и гуморальных механизмов регуляции.
- •2. Биологические мембраны, их строение и функциональные особенности.
- •Виды транспорта веществ через биологические мембраны.
- •2.2. Типы транспорта веществ через мембрану
- •3.Мембранный потенциал покоя. Современные представления о механизме его происхождения. Метод его регистрации.
- •4. Потенциал действия, его фазы. Современное представление о механизме его генерации.
- •Механизм возникновения
- •Механизм возникновения
- •Механизм возникновения
- •7. Законы раздражения. Закон силы. Закон «все или ничего» и его относительный характер.
- •8. Законы раздражения. Закон «силы времени». Понятие о реобазе и хронаксии. Хронаксиметрия и ее клиническое значение.
- •10.Законы раздражения. Закон градиента. Аккомодация, скорость аккомодации и ее мера. Закон градиента
- •9. Законы раздражения. Полярный закон. Физиологический электротон. Като-дическая депрессия.
- •Современное представление о механизме мышечного сокращения и расслабления.
- •2. Виды и режимы мышечного сокращения. Одиночное мышечное сокращение и его фазы. Сила и работа мышц. Правило средних нагрузок
- •Одиночное мышечное сокращение
- •Сила и работа мышц
- •Правило средних нагрузок
- •Виды тетануса, механизм возникновения различных видов тетануса:
- •Морфо-функциональные особенности гладких мышц.
- •Мионевральный синапс. Механизм передачи возбуждения в нем. Потенциал концевой пластинки.
- •Потенциал концевой пластинки
- •Классификация нервных волокон. Распространения возбуждения по безмиелиновым и миелиновым нервным волокнам. Характеристика их возбудимости и лабильности. Законы проведения возбуждения по нерву.
- •3. Учение п.К.Анохина о функциональных системах и саморегуляции
- •Узловые механизмы функциональной системы.
- •4. Строение, классификация и функциональные свойства синапсов. Морфо-функциональные особенности электрических и химических синапсов.
- •5. Возбуждающие синапсы, их медиаторы и рецепторы к ним. Особенности передачи возбуждения. Механизмы развития возбуждающего остсинаптического потенциала (впсп). Свойства синапсов.
- •Механизмы развития возбуждающего остсинаптического потенциала (впсп).
- •Свойства синапсов.
- •6. Тормозные синапсы и их медиаторы. Механизм развития тормозного постсинаптического потенциала (тпсп). Взаимодействие тормозных и возбуждающих синапсов.
- •7. Нервный центр. Анатомическое и физиологическое понятие нервного центра. Свойства нервных центров.
- •Основные свойства нервных центров
- •8. Торможение в цнс (и.М.Сеченов). Его роль. Виды торможения.
- •9. Первичное торможение. Его виды. Механизм возникновения
- •Структурно-функциональные особенности соматической и вегетативной нервной системы.
- •Отличия внс от соматической нервной системы
- •2. Вегетативная нервная система. Структурно – функциональные особенности.Синапсы, медиаторы и рецепторы внс.
- •Механизмы синаптической передачи в вегетативной нервной системе Постганглионарные или периферические синапсы
- •2.1. Симпатические синапсы
- •А) Медиатор симпатических синапсов — норадреналин
- •Б) Механизмы выделения норадреналина в синаптическую щель
- •В) Судьба выделившегося в синаптическую щель норадреналина
- •2.2. Парасимпатические синапсы а) Медиатор симпатических синапсов – ацетилхолина
- •Б) Механизм регуляции освобождения ацетилхолина в синаптическую щель
- •В) Судьба выделившегося в синаптическую щель ацетилхолина
- •Взаимосвязи симпатической и парасимпатической регуляции функций
- •2. Структурно – функциональная основа условного рефлекса. Современные представления о механизмах формирования временных связей.
- •4. Особенности внд человека. Учение и.П.Павлова о типах высшей нервной деятельности и о 1-й и 2-й сигнальных системах.
- •5. Эмоции, их генез, классификация и значение в целенаправленной деятельности человека. Эмоциональный стресс и его роль в формировании психосоматических заболеваний.
- •Традиционная "чикагская семерка" психосоматических заболеваний
- •6. Сон, его электрофизиологическая характеристика и значение для организма. Фазы сна. Теории сна.
- •2. Ответы на частную физиологию
- •1. Биоэнергетика организма. Методы определения энергетического обмена. Основной обмен и факторы, влияющие на его величину. Клиническое значение основного обмена.
- •1.Прямая калориметрия
- •2.Непрямая калориметрия
- •3. Исследование валового обмена
- •Для общего развития: теория обмена белков жиров и углеводов
- •Функции белков
- •Азотистый баланс
- •Регуляция белкового обмена
- •3. Температура тела человека. Температура кожных покровов и внутренних органов. Теплопродукция и теплоотдача и их механизмы. Изотермия и ее регуляция.
- •Физиология пищеварения
- •2. Пищеварение в желудке. Состав и свойства желудочного сока. Фазы отделения желудочного сока. Регуляция желудочной секреции. Приспособительный характер секреторной деятельности желудка.
- •Приспособительный характер желудочной секреции.
- •3. Пищеварение двенадцатиперстной кишке. Состав и свойства секрета поджелудочной железы. Регуляция панкреатической секреции. Пищеварение в тонкой кишке
- •Секреция поджелудочной железы
- •Фазы секреции поджелудочной железы.
- •4.Роль печени в пищеварении. Состав и свойства желчи. Регуляция образования желчи и выделения ее в двенадцатиперстную кишку.
- •5. Полостное и пристеночное пищеварение. Всасывание питательных веществ. Моторная деятельность тонкой кишки и ее регуляция.
- •Моторная деятельность тонкой кишки
- •Всасывание питательных веществ в тонкой кишке
- •6. Функциональные особенности нейрогуморальной регуляции пищеварения. Гормоны желудочно-кишечного тракта.
- •Физико-химические свойства крови
- •Регуляция постоянства осмотического давления крови.
- •2.Белки плазмы крови, их физиологическое значение. Онкотическое давление крови его роль. Скорость оседания эритроцитов, факторы, влияющие на ее величину. Клиническое значение соэ.
- •3. Эритроциты, строение, количество функций. Гемоглобин, количество, его виды, соединения и их физиологическое значение.
- •4. Лейкоциты, строение, количество, виды, функции. Лейкоцитарная формула и
- •Сдвиг лейкоцитарной формулы влево
- •Сдвиг лейкоцитарной формулы вправо
- •Функции тромбоцитов.
- •Взаимодействие свертывающей и противосвертывающей систем крови.
- •Фибринолиз
- •6. Группы крови. Система ав0. Определение группы крови у человека. Правила переливания крови.
- •Определение группы крови
- •2.Определение группы крови двойной реакцией (по стандартным сывороткам и стандартным эритроцитам) (перекрестный способ)
- •Правила переливания крови. Значение групповой принадлежности при гемотрансфузии
- •Правило Оттенберга
- •Особенность совместимости по резус-фактору
- •Переливание резус-несовместимой крови
- •Современные правила переливания крови
- •7. Резус-фактор. Учет резус-принадлежности крови в клинике. Резус-конфликт между матерью и плодом
- •2. Современные представления о структуре и локализации дыхательного центра. Автоматия дыхательного центра.
- •3. Газообмен в легких и тканях. Основные закономерности перехода газов че-
- •4Транспорт газов кровью. Кривая диссоциации оксигемоглобина, ее характе-
- •Транспорт газов кровью
- •Кислородная емкость крови.
- •5. Рефлекторно-гуморальные механизмы регуляции дыхания. Механизм первого вдоха новорожденного.
- •6.Дыхание в условиях пониженного и повышенного барометрического давления.
- •2. Автоматия сердца. Анатомический субстрат и природа автоматии. Проводя-
- •Ведущая роль синусового узла в автоматии.
- •Анатомический субстрат и природа автоматии.
- •Градиент автоматии
- •Особенности рефрактерного периода сердечной мышцы.
- •5.Сердечный цикл и его фазы. Давление крови в полостях сердца в различные фазы кардиоцикла. Работа клапанного аппарата сердца.
- •Сосудистый тонус и его компоненты.
- •Происхождение сосудистого тонуса
- •Иннервация сосудов
- •9. Давление крови в различных отделах сосудистой системы. Артериальное давление и факторы, определяющие его величину.
- •10.Сосудодвигательный центр. Рефлекторная регуляция системного артериального давления. Значение сосудистых рефлексогенных зон.
- •Рефлекторная регуляция системного артериального давления.
- •Значение сосудистых рефлексогенных зон
- •Способы регистрации.
- •1. Учение и. П.Павлова об анализаторах. Структура и функции анализаторов. Механизм возникновения возбуждения в рецепторах. Рецепторный и генераторный потенциалы.
- •Nb!!!! Анализаторы при ответе описываем по схеме: ПереферическийПроводниковый- Корковый отделы
- •2. Физиология зрительного анализатора. Рецепторный аппарат. Фотохимические процессы в сетчатке глаза при действии света. Теории цветного зрения (м.Ломоносов, г.Гельмгольц, п.Лазарев).
- •3. Слуховой анализатор. Звукоулавливающий и звукопроводящий аппарат органа слуха. Электрофизиологическая характеристика рецепторного отдела. Теории восприятия звука (г.Гельмгольц, г.Бекеши).
- •1. Реобаза, хронаксия и их значение в клинической практике. Хронаксиметрия.
- •2.Рецепторы: понятия, классификация, основные свойства и особенности возбуждения.
- •3. Утомление. Утомление изолированной мышцы, нервно-мышечного препарата и нейро-моторной единицы в условиях целостного организма. Теории утомления.
- •4. Особенности умственного труда. Переутомление. Профилактика утомления. Активный и пассивный отдых.
- •5. Кожные и сухожильные рефлексы человека и их клиническое значение.
- •6. Чувствительные и двигательные нарушения при полном и частичном пересечении спинного мозга (спинальный шок, синдром Броун-Секара).
- •7. Электроэнцефалография. Ритмы ээг и их характеристика.
- •8. Сон, его физиологическое значение. Фазы сна, теории сна. Характеристика электроэнцефалограммы человека в условиях естественного сна и бодрствования.
- •9. Обмен белков. Белковый оптимум и минимум. Азотистый баланс, его виды. Белковое голодание.
- •10.Физиологические основы голода и насыщения.
- •12. Анализ типичных кривых желудочной секреции на хлеб, мясо и молоко.Приспособительный характер желудочной секреции к разным видам пищи.
- •13. Методы изучения секреторной и моторной функций желудка человека.Запальный (аппетитный) сок и его значение.
- •14 Обмен углеводов. Нормо-, гипо- и гипергликемия. Механизм поддержания постоянства уровня глюкозы в крови.
- •15. Эндокринная функция поджелудочной железы и роль ее в регуляции обмена веществ.
- •16. Эндокринная роль щитовидной железы и ее роль в обмене веществ.
- •17. Эндокринная функция надпочечников.
- •18.Эндокринная функция половых желез.
- •19. Гипоталамо- гипофизарная система и ее роль в регуляции функций организма.
- •20.Регуляция уровня кальция в крови. Роль щитовидной и паращитовидной желез.
- •21.Минутный объем дыхания, его определение. «Мертвое пространство» и вентиляция альвеол, эффективность ее в зависимости от частоты и глубины дыхания.
- •22. Давление в плевральной полости, изменение его в разные фазы дыхательного цикла и роль в механизме внешнего дыхания. Пневмоторакс.
- •23. Парциальное давление газов о2 и со2 в альвеолярном воздухе и напряжение их в крови. Газообмен в легких.
- •24. Физиологические основы искусственного дыхания. Действие смеси 96 % о2 и 4 % со2.
- •26. Дыхание в измененных условиях внешней среды. Горная (высотная) болезнь, водолазная и кессонная болезнь, их физиологические механизмы.
- •27. Функции дыхательных путей. Защитные дыхательные рефлексы. Роль ирритантных и юксткапиллярных рецепторов в регуляции дыхания.
- •28. Кислотно-щелочное равновесие крови и механизмы, обеспечивающие его постоянство.
- •29.Скорость оседания эритроцитов, факторы, влияющие на ее величину. Клиническое значение соэ.
- •30. Правила переливания крови.
- •31.Кровезамещающие растворы. Классификация и показания к использованию.
- •32.Физиологические основы иммунитета. Т- и в-лимфоциты.
- •33.Нервная и гуморальная регуляция гемопоэза. Понятие о гемопоэтинах.
- •34.Изменение возбудимости сердечной мышцы в различные фазы сердечного цикла. Экстрасистолия.
- •35. Биофизические основы электрокардиографии. Основные отведения экг. Клиническое значение.
- •36.Тоны сердца и их происхождение. Компоненты первого и второго тона. Фонокардиография.
- •37. Физиологические механизмы регуляции деятельности пересаженного сердца.
- •39. Физиологические основы гипертензии.
- •40. Особенности легочного кровоснабжения.
- •41. Особенности коронарного кровообращения.
- •42. Особенности мозгового кровообращения.
- •43.Особенности почечного кровотока. Роль гидростатического давления крови в ультрафильтрации.
- •44.Ренин-ангиотензин-альдостероновая система и ее роль в регуляции артериального давления.
- •45. Биологическое значение боли. Виды боли. Современные представления о болевой рецепции.
- •46 Физиологические основы обезболивания и наркоза.
9. Законы раздражения. Полярный закон. Физиологический электротон. Като-дическая депрессия.
Полярный закон раздражения (закон Пфлюгера)

При замыкании цепи постоянного электрического тока возбуждение возникает только под катодом, а при размыкании - только под анодом
Доказать правильность закона можно при помощи опыта, в котором меняется расположение катода и анода на поврежденном и неповрежденном участках нерва, иннервирующего мышцу
Прохождение постоянного электрического тока через мембрану вызывает изменение мембранного потенциала покоя.
Так, при замыкании цепи возле катода скапливается его "-" заряд, который уменьшает "+" заряд наружной поверхности мембраны.
Разность потенциалов (между наружной и внутренней поверхностями мембраны) уменьшается, и мембранный потенциал изменяется в сторону уровня критической деполяризации, т.е. формируется деполяризация(возбудимость повышается).
Достижение критического уровня приводит к возникновению пикового потенциала (потенциала действия)
При замыкании цепи возле анода скапливается его "+" заряд.
Он увеличивает "+" заряд мембраны и величину мембранного потенциала
Мембранный потенциал удаляется от критического уровня, превышает значение потенциала покоя и формируетгиперполяризацию (возбудимость уменьшается)
При размыкании цепи, прекращение поступления дополнительного "+" заряда от анода приводит к уменьшению(восстановлению) заряда наружной поверхности мембраны.
Мембранный потенциал, уменьшаясь, приближается к критическому уровню
Формируется деполяризация (возбудимость увеличивается).
После достижения критического значения развивается пиковый потенциал
(Поскольку размыкание происходит после замыкания, а, следовательно, на фоне гиперполяризации и пониженной возбудимости, то для возникновения ПД необходим раздражитель, превышающий по силе пороговый - это анодно-размыкательный эффект)
При размыкании возле катода прекращается накопление его "-" заряда
Заряд наружной поверхности мембраны увеличивается (восстанавливается), мембранный потенциал, увеличиваясь, удаляется от критического уровня и возбуждение не возникает
Закон физиологического электротона
Действие постоянного электрического тока на ткань сопровождается изменением ее возбудимости
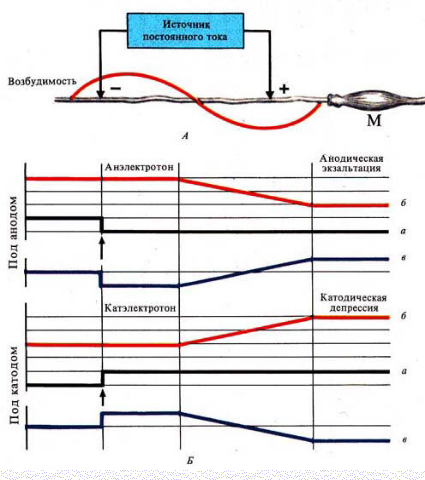

Различают 3 вида физиологического электротона или изменения возбудимости:
Катэлектротон - изменение возбудимости под катодом.
В момент замыкания под катодом формируется деполяризация и возбудимость повышается.
По мере удаления от катода количество его "-" зарядов, а следовательно и выраженность деполяризацииуменьшается.
В результате возбудимость уменьшается, но она остается выше, чем в состоянии покоя
Анэлектротон - изменение возбудимости под анодом.
В момент замыкания под анодом формируется гиперполяризация и возбудимость снижается.
По мере удаления от анода количество его "+" зарядов, а, следовательно, и гиперполяризация уменьшается.
В результате возбудимость увеличивается, но она остается ниже, чем в состоянии покоя
Периэлектротон - обратное изменение возбудимости вне электротонических областей.
В зоне прекращения действия катода возбудимость снижается.
В зоне прекращения влияний анода она, наоборот, увеличивается
При длительном прохождении постоянного тока через ткань происходит извращение измененной возбудимости
При длительном замыкании под катодом происходит:
·инактивация Na проницаемости
·повышение уровня критической деполяризации
·увеличение порога деполяризации
·снижение вначале повышенной возбудимости
Это явление получило название катодическая депрессия
При длительном замыкании под анодом происходит:
·снижение К проницаемости
·уровень критической деполяризации снижается
·порог деполяризации уменьшается
·повышается вначале сниженная возбудимость
Это явление получило название анодическая экзальтация
Этот закон необходимо учитывать в медицинской практике
С одной стороны, он может быть использован, если требуется заблокировать проведение возбуждения по нервной или мышечной ткани (катодическая депрессия) или повысить возбудимость (анодическая экзальтация)
С другой стороны, необходимо помнить о возможности привыкания к длительному действию раздражителей, в частности, фармацевтических препаратов, влияющих на возбудимость мембраны.
ФИЗИОЛОГИЯ МЫШЦ И НЕРВОВ
Структура миофибрилл и ее изменения при сокращении.Миофибриллы представляют собой сократительный аппарат мышечного волокна. В поперечнополосатых мышечных волокнахмиофибриллы-разделены на правильно чередующиеся участки (диски), обладающие разными оптическими свойствами. Одни участки анизотропны,т. е. обладают двойным лучепреломлением. В обыкновенном свете они ^выглядят темными, а. в поляризованномг— прозрачными в продольном направлении й непрозрачными в поперечном. Другие участки в Обыкновенной свете выглядят светлыми — они изотропны,т. е. не ; обладают двойным' лучепреломлением (рис. 34, а) . Анизотропные участки обозначают буквой А,изотропные — буквой I.В середине диска Аразличается светлая полоска Н, посередине диска / — темная "полоска -представляющая собой тонкую мембрану, сквозь поры которой проходят миофибриллы. Благодаря наличию этой опорной структуры параллельно расположенные однозначные диски отдельных фибрилл внутри одного волокна во время сокращения не смещаются по,отношению друг к другу.
Современные представления о структуре миофибриллярного аппарата основываются на исследованиях структуры мышечного волокна-при помощи электронной микроскопии, рентгеноструктурного анализа, фазово-контрастной и интерференционной микроскопии в сочетании с гистохимическими методами.
Установлено, что каждая миофибрилла мышечного волокна диаметром около 1 мкм состоит в среднем из 2500 протофибрилл,представляющих собой удлиненные полимери-, зованные молекулы белков миозина и актина; Миозиновые протофибриллы, или, как, их принято обозначать, нити, вдвое толще актиновых. Их диаметр,примерно 10 нм. В состоянии покоя мышечного волокна нити расположены в миофибрилле таким образом, ^что тонкие длинные актиновые нити входят своими концами в промежутки между толстыми и более короткими миозиновыми нитями (рис. 34, б). Благодаря этому диски / состоят только из актиновых нитей, а диски А — из нитей миозина, а, возможно, еще и другого белка.

![]()
Рис. 34. Структура миофибриллы (схема), Показаны диски А и 1-полоски Zи Н(а). Взаимное расположение толстых (миозиновых) и тонких ; (актиновых) нитей в расслабленной (б) й сокращённой (в) миофибрилле.
Светлая полоска Н представляет собой узкую зону, свободную от актиновых нйтей. Мембрана Z,проходя через середину диска /, скрепляет,между собой эти Нити. Важным компонентом ультрамикроскопической-структуры миофибрилл являются также многочисленные поперечные мостики, .соединяющие между собой миозиновые и актиновые нити. При сокращений мышечного волокна указанные нити не укорачиваются, а начинают «скользить» друг по другу: актиновые нити вдвигаются в промежутки между миозиновыми, в результате чего диски / укорачиваются, а диски/1 сохраняют свой размер. Почти исчезает светлая полоска //, так как актиновые нити при сокращении сближаются друг с другом своими концами (рис. 34, в). Причиной «скольжения» является химическое взаимодействие между актином и миозином в присутствии ионов Са2+и АТФ. Наблюдается своегородачхимическое «зубчатое колесо», как 6^,1 протягивающее одну Группу нитей по другой. Роль «зубчиков» в этом процессе приписывают поперечным мостикам, обеспечивающим взаимодействие активных центров белков миозиновых и актиновых нитей.
Молекула актина
Это глобулярный белок, состоящий из одного полипептида, который полимеризуется с другими молекулами актина и образует две цепи, обвивающие друг друга (рис. 4-4 А). Такая двойная спираль представляет собой остов тонкого филамента. На каждой молекуле актина есть участок связывания миозина. В покоящемся мышечном волокне взаимодействие между актином и миозином предотвращают два белка - тропонин и тропомиозин (рис. 4-4 Б).

Тропомиозин - стержневидная молекула из двух полипептидов, обвивающихся друг около друга; молекула соответствует в длину примерно семи мономерам актина. Цепи из молекул тропомиозина, уложенные конец в конец, располагаются вдоль всего тонкого филамента. Молекулы тропомиозина частично прикрывают участки связывания каждой молекулы актина, мешая контакту миозина с актином. В таком блокирующем положении молекула тропомиозина удерживается тропонином.
|
|
Тропонин - гетеротримерный белок. Он состоит из тропонина Т (отвечает за связывание с одиночной молекулой тропомиозина), тропонина С (связывает ион Са2+) и тропонина I (связывает актин и ингибирует сокращение). Каждая молекула тропомиозина связана с одной гетеротримерной молекулой тропонина, которая регулирует доступ к участкам связывания миозина на семи мономерах актина, прилегающих к молекуле тропомиозина.
Миозин
Это единое название большой семьи протеинов, имеющих определенные отличия в клетках разных тканей. Миозин присутствует у всех эукариотов. Около 60 лет назад было известно два типа миозина, которые сейчас называют миозин I и миозин II. Миозин II был первым из числа открытых миозинов, и именно он принимает участие в мышечном сокращении. Позднее были открыты миозин I и миозин V (рис. 4-4 В). В последнее время показано, что миозин II участвует в мышечном сокращении, тогда как миозин I и миозин V вовлечены в работу подмембранного (кортикального) цитоскелета. В настоящее время идентифицировано более 10 классов миозина. На рисунке 4-4 Г показано два варианта схемы строения миозина, который состоит из головки, шейки и хвоста. Молекула миозина состоит из двух больших полипептидов (тяжелых цепей) и четырех меньших (легких цепей). Эти полипептиды составляют молекулу с двумя глобулярными «головками», которые содержат оба вида цепей, и длинным стержнем («хвостом») из двух переплетенных тяжелых цепей. Хвост каждой молекулы миозина располагается вдоль оси толстого филамента, а две глобулярные головки выступают по бокам, их иначе называют поперечными мостиками. На каждой глобулярной головке находятся по два участка связывания: для актина и для АТФ. Участки связывания АТФ обладают также свойствами фермента АТФазы, гидролизующей связанную молекулу АТФ.
