
- •Список основных сокращений
- •Часть 1. Статическая биохимия тема 1. Строение, свойства, биологическая роль углеводов и липидов
- •1.1.1. Основные понятия биохимии
- •1.1.2. Основные разделы биохимии
- •1.1.3. Основные закономерности строения и метаболизма макромолекул в живых системах
- •1.1.4. Превращение энергии в живых клетках
- •1.1.5. Химические реакции в живых клетках
- •1.1.6. Строение, свойства, биологическая роль углеводов
- •1.1.6.1. Биологические функции углеводов
- •Слайд: Биологические функции углеводов
- •1.1.6.2. Моносахариды
- •Стереоизомерия моносахаридов
- •1.1.6.3. Олигосахариды
- •1.1.6.4. Полисахариды (гликаны)
- •1.1.7.1. Строение, свойства, биологическая роль липидов
- •1.1.7.2. Биологическая роль липидов
- •1.1.7.3. Нейтральные липиды (ацилглицеролы)
- •1.1.7.4. Жирные кислоты
- •1.1.7.5. Нейтральные диольные липиды
- •1.1.7.6. Нейтральные плазмалогены
- •1.1.7.11. Стероиды
- •1.1.7.12. Терпены
- •Тема 2. Строение, свойства, биологическая роль белков
- •2.1. Состав белков
- •2.2. Аминокислоты
- •2.3. Стереохимия аминокислот
- •2.4. Связи, стабилизирующие белковую молекулу
- •Пептидные связи
- •Часть молекулы полипептида Ионная связь
- •Дисульфидная связь
- •Водородная связь
- •2.5. Конформации белков
- •1.2.5.1. Первичная структура
- •1.2.5.2. Вторичная структура
- •1.2.5.3. Третичная структура
- •1.2.5.4. Четвертичная структура
- •1.2.5.5. Биологические функции белков
- •1.2.5.6. Классификация белков
- •1.2.5.7. Простые белки
- •1.2.5.8. Сложные белки
- •Тема 3. Строение, сворйства, биологическая роль нуклеотидов
- •1.3.1. Строение нуклеотидов. Компоненты нуклеотидов
- •1.3.2. Образование нуклеотида
- •1.3.3. Строение динуклеотидов и полинуклеотидов
- •Фрагмент полинуклеотида
- •1.3.3.1. Структура днк
- •1.3.3.2. Структура рнк
- •Тема 4. Витамины, ферменты
- •1.4.1. Витамины
- •1.4.1.2. Водорастворимые витамины витамин в1 (тиамин)
- •Витамин в2 (рибофлавин)
- •Витамин рр (в5) (никотинамид)
- •Витамин в6 (пиридоксин)
- •Витамин р (витамин проницаемости)
- •Витамин в12 (антианемический витамин, кобаламин)
- •Витамин с
- •Пантотеновая кислота (витамин в3)
- •Пара-аминобензойная кислота
- •Фолиевая кислота (витамин Вс)
- •1.4.1.2. Жирорастворимые витамины витамин а (ретинол)
- •Витамин d (антирахитический витамин)
- •Витамин е (витамин размножения, токоферол)
- •Витамин к (антигеморрагический витамин)
- •1.4.2. Ферменты
- •1.4.2.1. Химическая кинетика
- •1.4.2.2. Кинетика ферментативных реакций
- •1.4.2.3. Структура ферментов
- •1.4.2.4. Регуляция активности ферментов
- •1.4.2.5. Классификация ферментов
- •1. Оксидоредуктазы (окислительно-восстановительные реакции)
- •2. Трансферазы (перенос функциональных групп)
- •3. Гидролазы (реакции гидролиза)
- •1.5.1. Механизм действия гормонов
- •1.5.2. Гормоны гипоталамуса
- •Гормоны гипофиза
- •1.5.3. Гормоны поджелудочной железы
- •1.5.4. Гормоны щитовидной железы
- •1.5.5. Гормоны коры надпочечников
- •1.5.6. Гормоны мозгового вещества надпочечников
- •1.5.7. Гормоны половых желез
- •1.5.8. Гормоны паращитовидной железы
- •1.5.9. Гормоны тимуса (вилочковая железа)
- •Часть 2. Динамическая биохимия
- •Тема 6. Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата
- •2.6.1. Метаболические пути и обмен энергии
- •А → б → в → г → д, где а - исходное вещество (предшественник), б, в, г – интермедиаты, д – конечный продукт.
- •2.6.2. Обмен углеводов
- •2.6.2.1. Переваривание углеводов
- •2.6.2.2. Всасывание моносахаридов
- •2.6.2.3. Транспорт углеводов в клетки
- •2.6.3. Гликолиз
- •Аденозинтрифосфорная кислота
- •Брожение и дыхание
- •Стадии гликолиза
- •Ферментативные реакции первой стадии гликолиза
- •1. Фосфорилирование d-глюкозы за счет атф
- •Полный баланс гликолиза
- •2.6.4. Гликогенолиз
- •Тема 7. Аэробный метаболизм углеводов
- •2.7.1. Энергетика брожения и дыхания
- •2.7.2. Общая схема дыхания
- •2.7.3. Окисление пирувата до ацетил-КоА
- •2.7.4. Цикл трикарбоновых кислот (цикл Кребса)
- •Цитрат-синтаза
- •Аконитазное равновесие
- •Изоцитратадегидрогеназа
- •Окисление -кетоглутарата до сукцината
- •Сукцинатдегидрогеназа
- •Фумараза
- •Окисление малата до оксалоацетата
- •Баланс одного оборота цикла Кребса
- •2.7.5. Перенос электронов и окислительное фосфорилирование
- •2.7.6. Путь переноса электронов – дыхательная цепь
- •Баланс энергии
- •2.7.7. Хемиосмотическая гипотеза Митчелла
- •Тема 8. Липидный обмен
- •2.8.1. Превращение липидов в процессе пищеварения
- •2.8.2. Всасывание продуктов переваривания липидов и ресинтез липидов в кишечной стенке
- •2.8.3. Внутриклеточные процессов расщепления и синтеза липидов различных классов
- •2.8.4. Обмен триглицеридов и холестерина в тканях
- •2.8.5. Интеграция и регуляция метаболизма липидов
- •2.8.6. Нарушение обмена липидов при ожирении
- •Тема 9. Белковый обмен
- •2.9.1. Общие представления об обмене белков
- •2.9.2. Пищеварение белков
- •2.9.3. Синтез белков
- •2.9.4. Внутриклеточный распад белков
- •2.9.5. Пути выведения аммиака из организма
- •Тема 10. Интеграция клеточного обмена
- •2.10.1. Взаимосвязь процессов обмена углеводов, липидов, белков
- •2.10.2. Внутриклеточная регуляция обмена веществ
- •2.10.3. Нервная и гормональная регуляция обмена веществ
- •Часть 3. Спортивная биохимия тема 11. Биохимия мышечного сокращения
- •3.11.1. Типы мышечных волокон
- •3.11.2. Ультраструктура мышечного волокна
- •Тема 12. Энергетическое обеспечение мышечной деятельности
- •3.12.1. Креатинфосфокиназный механизм ресинтеза атф
- •3.12.2. Гликолитический механизм ресинтеза атф
- •3.12.3. Миокиназный механизм ресинтеза атф
- •3.12.4. Аэробный механизм ресинтеза атф
- •3.12.5. Соотношение анаэробных и аэробных механизмов ресинтеза атф при мышечной нагрузке
- •3.12.6. Биохимические факторы спортивной работоспособности
- •Тема 13. Биохимические изменения в организме при работе различного характера. Биохимические изменения при утомлении.
- •3.13.1. Общие изменения в организме при физической нагрузке
- •3.13.2. Биохимические изменения в мышцах при физической нагрузке
- •3.13.3. Систематизация упражнений по характеру биохимических изменений при физической работе
- •3.13.4. Биохимические изменения при утомлении
- •Тема 14. Биохимические превращения в период восстановления после мышечной работы
- •3.14.1. Срочное и отставленное восстановление
- •Тема 15. Закономерности биохимической адаптации под влиянием систематической тренировки
- •Сверхотягощение
- •Специфичность
- •3.15.3. Принцип обратимости действия
- •3.15.4. Принцип положительного взаимодействия
- •3.15.5. Принцип цикличности
- •Тема 16. Биохимический контроль при занятиях физической культурой
- •3.16.1. Биохимический контроль развития систем энергообеспечения организма и уровнем тренированности, утомления и восстановления организма
- •3.16.2. Контроль за применением допинга в спорте
- •Тема 17. Биохимические основы силы, быстроты и выносливости
- •3.17.1. Морфологические и биохимические основы скоростно-силовых качеств
- •3.17.2. Биохимические основы методов скоростно-силовой подготовки спортсменов
- •3.17.3. Биохимические основы выносливости
- •3.17.4. Методы тренировки, способствующие развитию выносливости
- •Тема 18. Биохимическое обоснование методики занятий физической культурой и спортом с лицами разного возраста. Биохимические основы рационального питания при занятиях физической культурой.
- •3.18.1. Биохимическое обоснование методики занятий физической культурой и спортом с лицами разного возраста
- •3.18.2. Биохимические основы рационального питания спортсменов
3.11.2. Ультраструктура мышечного волокна
Мышечное волокно является структурной единицей скелетных мышц, представляя собой большую многоядерную клетку, а точнее – бесклеточное образование – симпласт, так как в процессе развития мышечная клетка образуется путем слияния множества эмбриональных отдельных клеток – миобластов (рис.18). Клетка окружена плазматической мембраной – сарколеммой, которая покрыта сетью коллагеновых волокон, придающим ей прочность и эластичность. Длина отдельных мышечных клеток может достигать 10 см (портняжная мышца) и даже 50 см, толщина до 0,1 мм. К мышечному волокну подходят окончания двигательных нервов и множество кровеносных сосудов.
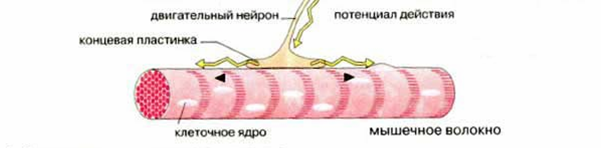
Рис.18. Мышечное волокно, иннервируемое мотонейроном
Двигательный нерв (мотонейрон) имеет разветвленные аксоны и может иннервировать несколько мышечных волокон, которые вместе представляют функциональную единицу мышцы (нейромоторная или двигательная единица). Такая единица работает как единое целое, т.е. сокращаются все входящие в нее мышечные волокна. Отдельная мышца состоит из многих двигательных единиц, которые могут не одновременно подключаться к мышечному сокращению. Сила и скорость сокращения мышцы зависит от количества участвующих в сокращении двигательных единиц, а также от частоты нервных импульсов.
Мышечные клетки не способны к делению, поэтому разрушенные мышечные волокна не могут восстановиться простым удвоением. В случае повреждения, что наблюдается при напряженной мышечной деятельности, самовозобновление мышечного волокна происходит из маленькой клетки – сателлита, которая находится в неактивном состоянии в тесном контакте со зрелыми мышечными волокнами. При нарушении структуры мышечного волокна она активируется и начинает пролиферировать, что приводит к образованию нового мышечного волокна.
Для высокоэффективного преобразования энергии АТФ в механическую работу мышцы должны обладать строго упорядоченной структурой. Действительно, упаковка сократительных белков в мышце сравнима с упаковкой атомов и молекул в составе кристалла.
Веретенообразная мышца состоит из пучков мышечных волокон. Зрелое мышечное волокно практически полностью заполнено миофибриллами - цилиндрическими образованиями, сформированными из системы перекрывающихся толстых и тонких нитей, образованных сократительными белками. В миофибриллах скелетных мышц наблюдается правильное чередование более светлых и более темных участков. Поэтому часто скелетные мышцы называют поперечнополосатыми. Скелетные мышцы состоят из многоядерных клеток, связанных возбудимой плазматической мембраной, по которой приходит нервный импульс, инициирующий сокращение мышцы. Мышечные клетки состоят из множества сократительных волокон – миофибрилл, расположенных параллельно друг другу.
Саркоплазматический ретикулум – это внутриклеточная мембранная система взаимосвязанных уплощенных пузырьков и канальцев (цистерн), которая окружает саркомеры миофибрилл (рис.19). На внутренней его мембране расположены белки, способные связывать ионы кальция (кальсеквестрин). Основная функция СР заключается в регуляции содержания ионов кальция в пространстве между актином и миозином, уровень которого изменяется при сокращении-расслаблении от 10-5 до 10-7 М. Под воздействием нервного импульса СР выбрасывает ионы кальция. Основные пути поступления Са2+ в клетки из окружающей среды или его освобождения из внутриклеточных источников достаточно универсальны, поэтому исследование молекулярных механизмов, обеспечивающих Са-зависимую регуляцию сократительной активности мышц разных типов, всегда вызывало повышенный интерес.
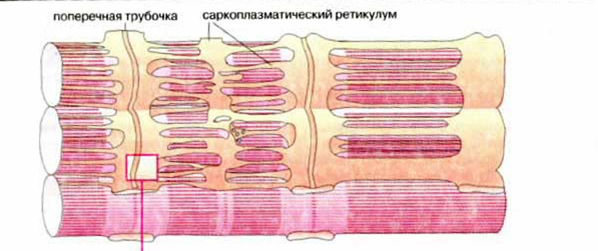
Рис.19. Саркоплазматический ретикулум
Мышечное сокращение становится возможным потому, что из СР через Са-каналы за короткое время (несколько микросекунд) выбрасывается большое количество Са2+ (градиент концентрации Са2+ на мембране СР составляет ~104), достаточное для взаимодействия с регуляторными Са-связывающими белками и активации сократительного аппарата. Благодаря хорошему развитию сети мембран СР и высокому содержанию в них белка Са-АТФазы (до 80% всех белков в продолговатых трубочках СР) весь освободившийся Са2+ также очень быстро (за 1-2 миллисекунды) полностью удаляется из цитоплазмы.
Таким образом, мембраны СР - основного депо кальция в мышечных клетках содержат оба компонента, которые необходимы для освобождения этого катиона и его последующей реаккумуляции: Са-каналы (RyR) и Са-АТФазу. Са-АТФаза активируется тем кальцием, который освобождается из ретикулума через Са-каналы и взаимодействует с регуляторными Са-связывающими белками (тропонин С, кальмодулин).
На мембране СР расположены также рибосомы, на которых происходит биосинтез белков. Митохондрии располагаются вдоль миофибрилл, тесно соприкасаясь с ретикулумом. При тренировке количество митохондрий увеличивается.
Структура миофибриллы. Структурно-функциональными единицами миофибрилл являются саркомеры, которые располагаются вдоль мышечных волокон через каждые 2,3 мкм (рис.20). На электронно-микроскопических снимках продольного среза мышечной ткани видно, что саркомер состоит из параллельных рядов толстых и тонких нитей. Вертикальные темные линии Z соответствуют специальным структурным белкам, разделяющим миофибриллы на саркомеры. Между ними видны горизонтальные нити сократительного аппарата. От Z-линий отходят тонкие нити, которым на электронно-микроскопических снимках соответствуют светлые полосы I. В центральной части саркомера расположены толстые нити, которым соответствуют темные полосы А. В середине каждой полосы А видна более светлая полоса Н. Наличие двух темных участков полосы А определяется тем, что в этих зонах толстые нити пересекаются тонкими нитями. Более светлая полоса (зона Н) соответствует участку саркомера, где толстые нити не пересекаются с тонкими нитями.
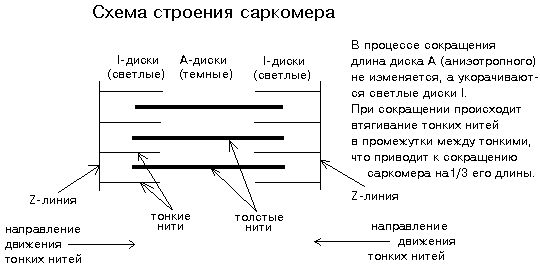
Рис.20. Схема саркомера
Толстые нити, имеющие диаметр 15 нм, состоят главным образом из молекул миозина. Тонкие нити имеют диаметр 9 нм. Они содержат белки трех типов: актин, тропомиозин и тропониновый комплекс. Каждая тонкая нить окружена тремя толстыми нитями, а каждая толстая нить окружена шестью тонкими нитями. Толстые и тонкие нити взаимодействуют друг с другом с помощью поперечных мостиков длиной около 13 нм, которые через регулярные промежутки выходят из толстых нитей и заполняют щели между соседними толстыми и тонкими нитями. При сокращении мышцы ее длина укорачивается на одну треть. Как это происходит стало понятно в начале 1950-х гг., когда Эндрю и Хью Хаксли, Р.Нидергерк и Ж.Хэнсон, исследовавшие мышечные волокна методами рентгеноструктурного анализа, оптической и электронной микроскопии, независимо пришли к модели скользящих нитей.
В основе модели скользящих нитей лежат следующие факты:
– при сокращении мышцы длины толстых и тонких нитей саркомера не изменяются; – саркомер укорачивается за счет перекрывания толстых и тонких нитей, которые скользят друг относительно друга во время сокращения мышцы; это проявляется в том, что при сокращении мышцы полосы Н и I укорачиваются;
– сила, развиваемая мышцей, создается в процессе движения соседних нитей.
Скольжение толстых и тонких нитей друг относительно друга совершается за счет энергии, выделяемой при гидролизе ATФ до AДФ и неорганического фосфата (рис.21).
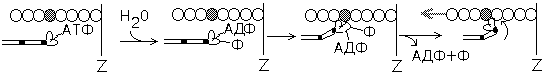
Рис.21. Механизм скольжения актиновых нитей относительно миозиновых за счет работы миозиновой АТФазы
Главной "моторной" частью миозина скелетных мышц является головка тяжелой цепи миозина вместе со связанной с ней легкими цепями миозина. Головки миозина могут дотягиваться до нитей актина и контактировать с ними. При замыкании таких контактов образуются поперечные мостики, которые генерируют тянущее усилие и обеспечивают скольжение нитей актина относительно миозина.
