
- •Электрохимические методы анализа
- •Теоретические основы электрохимичесих методов анализа
- •Электрохимические системы
- •Типы электродов, используемых в электрохимических методах анализа
- •Классификация обратимых электродов
- •Потенциометрия
- •Основы метода
- •Типы электродов
- •Потенциометрические измерения
- •Кривые титрования.
- •Способы нахождения конечной точки титрования
- •Вольтамперометрия
- •Явления на электродах электрохимической ячейки при прохождении постоянного электрического тока
- •Электродная поляризация
- •Основы метода
- •I пред. Дифф
- •Градуировка оборудования
- •Амперометрическое титрование
- •Кулонометрия
- •Теоретические основы метода. Электролиз
- •Кулонометрический анализ
- •Кулонометрическое титрование.
- •Кондуктометрия
- •Электрическая проводимость растворов электролитов.
- •Прямой кондуктометрический анализ и кондуктометрическое титрование
-
Прямой кондуктометрический анализ и кондуктометрическое титрование
Кондуктометрия - аналитический метод, основанный на измерении электрической проводимости G (величины, обратной электрическому сопротивлению R) электрохимической ячейки, состоящей из анализируемого раствора и помещенных в него двух одинаковых инертных электродов с достаточно большой площадью. Электропроводность ячейки зависит от ее геометрии, определяемой площадью и формой электродов, расстоянием между электродами и их относительным расположением, а также от электропроводности раствора электролита. Для того, чтобы исключить геометрический фактор из кондуктометрических измерений, по экспериментальным данным рассчитывают значения удельной и эквивалентной (или молярной) проводимости электролитов.
Кондуктометрический анализ обычно проводят при использовании переменного тока. В зависимости от того, какой аналитический сигнал используется при проведении анализа, различают собственно кондуктометрию, низкочастотную кондуктометрию и высокочастотную кондуктометрию (различное сопротивление проходящему через раствор току).
Кондуктометрия широко применяется в лабораторной практике, хотя и является неселективным методом анализа, так как все виды ионов, находящихся в растворе, вносят свой вклад в проводимость раствора. Поэтому прямой кондуктометрический анализ обычно используется для определения концентрации растворов бинарных электролитов или для определения общей ионной силы раствора (например, степень минерализации природных вод, загрязненность сточных вод, контроль качества воды после ее очистки).
Более широко распространено кондуктометрическое титрование, при котором точка эквивалентности определяется по излому кривой зависимости электрической проводимости титруемого раствора от количества титрующего раствора. При кондуктометрическом титровании могут быть использованы химические реакции всех типов: осаждения, комплексообразования, окислительно-восстановительные, кислотно-основного взаимодействия.
G



V
Vэкв
Рис. Кривые кондуктометрического титрования
Резкое изменение электрической проводимости происходит тогда, когда в процессе титрования происходит изменение состава раствора и подвижности электроактивных ионов, образуются малодиссоциирующие или труднорастворимые соединения.
Пример. H+ + Cl- + Na+ + OH- = H2O + Na+ + Cl-.
До точки эквивалентности электрическая проводимость раствора обеспечивается ионами H+, Cl- и Na+. Ионы H+ обладают наиболее высокой подвижностью, но в процессе титрования их число уменьшается и проводимость раствора уменьшается. После точки эквивалентности электрическая проводимость раствора определяется ионами Na+ + Cl- и наиболее подвижными OH-. С увеличением концентрации щелочи проводимость раствора возрастает. Минимум электрической проводимости соответствует точке эквивалентности.
Кондуктометрическое титрование - удобный метод анализа окрашенных и мутных растворов, а также растворов, содержащих вещества, реагирующие с применяющимися в обычном химическом анализе индикаторами. Метод может быть использован в установках автоматического титрования.
Промышленно выпускаемое оборудование: Карманные кондуктометры для оперативного контроля количества растворенных в воде солей DIST (десять модификаций), экспресс-анализа водных растворов ТЕСТЕР-Солемер. Многодиапазонные портативные кондуктометры HI 8633, HI 8733, HI 8733, HI 9033 (для работы в полевых условиях - в защитном исполнении), микропроцессорные измерители проводимости HI 9032 с внесенными в память программами измерений, измеритель окислительно-восстановительного потенциала в промышленных сточных водах ORP, измерители растворенного кислорода и т.п.
Более простая версия изложенного выше материала
Потенциал. Электрический потенциал - работа по перемещению единичного положительного заряда из данной точки пространства в бесконечность. Каждый электрод обладает каким-то электрическим потенциалом. Абсолютное значение потенциала электрода определить нельзя. Можно лишь сравнивать потенциалы различных электродов друг с другом. Для этого надо два электрода (полуэлемента) объединить в электрохимическую цепь. Для этого металлические части соединяются проводником, а растворы электролитов, в которые они погружены - стеклянной трубкой с раствором электролита (хлорида калия). Чтобы раствор не выливался, концы трубки закрывают пористыми ватными жгутами. Эту трубку называют электролитическим ключом или солевым мостиком. Она обеспечивает ионную проводимость между полуэлементами. Таким образом возникает замкнутая цепь или гальванический элемент (ГЭ). Пример такого ГЭ показан на рис. 1. Разность электрических потенциалов двух электродов в такой цепи при отсутствии тока называют электродвижущей силой цепи ЭДС Е.
Значение ЭДС может быть измерено, что позволяет сравнивать потенциалы электродов друг с другом. Обычно потенциалы отдельных электродов измеряют относительно потенциала стандартного водородного электрода. Его потенциал условно принимают равным нулю.
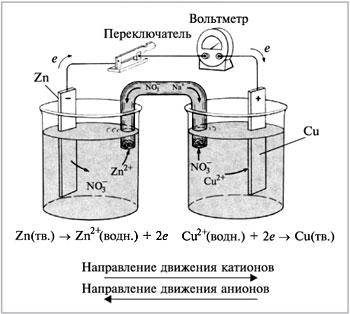
Рис. 1. Электрохимическая цепь или гальванический элемент, составленный из цинкового из медного полуэлементов.

Рис. 2. Электрохимическая цепь (ГЭ) со стандартным водородным электродом: 2 –стандартный водородный электрод, 1 - исследуемый электрод, в центре – один из видов электролитического ключа.
Таким образом, электродным потенциалом
называют ЭДС Е электрохимической
цепи -гальванического элемента,
составленного из исследуемого электрода
и стандартного водородного электрода.
Такая цепь изображена на рис. 2. Электродный
потенциал обычно обозначают буквой
![]() .
Е =
.
Е =
![]() исследуемый
электрод -
исследуемый
электрод -
![]() стандартный
водородный электрод ,
стандартный
водородный электрод ,
![]() стандартный
водородный электрод = 0 В
стандартный
водородный электрод = 0 В
![]() исследуемый
электрод = Е
Электрод, относительно
которого измеряется потенциал, называется
электродом сравнения. Кроме
водородного, в качестве электродов
сравнения используют хлорсеребряный,
каломельный и некоторые другие. Во всех
случаях потенциал электрода сравнения
принимается равным нулю. Можно перейти
от одной шкалы потенциалов к другой.
Например стандартный равновесный
потенциал цинкового электрода по
водородной шкале равен - 0,76 В, а потенциал
хлорсеребряного электрода + 0,22 В (по той
же шкале). Следовательно, потенциал
цинкового электрода по шкале хлорсеребряного
электрода будет равен: - 0,76 - (+ 0,22) = - 0,98
В.
исследуемый
электрод = Е
Электрод, относительно
которого измеряется потенциал, называется
электродом сравнения. Кроме
водородного, в качестве электродов
сравнения используют хлорсеребряный,
каломельный и некоторые другие. Во всех
случаях потенциал электрода сравнения
принимается равным нулю. Можно перейти
от одной шкалы потенциалов к другой.
Например стандартный равновесный
потенциал цинкового электрода по
водородной шкале равен - 0,76 В, а потенциал
хлорсеребряного электрода + 0,22 В (по той
же шкале). Следовательно, потенциал
цинкового электрода по шкале хлорсеребряного
электрода будет равен: - 0,76 - (+ 0,22) = - 0,98
В.
Zn2+/Zn H+/H2 AgCI/Ag
_______│____________│______│____________
-0.76 0 +0.22 В
Измерение электродных потенциалов
Точно измерить электродный потенциал
достаточно трудно, так как необходимо,
чтобы в процессе измерения не нарушалось
равновесие на электродах (отсутствовал
ток в цепи). По этой причине невозможно
получить точное значение Е с помощью
обычного вольтметра: если мы замкнем
цепь, используя вместо проводника
вольтметр, то в ней начнет протекать
довольно большой ток, который нарушит
равновесие на электродах. Поэтому для
измерения используют специальные
вольтметры с высоким входным сопротивлением
(более 1000 Ом). При включении в цепь такого
прибора протекающий ток окажется слишком
малым для оказания существенного влияние
на электродное равновесие.
Стандартный равновесный электродный
потенциал - это потенциал электрода при
стандартных условиях (активности
потенциалопределяющих ионов равны
нулю, температура раствров 25оС,
давление участвующих в полуреакции
газообразных веществ равно 1 атм.),
его обозначают символом
![]() °.
Эти потенциалы определены для многих
окислительно-восстановительных систем
и приводятся в справочниках. Если
электроды (например, металлические
электроды 1-го рода) расположить в порядке
возрастания потенциала, то мы получим
таблицу, называемую рядом стандартных
равновесных электродных потенциалов.
Этот ряд часто называют также
электрохимическим рядом напряжений,
однако этот термин устарел и его
постепенно перестают использовать.
°.
Эти потенциалы определены для многих
окислительно-восстановительных систем
и приводятся в справочниках. Если
электроды (например, металлические
электроды 1-го рода) расположить в порядке
возрастания потенциала, то мы получим
таблицу, называемую рядом стандартных
равновесных электродных потенциалов.
Этот ряд часто называют также
электрохимическим рядом напряжений,
однако этот термин устарел и его
постепенно перестают использовать.

При помощи ряда стандартных равновесных электродных потенциалов можно характеризовать некоторые химические свойства металлов. Например, его применяют для выяснения, в какой последовательности восстанавливаются ионы металлов при электролизе. Чем меньше алгебраическая величина потенциала (например, -0.76 < +0.22), тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов. Как следует из вышеприведенного ряда, металлический литий - самый сильный восстановитель, а золото - самый слабый. И наоборот, ион золота Аu3+- самый сильный окислитель, а ион лития Li+ - самый слабый. Каждый металл М1 в ряду стандартных электродных потенциалов обладает способностью вытеснять все следующие за ним металлы М2 из растворов их солей:
nM1 + mM2n+ = nM1m+ + mM2
Однако это не означает, что на практике вытеснение обязательно происходит во всех случаях. Например, алюминий вытесняет медь из раствора хлорида меди (II) СuСl2, но практически не вытесняет ее из раствора сульфата меди (II) CuS04. Это объясняется тем, что хлорид-ион Сl- быстро разрушает защитную оксидную пленку AI2O3 на поверхности алюминии, а сульфат-ион SO42- ее практически не разрушает. Все металлы, имеющие отрицательные значения стандартных равновесных электродных потенциалов, т.е. стоящие в ряду до водорода, вытесняют водород из разбавленных кислот, анионы которых не проявляют окислительных свойств (например, из НСl или разбавленной H2S04) и растворяются в них. Однако есть и исключения. Например, свинец практически не растворяется в серной кислоте. Это обусловлено образованием на поверхности металла защитной пленки из образующегося слаборастворимого сульфата свинца PbS04, который затрудняет контакт металла с раствором кислоты. Поэтому можно сделать вывод, что пользоваться рядом стандартных электродных потенциалов следует с учетом всех особенностей рассматриваемых процессов.
Электрохимические методы анализа
Классификация электрохимических методов анализа
Электрохимические методы основаны на измерении электрических параметров электрохимических явлений, возникающих в исследуемом растворе. Такое измерение осуществляют с помощью электрохимической ячейки, представляющей собой сосуд с исследуемым раствором, в который помещены электроды. Электрохимические процессы в растворе сопровождаются появлением или изменением разности потенциалов между электродами, или изменение величины тока, проходящего через раствор.
Электрохимические методы классифицируют в зависимости от типа явлений, замеряемых в процессе анализа. В общем случае различают две группы электрохимических методов:
- Методы без наложения постороннего потенциала, основанные на измерении разности потенциалов, которая возникает в электрохимической ячейке, состоящей из электрода и сосуда с исследуемым раствором. Эту группу методов называют потенциометрическими. В потенциометрических методах используют зависимость равновесного потенциала электродов от концентрации ионов, участвующих в электрохимической реакции на электроде.
- Методы с наложением постороннего потенциала, основанные на измерении: а) электрической проводимости растворов – кондуктометрия; б) количества электричества, прошедшего через раствор – кулонометрия; в) зависимости величины тока от приложенного потенциала – вольт-амперометрия; г) времени, необходимого для прохождения электрохимической реакции – хроноэлектрохимические методы (хроновольтамперометрия, хронокондуктометрия). В методах этой группы на электроды электрохимической ячейки налагают посторонний потенциал.
Основным элементом приборов для электрохимического анализа является электрохимическая ячейка. В методах без наложения постороннего потенциала она представляет собой гальванический элемент, в котором вследствие протекания химических окислительно-восстановительных реакций возникает электрический ток. В ячейке типа гальванического элемента в контакте с анализируемым раствором находятся два электрода – индикаторный электрод, потенциал которого зависит от концентрации анализируемого вещества, и электрод с постоянным потенциалом – электрод сравнения, относительно которого измеряют потенциал индикаторного электрода. Измерение разности потенциалов производят специальными приборами – потенциометрами.
В методах с наложением постороннего потенциала применяют электрохимическую ячейку, на электродах которой под действием наложенного потенциала происходит электролиз – окисление или восстановление вещества. В кондуктометрическом анализе используют кондуктометрическую ячейку, в которой замеряют электрическую проводимость раствора.
По способу применения электрохимические методы можно подразделять на прямые, в которых концентрацию веществ измеряют по показанию прибора, и электрохимическое титрование, где точку эквивалентности фиксируют с помощью электрохимических измерений. В соответствии с этой классификацией различают потенциометрию и потенциометрическое титрование, кондуктометрию и кондуктометрическое титрование и т.д.
Приборы для электрохимических определений кроме электрохимической ячейки, мешалки, нагрузочного электрического сопротивления включают также устройства для измерения разности потенциалов, тока, электрического сопротивления раствора, количества электричества. Эти измерения могут осуществляться стрелочными приборами (вольтметр или микроамперметр), осциллографами, автоматическими самопишущими потенциометрами. Если электрический сигнал от ячейки очень слабый, то его усиливают с помощью радиотехнических усилителей. В приборах методов с наложением постороннего потенциала важной частью являются устройства для подачи на ячейку контролируемого потенциала, стабилизированного постоянного или переменного тока (зависит от типа метода). Блок электропитания приборов электрохимического анализа включает обычно выпрямитель и стабилизатор напряжения, который обеспечивает постоянство работы прибора.
Потенциометрия
Потенциометрия основана на измерении разности электрических потенциалов, возникающих между разнородными электродами, опущенными в раствор с определяемым веществом. Электрический потенциал возникает на электродах при прохождении на них окислительно-восстановительной (электрохимической) реакции. Окислительно-восстановительные реакции протекают между окислителем и восстановителем с образованием окислительно-восстановительных пар, потенциал φ которых определяется по уравнению Нернста активностями компонентов пар а(Ox) и а(Red):
![]()
Потенциометрические измерения проводят, опуская в раствор два электрода – индикаторный, реагирующий на концентрацию определяемых ионов, и стандартный электрод или электрод сравнения, относительно которого измеряется потенциал индикаторного. Применяют несколько видов индикаторных и стандартных электродов.
- Электроды первого рода обратимы относительно ионов Mn+ металла M, из которого состоит электрод. При опускании такого электрода в раствор, содержащий катионы металла, образуется электродная пара Mn+/M .
- Электроды второго рода чувствительны к анионам и представляют собой металл М, покрытый слоем слаборастворимой его соли МА с анионом A-, к которому чувствителен электрод. При контакте такого электрода с раствором, содержащим указанный анион A-, возникает потенциал φ, величина которого зависит от произведения растворимости ПР(МА) соли МА и концентрации аниона [А-] в растворе.
Электродами второго рода являются, например, хлорсеребряный и каломельный. Насыщенные (слаборастворимой солью МА) хлорсеребряный и каломельный электроды поддерживают постоянный потенциал и применяются в качестве электродов сравнения, по отношению к которым измеряется потенциал индикаторного электрода.
Инертные электроды – пластина или проволока из трудноокисляемых металлов – платины, золота, палладия. Применяются они для измерения φ в растворах, содержащих окислительно-восстановительную пару (например, пару Fe3+/Fe2+).
Мембранные электроды различного типа имеют мембрану, на которой возникает мембранный потенциал φ. Величина φ зависит от разности концентраций одного и того же иона по разным сторонам мембраны. Простейшим и наиболее часто употребляемым мембранным электродом является стеклянный электрод.
Смешивание слаборастворимых солей типа AgBr, AgCl, AgI и других с каучуками и некоторыми пластмассами (полиэтилен, полистирол) привело в свое время к созданию первых ион-селективных электродов на анионы Br-, CI-, I- , избирательно адсорбирующих из раствора указанные ионы в соответствии с правилом Панета – Фаянса – Гана. Так как концентрация определяемых ионов вне электрода отличается от таковой внутри электрода, равновесия на противоположных поверхностях мембраны отличаются, что приводит к возникновению мембранного потенциала. Позднее были разработаны и другие ион-селективные электроды.
Правило Панета-Фаянса-Гана. Из содержащихся в растворе двух одинаково заряженных ионов с одинаковой концентрацией на кристаллическом осадке преимущественно адсорбируется тот, который сильнее притягивается зернами осадка. Сила ионного притяжения тем больше, чем ниже растворимость соединения, образуемого этим ионом с противоположным ионом решетки. Сильнее всего притягиваются собственные ионы осадка. В результате поверхность частиц осадка заряжается (положительно или отрицательно), а около поверхности концентрируются противоионы. Например, на поверхности иодида серебра AgI в растворе нитрата серебра Ag NO3 адсорбируются ионы серебра, а в качестве противоионов –нитрат – ионы. Схематически запишем это так: AgI ∙Ag+│ NO3-.
Для проведения потенциометрических определений собирают электрохимическую ячейку из индикаторного электрода и электрода сравнения, которые опускают в анализируемый раствор и подсоединяют к потенциометру. Применяемые в потенциометрии вольтметры имеют большое внутреннее сопротивление (500 - 1000 МОм), поэтому существующие типы потенциометров представляют собой сложные электронные высокоомные вольтметры (значит через высокоомный вольтметр протекает очень малый ток). Для измерения ЭДС электродной системы в потенциометрах применяют компенсационную схему, позволяющую уменьшить ток в цепи ячейки.
Наиболее часто потенциометры применяют для прямых измерений рН, а также показателей концентраций других ионов: pNa, pK, pNH4, pCl. Измерения проводят, используя соответствующие ион-селективные электроды.
Для измерения рН применяют стеклянный электрод и электрод сравнения – хлорсеребряный. Перед проведением анализов необходимо проверить калибровку рН-метров по стандартным буферным растворам, фиксаналы которых прикладываются к прибору.
рН-метры помимо прямых определений рН, pNa, pK, pNH4, pCl и других позволяют проводить потенциометрическое титрование определяемого иона.
Потенциометрическое титрование
Потенциометрическое титрование проводят в тех случаях, когда химические индикаторы использовать нельзя или при отсутствии подходящего индикатора.
В потенциометрическом титровании в качестве индикаторов используют электроды потенциометра, опушенные в титруемый раствор. При этом применяют электроды, чувствительные к титруемым ионам. В процессе титрования изменяется концентрация ионов, что регистрируется на шкале измерительного пробора потенциометра. Записав показания потенциометра в единицах рН или мВ, строят график их зависимости от объема титранта (кривую титрования), определяют точку эквивалентности и объем титранта, израсходованный на титрование.
Кривая потенциометрического титрования имеет вид, аналогичный кривой титрования в титриметрическом анализе. По кривой титрования определяют точку эквивалентности, которая находится в середине скачка титрования. Наибольшее значение величина производной ∆рН/∆V имеет в точке эквивалентности.
Еще более точно точку эквивалентности можно определить методом Грана, по которому строят зависимость ∆V/∆Е от объема титранта. Методом Грана можно проводить потенциометрическое титрование, не доводя его до точки эквивалентности.
Потенциометрическое титрование применяют во всех случаях титриметрического анализа.
При кислотно-основном титровании используют стеклянный электрод и электрод сравнения. Поскольку стеклянный электрод чувствителен к изменениям рН среды, при титровании на потенциометре регистрируется изменение рН среды. Кислотно-основное потенциометрическое титрование с успехом применяют при титровании слабых кислот и оснований (рК ≤ 8). При титровании смесей кислот необходимо, чтобы их рК отличались больше, чем на 4 единицы, в противном случае часть более слабой кислоты оттитровывается вместе с сильной, и скачок титрования выражен не четко.
Это позволяет использовать потенциометрию для построения экспериментальных кривых титрования, подбор индикаторов для титрования и определения констант кислотности и основности.
При осадительном потенциометрическом титровании применяют в качестве индикатора электрод из металла, составляющего с определяемыми ионами электродную пару.
При комплексометрическом титровании используют: а) металлический электрод, обратимый к иону определяемого металла; б) платиновый электрод при наличии в растворе окислительно-восстановительной пары. При связывании титрантом одного из компонентов редокс-пары меняется его концентрация, что вызывает изменения потенциала индикаторного платинового электрода. Применяются также обратное титрование избытка раствора ЭДТА, добавленного к соли металла, раствором соли железа (III).
При окислительно-восстановительном титровании применяют электрод сравнения и платиновый индикаторный электрод, чувствительный к окислительно-восстановительным парам.
Потенциометрическое титрование – один из наиболее употребляемых методов инструментального анализа вследствие простоты, доступности, селективности и широких возможностей.
Кондуктометрия. Кондуктометрическое титрование
Кондуктометрия основана на измерении электрической проводимости раствора. Если в раствор вещества поместить два электрода и подать на электроды разность потенциалов, то через раствор потечет электрический ток. Как и каждый проводник электричества, растворы характеризуются сопротивлением R и обратной ему величиной – электрической проводимостью G:
![]() ,
,
![]()
Кондуктометрический анализ проводят с помощью кондуктометров – приборов, измеряющих сопротивление растворов. По величине сопротивления R определяют обратную ему по величине электрическую проводимость растворов G.
Определение концентрации растворов осуществляют прямой кондуктометрией и кондуктометрическим титрованием. Прямая кондуктометрия используется для определения концентрации раствора по калибровочному графику. Для составления калибровочного графика замеряют электрическую проводимость серии растворов с известной концентрацией и строят калибровочный график зависимости электрической проводимости от концентрации. Затем измеряют электрическую проводимость анализируемого раствора и по графику определяют его концентрацию.
Чаще применяют кондуктометрическое титрование. При этом в ячейку с электродами помещают анализируемый раствор, ячейку помещают на магнитную мешалку и титруют соответствующим титрантом. Титрант добавляют равными порциями. После добавления каждой порции титранта замеряют электрическую проводимость раствора и строят график зависимости между электрической проводимостью и объемом титранта. При добавлении титранта происходит изменение электрической проводимости раствора. В точке эквивалентности (т.э.) наступает перегиб кривой титрования.
Электрическая проводимость раствора зависит от подвижности ионов: чем выше подвижность ионов, тем больше электрическая проводимость раствора.
Кондуктометрическое титрование обладает рядом преимуществ. Его можно проводить в мутных и окрашенных средах, в отсутствии химических индикаторов. Метод обладает повышенной чувствительностью и позволяет анализировать разбавленные растворы веществ (до 10-4 моль/л). Кондуктометрическим титрованием анализируют смеси веществ, т.к. различия в подвижности различных ионов существенны и их можно дифференцированно оттитровывать в присутствии друг друга.
Кондуктометрический анализ легко автоматизировать, если раствор титранта подавать из бюретки с постоянной скоростью, а изменение электрической проводимости раствора регистрировать на самописце. Эта разновидность кондуктометрии получила название хронокондуктометрического анализа.
В кислотно-основном титровании кондуктометрическим путем можно определять сильные кислоты, слабые кислоты, соли слабых оснований и сильных кислот.
В осадительном кондуктометрическом титровании электрическая проводимость титруемых растворов сначала уменьшается или остается на некотором постоянном уровне вследствие связывания титруемого электролита в осадок, а после т.э. при появлении избытка титранта – снова возрастает.
В комплексометрическом кондуктометрическом титровании изменение электрической проводимости раствора наступает вследствие связывания катионов металла в комплекс с ЭДТА.
Окислительно-восстановительное кондуктометрическое титрование основано на изменении концентрации реагирующих ионов и появлении в растворе новых ионов, что изменяет электрическую проводимость раствора.
В последние годы получило развитие высокочастотная кондуктометрия, в которой электроды с раствором не контактируют, что важно при анализе агрессивных сред и растворов в закрытых сосудах.
Получили развитие два варианта – прямая высокочастотная кондуктометрия и высокочастотное титрование.
Прямая высокочастотная кондуктометрия применяется для определения влажности веществ, зерна, древесины, концентрации растворов в закрытых сосудах – ампулах, при анализе агрессивных жидкостей.
Высокочастотное титрование проводят на специальных титраторах – ТВ-6, ТВ-6Л.
Высокочастотное кондуктометрическое титрование проводят по типу кислотно-основного, окислительно-восстановительного или осадительного титрования в тех случаях, когда отсутствует подходящий индикатор или при анализе смесей веществ.
Кулонометрия. Кулонометрическое титрование
Сначала напомним законы электролиза Фарадея.
Пусть на электроде протекает полуреакция
X ± ne = Y
где знак плюс относится к полуреакции на катоде и минус – на аноде.
1- й закон Фарадея: m(Y) = k(Y) ∙I∙ t
2 - й закон Фарадея: k(Y) = M(Y)/n∙F
И суммарно m(Y) = M(Y) ∙I∙ t /n∙F
В кулонометрии количество определяемого вещества определяют измерением количества электричества, затраченное на их количественное электрохимическое превращение. Кулометрический анализ проводят в электролитической ячейке, в которую помещают раствор определяемого вещества. При подаче на электроды ячейки соответствующего потенциала происходит электрохимическое восстановление или окисление вещества. Согласно законам электролиза Фарадея масса m(Y) вещества Y, прореагировавшего на электроде, пропорционально количеству электричества I∙ t, прошедшего через раствор:
m(Y) = M(Y) ∙ I∙ t /n∙F
Кулонометрический анализ позволяет определять вещества, не осаждающиеся на электродах или улетучивающиеся в атмосферу при электрохимической реакции.
Различают кулонометрию прямую и кулонометрическое титрование. Высокая точность и чувствительность методов измерения электрического тока обеспечивает кулонометрическому анализу уникальную точность 0,1- 0,001%, и чувствительность до 1∙10⁻⁸ - 1∙10⁻10 г. Поэтому кулонометрический анализ применяется для определения микропримесей и продуктов разрушения веществ, что важно при контроле их качества.
Для определения точки эквивалентности при кулонометрическом титровании можно применять химический и инструментальные методы – добавление индикаторов, обнаружение окрашенных соединений фотометрическим или спектрофотометрическим путём.
В отличие от других методов анализа кулонометрия может быть полностью автоматизирована, что сводит к минимуму случайные ошибки определения. Эта особенность использована при создании автоматических кулонометрических татраторов – чувствительных приборов, применяющихся для особо точных анализов, когда другие методы оказываются недостаточно чувствительными. При анализе веществ, малорастворимых в воде, кулонометрию можно проводить на электродах из ацетиленовой сажи, являющейся хорошим адсорбентом и извлекающей такие вещества из реакционной среды с достаточной полнотой. Кулонометрическое титрование – перспективный метод инструментального анализа. Он может найти широкое применение для решения ряда специальных аналитических задач – анализа примесей, малых количеств лекарственных препаратов, определение в биологическом материале и окружающей среде токсических веществ, микроэлементов и других соединений.
