
- •Электрохимические методы анализа
- •Теоретические основы электрохимичесих методов анализа
- •Электрохимические системы
- •Типы электродов, используемых в электрохимических методах анализа
- •Классификация обратимых электродов
- •Потенциометрия
- •Основы метода
- •Типы электродов
- •Потенциометрические измерения
- •Кривые титрования.
- •Способы нахождения конечной точки титрования
- •Вольтамперометрия
- •Явления на электродах электрохимической ячейки при прохождении постоянного электрического тока
- •Электродная поляризация
- •Основы метода
- •I пред. Дифф
- •Градуировка оборудования
- •Амперометрическое титрование
- •Кулонометрия
- •Теоретические основы метода. Электролиз
- •Кулонометрический анализ
- •Кулонометрическое титрование.
- •Кондуктометрия
- •Электрическая проводимость растворов электролитов.
- •Прямой кондуктометрический анализ и кондуктометрическое титрование
-
Типы электродов, используемых в электрохимических методах анализа
Различают обратимые и необратимые электроды. При перемене направления электрического тока на обратимых электродах возникают реакции, противоположные по направлению, на необратимых - протекают реакции не обратные друг другу. Примером обратимого электрода служит медь в растворе, содержащем катионы Cu2+. При прохождении тока в противоположных направлениях идут реакции:
Cu2+ + 2e = Cu и Cu = Cu2+ + 2e.
К необратимым электродам относится, например, медь в растворе кислоты. Перемена направления тока приводит к реакциям
Cu = Cu2+ + 2e и 2H+ + 2e = H2.
Из обратимых электродов могут быть составлены обратимые электрохимические цепи (пары, гальванические элементы).
-
Классификация обратимых электродов
Электроды первого рода – пластинка металла в растворе своих ионов. На поверхности этого электрода (металлической пластинки) протекает полуреакция
Ох + n e = Red
где Ox – ионы металла в растворе (простые или комплексные),
Red – металл.
Примером может служить система Cu2+ + 2e = Cu, для которой
![]()
Электрод первого рода обратим по катиону металла. Эти катионы называются потенциал-
определяющими. Активность самого металла также может меняться, если он входит в состав сплава. В общем случае для потенциала электрода первого рода
![]()
где а(Меn+) – активность потенциалопределяющих ионов в растворе,
n - число электронов в уравнении полуреакции Ох + n e = Red,
а(Ме) – активность металла в сплаве.
Активность чистого металла постоянна и равна 1, так что уравнение Нернста упрощается
![]()
Ещк раз: электроды первого рода - любой металл, погруженный в раствор соли этого же металла. Образует окислительно-восстановительную систему, в которой потенциал электрода зависит от концентрации катионов в растворе. К электродам первого рода относятся ртутные, серебряные, платиновые, водородные и другие. К электродам первого рода, обратимым относительно катиона, относится и газовый водородный электрод (Pt) H2, H+, так как на платиновом электроде при насыщении его водородом устанавливается равновесие:
2Н+ = Н2(адсорбированный) = Н2(газ)
К электродам первого рода относят также и электроды, обратимые относительно анионов. Например,
![]()
Электроды второго рода - система, в которой металл покрыт слоем его труднорастворимой соли (или оксида), а раствор содержит анионы этой соли (в случае оксида – гидроксид-ионы ОН-). На электроде протекает полуреакция
МmАn + m∙n e = m∙n M + n Am-
Окисленной формой здесь является слаборастворимая соль МmАn, а восстановленная форма представляет собой металл М и анионы Am-. Потенциал электрода второго рода определяется активностью а(Мn+) катионов Мn+, которую можно выразить через произведение растворимости ПР(МmАn) соли МmАn и активность а(Am-) анионов Am-.
Поскольку уравнение растворения - диссоциации соли МmАn имеет вид
МmАn = m Мn+ + n Am-
То выраженное через молярные концентрации произведение растворимости имеет вид
ПР(МmАn) = Сm(Мn+) ∙ Сn(Am-)
Как записать уравнение
Нернста для электрода второго рода?
Выразим активность катионов Мn+
металла через произведение
растворимости С(Мn+)
=
![]() .
Получим
.
Получим
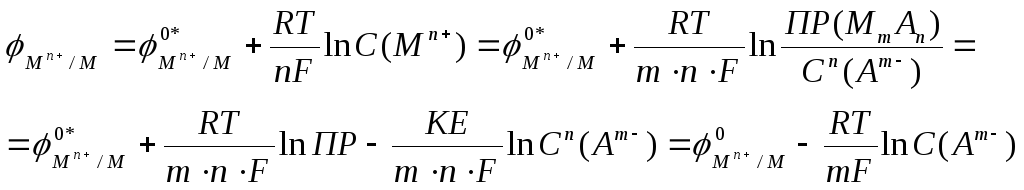
где
![]() - стандартный электродный потенциал
системы M n+/M
- стандартный электродный потенциал
системы M n+/M
![]() -
стандартный электродный потенциал
электрода второго рода.
-
стандартный электродный потенциал
электрода второго рода.
Следовательно, электрод второго рода обратим по аниону. Анионы являются потенциал-определяющими, их концентрация (активность) определяет потенциал электрода.
Еще раз: электроды второго рода - система, в которой металл, покрытый слоем его труднорастворимого соединения (соли, оксида или гидроксида), находится в равновесии с раствором, содержащим избыток другой хорошо растворимой соли с таким же анионом. Потенциал такого электрода определяется концентрацией соответствующего аниона. К электродам второго рода относятся хлорид-серябряный, каломельный и сурьмяный электроды, часто применяемые в качестве электродов сравнения.
Примеры электродов 2 рода.
Хлорсеребряный электрод. На электроде протекает полуреакция: с.7
AgCI + e = Ag + CI- , 0AgCl/Ag = + 0.222 В;
![]()
Каломельный электрод (каломелью называют слаборастворимую соль состава Hg2CI2) :
Hg2CI2
+
2e = 2Hg + 2CI-,
![]() =
+ 0.268 В.
=
+ 0.268 В.
![]()
Ртутно-оксидный электрод:
Hg2O + H2O + 2e = 2Hg + 2OH-
![]()
Эти электроды широко применяются как электроды сравнения вместо стандартного водородного электрода при составлении электрохимических цепей. Измеренные потенциалы затем пересчитывают в шкалу стандартного водородного электрода.
Электроды третьего рода – металл в контакте с двумя слаборастворимыми солями. Например, электрод
Pb2+│PbCI2, AgCI, Ag ,
в котором протекает реaкция
2 AgCI(тв) + 2e + Pb2+(водн) = 2Ag(тв) + PbCI2 (тв)
При работе такой электрохимической цепи происходит превращение менее растворимой соли в более растворимую (ПР(AgCI) =1.8∙10-10, ПР(PbCI2) =1.7∙10-5).
Уравнение Нернста выводится тем же методом, что и для электродов 2 рода: активности ионов выражаются через произведения растворимости, а постоянные слагаемые объединяются в 0 Ox//Red . Результат:
![]()
Следовательно, электрод 3-го рода обратим по катионам растворенного металла, которые в данном случае являются потенциалопределяющими.
Окислительно-восстановительные электроды - инертное вещество с электронной проводимостью (например, платина), погруженное в раствор, содержащий вещества с различной степенью окисления Ox и Red . В качестве электродов этого типа чаще всего применяют платиновую или серебряную проволоку, помещенную в стеклянный корпус. Инертный электрод выполняет только функцию переноса электронов от восстановленной формы к окисленной. Потенциал электрода определяется выражением:
![]()
где Пa(Ox) – произведение активностей ионов из той части уравнения полуреакции, где содержится Ох
Па(Red) – произведение активностей ионов из той части уравнения полуреакции, где содержится Red.
Ионообменные электроды. Ионообменный электрод состоит из ионита и раствора. Потенциал на границе раздела фаз возникает за счет процессов обмена ионами между ионитом и раствором. Допустим, ионит содержит ионы А+, способные к обмену с ионами М+ в растворе. Такой обмен записывается с помощью уравнения:
А+(ионит) + М+(водн) = А+(водн) + М+(ионит)
Эта реакция характеризуется константой равновесия (обмена), которая определяет степень замещения ионов в ионите ионами другого рода из раствора:
Коб = [А+(водн)][М+(ионит)]/ [А+(ионит)][М+(водн)]
При установившемся равновесии обменного процесса поверхность ионита и раствор приобретают электрические заряды противоположного знака, на границе раздела ионит - раствор возникает двойной электрический слой, которому соответствует скачок потенциала. К этой группе относится и стеклянный электрод.
Ионит – слаборастворимое вещество, на поверхности которого расположены связанные ионной связью ионы, способные обмениваться на другие ионы, находящиеся в растворе.
