
- •Электрохимические методы анализа
- •Теоретические основы электрохимичесих методов анализа
- •Электрохимические системы
- •Типы электродов, используемых в электрохимических методах анализа
- •Классификация обратимых электродов
- •Потенциометрия
- •Основы метода
- •Типы электродов
- •Потенциометрические измерения
- •Кривые титрования.
- •Способы нахождения конечной точки титрования
- •Вольтамперометрия
- •Явления на электродах электрохимической ячейки при прохождении постоянного электрического тока
- •Электродная поляризация
- •Основы метода
- •I пред. Дифф
- •Градуировка оборудования
- •Амперометрическое титрование
- •Кулонометрия
- •Теоретические основы метода. Электролиз
- •Кулонометрический анализ
- •Кулонометрическое титрование.
- •Кондуктометрия
- •Электрическая проводимость растворов электролитов.
- •Прямой кондуктометрический анализ и кондуктометрическое титрование
Инструментальные методы химического анализа. Часть 1.
Введение……………………………………………………………………………………3
-
Классификация инструментальных методов химического анализа………………..4
-
Основные характеристики аналитических методов………………………………..4
-
Классификация инструментальных методов анализа………………………………4
-
-
Электрохимические методы анализа……………………………………………...9
-
Теоретические основы………………………………………………………………..9
-
Электрохимические системы……………………………………………………..9
-
Типы электродов, используемых в электрохимических методах анализа……12
-
Классификация обратимых электродов………………………………………...12
-
-
Потенциометрия……………………………………………………………………..15
-
Основы метода……………………………………………………………………15
-
Типы электродов…………………………………………………………………17
-
-
Электроды сравнения
Индикаторные электроды
-
Теория селективности мембранных электродов………………………………..21
-
Потенциометрические измерения………………………………………………..22
-
Кривые титрования………………………………………………………………..25
-
Способы нахождения конечной точки титрования……………………………..27
-
Аппаратурное оформление потенциометрии……………………………………28
-
Вольтамперометрия………………………………………………………………….30
-
Явления на электродах электрохимической ячейки при прохождении
постоянного электрического тока……………………………………………….30
2.3.2. Электродная поляризация…………………………………………………………31
2.3.3. Основы метода……………………………………………………………………..32
2.3.4. Градуировка оборудования………………………………………………………..36
2.3.5. Разновидности вольтамперного анализа………………………………………….31
2.3.6. Амперометрическое титрование……………………………………………………
2.3.7. Аппаратурное оформление………………………………………………………34
2.4. Кондуктометрия……………………………………………………………………..
2.4.1. Теоретические основы метода. Электролиз……………………………………..35
2.4.2. Кулонометрический анализ………………………………………………………36
2.4.3.Кулонометрическое титрование (пусто)………………………………………….
2.5. Кондуктометрия……………………………………………………………………..38
2.5.1. Электрическая проводимость растворов электролитов…………………………39
2.5.2. Прямой кондуктометрический анализ и кондуктометрическое титрование…..41
-
Электрохимические методы анализа
К электрохимическим методам анализа относятся:
- потенциометрические - аналитическим сигналом служит потенциал электрода, опущенного в анализируемый раствор; включают ионометрию;
- вольтамперометрические, в том числе полярографические и инверсионно - вольтамперометрические;
- кулонометрические - измеряется количество электричества, потребовавшееся для преобразования определенного количества вещества;
- кондуктометрические - аналитическим сигналом служит электрическое сопротивление раствора электролита (или обратная сопротивлению величина - электропроводность).
-
Теоретические основы электрохимичесих методов анализа
-
Электрохимические системы
-
В основе всех этих методов лежит использование процессов, происходящих в электрохимических системах, состоящих из следующих частей:
- проводники первого рода, т.е. вещества, обладающие электронной проводимостью и находящиеся в контакте с электролитом (металлические и угольные электроды);
- проводники второго рода - вещества, обладающие ионной проводимостью - электролиты;
- проводники, обеспечивающие прохождение тока между электродами (тоже проводники первого рода) - внешняя цепь.
На границе раздела двух фаз (электрод-электролит) происходит перенос электрического заряда, т.е. протекает электрохимическая реакция. По направлению процесса взаимного превращения электрической и химической форм энергии различают два типа электрохимических систем: электрохимическую ячейку и гальванический элемент.
Электрохимической ячейкой называется система, в которой за счет энергии приложенного извне электрического тока происходят химические превращения веществ на электродах (электрическая энергия внешнего источника превращается в энергию химических связей продуктов электролиза) .
Гальваническим элементом называется система, в которой за счет химических превращений веществ на электродах электролитической ячейки и во внешней цепи возникает электрический ток (энергия химических связей исходных веществ превращается в электрическую энергию).
Внешний
источник
тока
Me1 Me2 K
Pt Pt - + е анод катод
А V - +


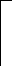
V катод анод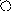


K+ A- Me1+ Me2+ - - - +++
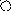

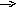
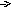
Me1+ A-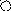
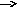
K+ Me2+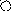
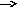



Рис. 1. Схематическое изображение электрохимических систем: электрохимическая ячейка или, иначе говоря, электролизер (слева); гальванический элемент (справа).
Пусть к двум металлическим электродам, помещенным в сосуд с раствором электролита, подключен внешний источник постоянного тока (рис.1 слева). Если приложенное извне напряжение постоянного тока обеспечивает достижение потенциалов разряда катионов K+ и анионов A-, то на электродах ячейки пойдут следующие электродные полуреакции:
К+ + е = К восстановление катионов на катоде
А- - е = А окисление анионов на аноде
В более общем виде запишем уравнения полуреакций так:
Ox1 + me Red1,
Red2 - ne Ox2.
Количество принятых me и отданных ne электронов должны быть одинаковыми, поэтому суммарное уравнение окислительно-восстановительной реакции в общем виде можно записать
n│ Ox1 + me Red1
m│ Red2 - ne Ox2
__│___________________
n Ox1 +m Red2 = n Red1 + m Ox2.
В электрохимии реакции восстановления принято называть катодными, реакции окисления - анодными. В соответствии с характером реакций, протекающих на электродах, их называют катодом или анодом.
Аналогичная картина прохождения электрического тока наблюдается и в том случае, когда электролитическая ячейка выступает в качестве гальванического элемента (рис.1 справа). Необходимо заметить, что гальванический элемент является системой, обратной электрохимической ячейке.
Если
химический потенциал металла Ме1,
используемого в качестве электрода,
больше химического потенциала его
катионов в растворе, металл растворяется
с образованием ионов Ме1n+
переходящих в раствор (система переходит
в состояние с меньшим химическим
потенциалом). Обратный процесс - выделение
катионов металла из раствора - протекает
с меньшей скоростью. Вследствие этого
на поверхности электрода скапливаются
электроны и она заряжается отрицательно,
а раствор вблизи электрода заряжается
положительно. Поэтому катионы металла
не будут диффундировать в глубину
электролита, а скапливаются вблизи
отрицательно заряженного электрода. В
конечном счете устанавливается
динамическое равновесие: сколько
катионов металла переходит в раствор,
столько же и возвращается из раствора
в металл. Поверхность электрода
приобретает отрицательный заряд, а
прилежащий к ней слой электролита -
равный ему положительный. В результате
на границе раздела раствор - металл
образуется двойной электрический слой,
которому соответствует скачек
электрического потенциала, называемый
равновесным электродным потенциалом
![]() системы
системы
![]() .
.
Если
химический потенциал катионов Ме2m+
металла
в растворе выше химического потенциала
его металлической формы
Ме2,
то катионы металла из раствора будут
осаждаться на электроде. В результате
осаждения катионов Ме2m+
на поверхности электрода Ме2
он будет заряжаться положительно, а
прилегающий слой электролита - отрицательно
из-за притягивания из раствора ионов
противоположного знака. В этом случае
также образуется двойной электрический
слой, подобный обкладкам физического
конденсатора, и на границе раздела фаз
«металл-раствор» возникает скачек
электрического потенциала. Как и в
первом случае, он является равновесным
электродным потенциалом
![]() системы Ме2m+/Ме2.
Равновесные потенциалы
системы Ме2m+/Ме2.
Равновесные потенциалы
![]() и
и
![]() могут различаться не только по величине,
но и по знаку.
могут различаться не только по величине,
но и по знаку.
Пока контакт К разомкнут (рис.1 справа), стрелка амперметра находится на нуле. При замыкании контакта амперметр покажет наличие в цепи тока. Это естественно, так как мы получили замкнутую электрическую цепь, в которой два электрода имеют разные потенциалы. ЭДС Е гальванического элемента представляет собой разность потенциалов между двумя электродами в электрохимической ячейке при отсутствии тока (при разомкнутом ключе):
E = катод - анод.
На одном электроде протекает реакция окисления (потеря электронов окисляющимися ионами или молекулами) и этот электрод, как было сказано выше, называется анодом. На другом электроде протекает реакция восстановления (присоединение электрона к восстанавливаемым ионам или молекулам) и этот электрод называется катодом.
Поскольку гальванический элемент является системой, обратной электрохимической ячейке, катод в нем имеет положительный знак, а анод - отрицательный. На аноде происходит растворение металла Ме1, а на катоде - осаждение катионов металла Ме2. Избыточные электроны, появившиеся на аноде в результате его растворения, через внешнюю цепь переходят на катод, где расходуются на восстановление катионов Ме2m+.
Суммарная химическая реакция может быть записана (повторим еще раз) так:
n Ox1 +m Red2 = n Red1 + m Ox2.
Равновесный
потенциал
![]() электрода
изменяется при изменении активности
(концентрации) ионов, которыми этот
электрод обменивается с раствором
электролита. Его зависимость от активности
ионов металла в растворе описывается
уравнением Нернста:
электрода
изменяется при изменении активности
(концентрации) ионов, которыми этот
электрод обменивается с раствором
электролита. Его зависимость от активности
ионов металла в растворе описывается
уравнением Нернста:
![]() (1)
(1)
где
![]() - равновесный потенциал электрода,
- равновесный потенциал электрода,
![]() - стандартный равновесный потенциал
электрода, R
- универсальная газовая постоянная,
равная 8.314 Дж∙ моль-1∙
К-1,
Т
- абсолютная температура (К), n
-
заряд иона, F
- постоянная Фарадея (96496 Кл ∙ моль-1),
a(Оx)
и a(Red)
- активность ионов в окисленной и
восстановленной формах соответственно.
- стандартный равновесный потенциал
электрода, R
- универсальная газовая постоянная,
равная 8.314 Дж∙ моль-1∙
К-1,
Т
- абсолютная температура (К), n
-
заряд иона, F
- постоянная Фарадея (96496 Кл ∙ моль-1),
a(Оx)
и a(Red)
- активность ионов в окисленной и
восстановленной формах соответственно.
Стандартный
равновесный электродный потенциал
![]() - это потенциал электрода, опущенного
в раствор электролита при температуре
25С,
давлении 1 атм. и активности
потенциалопределяющих ионов, равной
1. Для каждого металла значение
- это потенциал электрода, опущенного
в раствор электролита при температуре
25С,
давлении 1 атм. и активности
потенциалопределяющих ионов, равной
1. Для каждого металла значение
![]() величина постоянная, которую можно
найти в таблице стандартных электродных
потенциалов в водородной шкале
потенциалов.
величина постоянная, которую можно
найти в таблице стандартных электродных
потенциалов в водородной шкале
потенциалов.
Уравнение Нернста дает зависимость величины равновесного потенциала и от концентрации ионов в растворе электролита, если использовать связь активности иона с его концентрацией в растворе
a = ∙ C,
где а - активность иона в растворе, - коэффициент активности, С – молярная концентрация иона.
Уравнение (1) можно записать в виде
![]()
После некоторых преобразований получим следующее выражение для ЭДС Е гальванического элемента с электродами А и В:
E = (0B - 0A) - (RT/nF) ln([Aox]c[Bred]d/[Ared ]a[Box)]b). Исправить
Измерить абсолютный потенциал изолированного электрода невозможно, тогда как ЭДС гальванического элемента измерить довольно легко как разность потенциалов между двумя электродами E = В - А. Поэтому возникла необходимость выбора какого - либо электрода, потенциал которого не изменяется в зависимости от состава анализируемого раствора и условий измерения, и относительно которого измеряют потенциалы других электродов. В качестве такого выбран стандартный водородный электрод (СВЭ), потенциал которого условно был принят равным нулю при любых температурах.
В качестве электродов, потенциал которых относительно СЭВ точно известен и постоянен, в электрохимических методах применяют и другие, называемые электродами сравнения. Они используются для измерения потенциалов рабочих электродов.
Электрические параметры электролитической ячейки (сила тока, напряжение, сопротивление и т.п.) могут служить аналитическими сигналами при проведении анализов, если эти параметры измеряются с достаточной точностью. Поэтому электрохимические методы анализа основаны на использовании зависимости электрических параметров электрохимической ячейки или гальванического элемента от концентрации, природы и структуры вещества, участвующего в электродной реакции или электрохимическом процессе переноса электрических зарядов между электродами. С помощью специального аппаратурного оформления, можно создать такие условия, когда в процессе анализа в электролитической ячейке будет меняться только один электрический параметр.
Электрохимические методы анализа можно классифицировать следующим образом:
- методы, в которых отсутствует протекание электродных реакций, т.е. строение двойного электрического слоя в расчет не принимается (например, кондуктометрия);
- методы, основанные на электродных реакциях, протекающих в отсутствие внешнего источника тока (потенциометрия, ионометрия с ионоселективными электродами), или под током от внешнего источника тока (вольтамперометрия, кулонометрия).
Электрохимические методы анализа используют либо для прямых измерений, основанных на зависимости «аналитический сигнал - состав раствора», либо в сочетании с методами объемного анализа, например для определения конечной точки титрования.
