
- •Визначення температурного коефіцієнта ерс гальванічного елемента та розрахунок на його основі термодинамічних характеристик
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення коефіцієнтів активності електролітів методом ерс
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення стандартного потенціалу окисно-відновного електрода
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Придатність закону ома до розчинів електролітів
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Хімічна дія струму
- •Теоретичні відомості
- •Йодний кулонометр
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення чисел переносу
- •Теоретичні відомості
- •1.Метод Гітторфа
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •2. Метод рухомої межі
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •3. Метод, оснований на вимірюванні електрорушійної сили електрохімічних систем.
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Контрольні запитання
Контрольні запитання
1. Рівняння Гіббса-Гельмгольца та його використання в електрохімії.
2. За яких умов справедливий принцип Томпсона?
3. Як залежить співвідношення між електричною енергією, що генерується в оборотній системі, і тепловим ефектом реакції від температурного коефіцієнта ЕРС?
4. Докажіть, чи буде самовільно перебігати реакція Cu + ZnSO4 = Zn + CuSO4.
5. Розрахуйте максимальну електричну роботу, яку може генерувати гальванічний елемент Zn ZnCl2 AgCl Ag.
6. Охарактеризуйте фізичну суть понять “вільна” та “зв`язана” енергія.
7. Що являють собою відкриті, закриті та ізольовані термодинамічні системи?
8. Що таке “хімічний потенціал”?
9. В електрохімічній системі, складеній з електродів Cd/CdSO4 i Mn/MnSO4 самовільно перебігає електрохімічна реакція. Запишіть схему електрохімічної системи, електродні реакції та сумарну реакцію.
10. Наведіть приклади електродів 1-го та 2-го роду. Напишіть рівняння електродних реакцій та рівняння Нернста для вибраних електродів.
Лабораторна робота № 2
Визначення коефіцієнтів активності електролітів методом ерс
Мета роботи: Визначення середніх коефіцієнтів активності НСІ методом ЕРС. Дослідження їх залежності від концентрації електроліта.
Теоретичні відомості
Реальні розчини відрізняються від ідеальних насамперед тим, що в них мають місце сили взаємодії між іонами. Активності іонів (аі) відображають цю взаємодію і можуть бути подані у вигляді добутку:
аі = сі . fi,
де сі - концентрація іонів, fi - коефіцієнт активності.
Зіставлення виразів для хімічних потенціалів і-их іонів у реальних розчинах рі = і0 + RT lnCi + RT lnfi і в ідеальних розчинах
іді = і0 + RT lnCi показує, що RT lnfi = рі - іді = і.
Отже, коефіцієнт активності відображає зміну енергетичного стану іонів (або інших частинок), зумовлену міжіонною (міжчастинковою) взаємодією в умовах рівноваги.
В усіх електролітах коефіцієнти активності для нескінченно розведених розчинів дорівнюють одиниці і в цих умовах активності і концентрації співпадають аі = сі. Із збільшенням концентрації коефіцієнт активності поступово зменшується і при певному її значенні стає мінімальним. Подальше зростання концентрації веде до підвищення коефіцієнту активності, і в дуже концентрованих розчинах він може бути більшим від одиниці.
Експериментально визначити активності чи коефіцієнти активностей окремих іонів не можна. Це пов`язано з тим, що через умову електронейтральності розчину зміна вмісту іонів даного виду неможлива без одночасної й еквівалентної зміни іонів протилежного знаку. Звичайно визначають активність електроліту ае і так звані середні активності іонів а. Співвідношення між цими величинами таке: ае = а++ . а-- = а при умові, що електроліт розпадається при дисоціації на + позитивних і - негативних іонів. а = + + -. Очевидно, що середня активність іонів електроліту є середнім геометричним з активностей окремих іонів. Аналогічно можна визначити середні концентрації і середні коефіцієнти активності: (а++ . а--)1/ = с, (f++ . f-- )1/ = f.
Середній коефіцієнт іонів можна розрахувати, використовуючи висновки теорії Дебая і Гюккеля. Так, для розведених розчинів електролітів (с 0,01 моль/л) згідно першого наближення цієї теорії середній коефіцієнт активності можна розрахувати за формулою:
lg f
= -
z+
z-
h
![]() I,
I,
де z+,
z-
- заряди катіонів і аніонів відповідно;
І - іонна сила розчину, яку можна
розрахувати І = (1/2).
сi.
zi2;
h = 1,825 .
106
/(
Т)3/2.
Для водних розчинів 1-1-зарядних
електролітів при 250С
можна записати lg f
= - h![]() с
= - 0,509
с
= - 0,509![]() с.
В випадку більш концентрованих розчинів
для розрахунків середніх коефіцієнтів
активності використовують напівемпіричні
формули.
с.
В випадку більш концентрованих розчинів
для розрахунків середніх коефіцієнтів
активності використовують напівемпіричні
формули.
Середні коефіцієнти активності можна визначити експериментально за результатами вимірювань пружності пари, за зниженням температури замерзання і за ЕРС.
Використовуючи метод ЕРС, точні результати можна одержати, якщо підібрати електрохімічні системи, в яких буде відсутній дифузійний потенціал (елементи без переносу). Для цього найбільш придатні прості хімічні кола, в яких один електрод оборотний щодо катіонів електроліту, а другий - щодо його аніонів. Якщо необхідно, наприклад, визначити експериментально середній коефіцієнт активності іонів соляної кислоти, то складають електрохімічну систему з водневого (оборотного щодо катіонів електроліту) і хлорсрібного (оборотного щодо аніонів електроліту) електродів:
Pt(H2) HCI AgCI Ag (1)
Електрорушійна сила (Е) такої електрохімічної системи дорівнює різниці двох рівноважних потенціалів правого і лівого електродів:
Е=[Е0CI- AgCI Ag - (RT/F)ln aCI-] - [E0H+H2 + (RT/F) ln(aH+/p1/2H2)].
Враховуючи, що для 1-1-зарядного електроліта а+. а- = а2, при тиску водню рН2 = 1 i Е0CI- AgCI Ag - E0H+H2 = E0 вище наведене рівняння можна записати:
E = E0 - (RT/F) ln (aCI- . aH+) = E0 - 2(RT/F) ln а. (2)
Як відомо середня активність дорівнює добутку середньої концентрації на середній коефіцієнт активності а = с . f. Замість середньої концентрації можна використовувати аналітичну концентрацію для 1-1-зарядного розчину електроліту. Розглянемо на прикладі, чому це саме так можна зробити в даному випадку. Нехай аналітична концентрація с електроліту, який дисоціює на + і - іонів. Тоді концентрація позитивних іонів складатиме с+ = с . +, а негативних - с- = с . -. Середня активність іонів а = c . f = [(с . +)+ . (с . -)-]1/ . f = c . f . (++ + --)1/, де (++ + --)1/ - фактор асиметрії. Для 1-1-зарядного електроліту НСІ фактор асиметрії дорівнює одиниці, а тому а = c . f. Тоді рівняння для електрорушійної сили (2) матиме вигляд:
E = E0 - 2(RT/F) ln с - 2(RT/F) ln f, звідки
2(RT/F) ln f = E0 - (Е + 2(RT/F) ln с). Якщо замінити натуральний логарифм на десятковий і позначити (2,303 RT/F) = b0, то рівняння для розрахунку середнього коефіцієнта активності можна записати таким чином:
lg f = [E0 - (Е + 2 b0 lg с)]/2 b0. (3)
Е0CI- AgCI Ag - E0H+H2 = E0 можна визначити з дослідів. Для цього вимірюють електрорушійну силу електрохімічної системи (1) для різних концентрацій електроліта. Потім за одержаними даними будують графік залежності
(Е + 2 b0
lg с±) від
![]() с±
(див. рис.1).
Концентрацію
електроліта
виражають в моляльності.
с±
(див. рис.1).
Концентрацію
електроліта
виражають в моляльності.
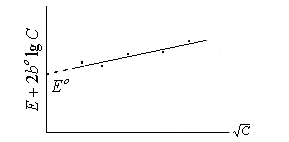
Рис.1 Визначення величини Е0.
При нескінченному розведенні (с0) коефіцієнт активності дорівнює одиниці, а lg f = 0, то очевидно, якщо екстраполювати одержану залежність до с = 0, то (Е + 2 b0 lg с) = Е0.
Після того, як значення Е0 підраховано, визначають за рівнянням (3) значення середніх коефіцієнтів активності розчину, які відповідають заданим значенням концентрацій.
