
- •Визначення температурного коефіцієнта ерс гальванічного елемента та розрахунок на його основі термодинамічних характеристик
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення коефіцієнтів активності електролітів методом ерс
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення стандартного потенціалу окисно-відновного електрода
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Придатність закону ома до розчинів електролітів
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Хімічна дія струму
- •Теоретичні відомості
- •Йодний кулонометр
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення чисел переносу
- •Теоретичні відомості
- •1.Метод Гітторфа
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •2. Метод рухомої межі
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •3. Метод, оснований на вимірюванні електрорушійної сили електрохімічних систем.
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Контрольні запитання
Теоретичні відомості
Всі електрохімічні процеси є окисно-відновними і будь-яка електродна реакція пов`язана з зміною окисно-відновного стану речовини. В цьому розумінні всі електроди є окисно-відновними. Наприклад, метал, занурений в розчин його іонів, є окисно-відновним і на межі поділу метал/розчин в рівноважних умовах перебігає реакція Mz+ + ze M, яка в одному напрямку іде за реакцією Mz+ + ze M - відновлення іонів (осадження металу), а в оборотному - M Mz+ + ze є окисленням металу (розчинення металу), але такий електрод відносять до електродів 1-го роду.
Згідно термінології, яка встановилась в електрохімії, окисно-відновним називають електрод, виготовлений з інертного металу і занурений в розчин, який містить речовину як в окисленій, так і у відновленій формах. Такі електроди називають також редокси-електродами. Інертний метал не обмінює свої іони з розчином тобто, не приймає участі в реакції, а служать лише для підведення чи відведення електронів. Метал редокс-електрода, обмінюючись електронами з учасниками окисно-відновної реакції, приймає потенціал, який відповідає редокси-рівновазі, що встановлюється між учасниками реакції. Крім цього метал повинен прискорювати встановлення електродної рівноваги, тобто бути каталізатором електродної реакції, але він повинен бути водночас інертним щодо інших можливих реакцій. Нарешті метал редокс-електрода повинен забезпечувати створення максимально розвинутої поверхні поділу метал/розчин, на якій могла б відбуватися реакція. Усі ці вимоги найкраще задовольняє платина. Для створення розвинутої поверхні платину покривають електролітично платиновою черню.
Розрізняють прості і складні редокси-електроди. На простих редокси-електродах реакція зводиться до переміни валентності іонів без зміни їх складу, наприклад:
Fe3+ + e = Fe2+,
MnO4- + e = MnO42-,
[Fe(CN)6]3- + e = [Fe(CN)6]4-.
Якщо позначити окислені іони Ox, а відновлені Red, то всі написані вище рівняння можна виразити одним загальним рівнянням:
Ox + ne = Red. (1)
Простий редокси-електрод записують у вигляді схеми Red,Ox Pt, або просто Red,Ox, а його потенціал згідно рівняння Нернста має вигляд
ERed,Ox = EoRed,Ox + 2,303 (RT/nF)lg (aOx/aRed). (2)
Потенціали простих редокси-електродів можна зв`язати з потенціалами відповідних електродів першого роду. Наприклад, залізо (Fe) може існувати в розчині у вигляді іонів Fe3+ та Fe2+. Для нього можливі два електроди першого роду Fe3+Fe i Fe2+Fe, а також редокси-електрод Fe2+, Fe3+. Зв`язок між цими величинами, згідно правила Лютера, можна знайти, провівши уявно процес електрохімічного розчинення заліза з одержанням іонів Fe3+ безпосередньо, або через проміжне утворення іонів нижчої валентності Fe2+.
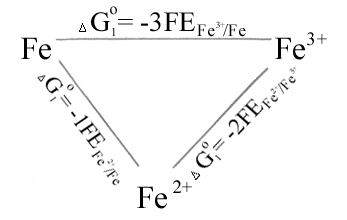
Враховуючи G1 = G2 + G3, можна записати:
EoFe3+/Fe
=
![]() EoFe2+/Fe
+
EoFe2+/Fe
+
![]() EoFe2+/Fe3+ (3)
EoFe2+/Fe3+ (3)
Рівняння (3) застосовують у тих випадках, коли безпосередньо визначити один із потенціалів або важко, або неможливо. В наведеному прикладі не вдається виміряти потенціал Fe3+Fe через нестійкість іонів Fe3+, але його можна визначити з доступних для прямого вимірювання стандартних потенціалів електродів Fe2+Fe i Fe2+,Fe3+.
На складних редокси-електродах реакція відбувається із зміною валентності та складу учасників окисно-відновного процесу. В реакціях такого роду беруть участь звичайно іони водню і молекули води. Проте участь останніх не позначається на характері рівнянь для електродного потенціалу, тому що активність води в ході реакції майже не змінюється. Схему складного редокси-електроду можна записати:
Red,Ox, Н+ Pt.
Потенціал складного редокси-електроду залежить не тільки від активностей окислених і відновлених учасників реакції, а й від активності водневих іонів. Характер залежності потенціалу редокси-електроду від активності водневих іонів визначається природою учасників реакції. Наприклад, для системи MnO4- - Mn2+, в якій перебігає реакція:
MnO4 - + 8H+ + 5e = Mn2+ + 4H2O,
потенціалу електрода відповідає рівняння:
E Mn2+, MnO4- = Eo Mn2+, MnO4- + 2,303 (RT/5F)lg (a MnO4- aH+8 /a Mn2+).
До складних редокси-електродів відносять також хінгідронний електрод, який являє собою гладкий платиновий електрод, занурений в водний розчин (наприклад, кислоти) з добавкою хінгідрона (малорозчинної сполуки чорно-зеленого кольору), який дисоціює в водних розчинах на еквімолекулярні кількості хінона С6Н4О2 (х) і С6Н4(ОН)2 гідрохінона (гх).
Для хінгідронного електроду, на якому перебігає реакція
С6Н4О2 + 2Н+ + 2е = С6Н4(ОН)2,
потенціал електрода передається рівнянням
Ех/гх = Ео х/гх + 2,303 (RT/2F)lg(ах . а2Н+/агх).
Складні редокси-електроди можна використовувати як індикаторні електроди при вимірюванні рН. Так, хінгідронний електрод використовують для вимірювання рН кислих та нейтральних розчинів (рН 8). Це пов`язано с тим, що внаслідок незначної розчинності і малої константи дисоціації хінгідрона в кислих розчинах малої іонної сили концентрації та коефіцієнти активності хінона і гідрохінона однакові, а тому потенціал електрода можна записати:
Ех/гх = Ео х/гх + 2,303 (RT/F)lg(аН+),
Ех/гх = Ео х/гх - bopH, (4)
де bo = 2,303 .RT/F = 0,059.
При рН 8 хінгідрон зазнає хімічні перетворення і легко окислюється киснем повітря.
Визначення стандартного окисно-відновного потенціалу електрода має велике значення, тому що дозволяє обчислити зміну стандартного ізобарно-ізотермічного потенціалу за формулою
Gо = - nFEoRed,Ox, (5)
а також константу рівноваги Кр реакції
EoRed,Ox = (RT/nF)lg Кр. (6)
