
- •Визначення температурного коефіцієнта ерс гальванічного елемента та розрахунок на його основі термодинамічних характеристик
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення коефіцієнтів активності електролітів методом ерс
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення стандартного потенціалу окисно-відновного електрода
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Придатність закону ома до розчинів електролітів
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Хімічна дія струму
- •Теоретичні відомості
- •Йодний кулонометр
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення чисел переносу
- •Теоретичні відомості
- •1.Метод Гітторфа
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •2. Метод рухомої межі
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •3. Метод, оснований на вимірюванні електрорушійної сили електрохімічних систем.
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Контрольні запитання
Прилади і засоби виміру, що використовуються при виконанні завдання
1. Джерело постійного струму з регулюванням струму ( 120 В).
2. Електролізер для визначення чисел переносу.
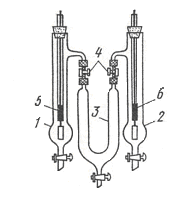
Рис.5 Електролізер для визначення чисел переносу
Електролізер складається з анодного (1), катодного (2) та проміжного (3) відсіків та затискачів (4). Кадмієвий анод (5) і мідний катод (6) вставляють у відповідні відсіки.
3.Міліамперметр.
4.Кулонометр мідний 6х2х4 (см).
Хід виконання роботи
Спочатку проводять підготовку поверхні електродів кулонометра та електролізера для визначення чисел переносу. Поверхню мідних катодів підготовляють, як описано в завданні 1.1. Мідний катод кулонометра зважують на вагах, занурюють в розчин його безпосередньо перед вмиканням електричного струму. Кадмієві аноди амальгамують. Мідні аноди кулонометра зачищають наждаковим папером і промивають водою, висушують фільтрувальним папером.
Заливають в катодний відсік (2) електролізера (рис.5) насичений розчин CuSO4 до рівня А-А і занурюють туди мідний катод. Після цього при відкритих затискачах в анодний відсік заливають досліджуваний розчин солі (за вказівкою викладача: 0,1...0,5 н KCI, NaCI чи LiCI) до тих пір, поки не заповниться повністю катодний та проміжний відсіки. Вставляють кадмієвий анод.
Збирають електричну схему, яка складається з електролізера для визначення чисел переносу, кулонометра, міліамперметра та джерела постійного струму. Занурюють катод кулонометра в розчин та вмикають електричний струм (30...50 мА). Електроліз ведуть протягом 1,0...1,5 годин.
Після закінчення електролізу катод кулонометра промивають, висушують, зважують та визначають масу міді, яка виділилась на катоді та кількість фарадеїв електрики, яка пройшла в електричному колі.
Закривають затискачі (4), зливають аноліт в попередньо зважену колбу чи бюкс, які закривають кришками, знову зважують та визначають масу аноліта. Розчин із проміжного відсіку зливають в склянку, відбирають пробу 5...10 мл та аналізують на присутність іонів кадмію, добавляючи декілька капель 1% розчину (NH4)2S, який з іонами кадмію дає жовтий осад CdS. Якщо в розчині є іони кадмію, то дослід треба повторити, зменшивши силу струму чи час електролізу. Якщо іонів кадмію в розчині немає, то приступають до аналізу аноліта.
Вихідний розчин та аноліт після електролізу аналізують на вміст іонів хлору шляхом титрування 0,1 н розчином AgNO3 у присутності 2% розчину K2CrO4. Для аналізу беруть наважки розчину 2...5 г із точністю до 0,0001 г. Розчини зважують в закритих кришками бюксах. На підставі отриманих даних обчислюють збільшення вмісту іонів хлору в аноліті за формулою:
Са = M (Vа - V) С 10-3, (12)
де М - маса аноліта, г; V і Va - значення об`ємів розчину AgNO3, що витрачено на титрування 1 г вихідного розчину і розчину аноліта після електролізу відповідно; С - концентрація розчину AgNO3, г-екв/л. Число переносу іонів хлору розраховують за формулою Са = n . tCI-.
