
- •Визначення температурного коефіцієнта ерс гальванічного елемента та розрахунок на його основі термодинамічних характеристик
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення коефіцієнтів активності електролітів методом ерс
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення стандартного потенціалу окисно-відновного електрода
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Придатність закону ома до розчинів електролітів
- •Теоретичні відомості
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Хімічна дія струму
- •Теоретичні відомості
- •Йодний кулонометр
- •Прилади і засоби виміру, що використовуються при виконанні лабораторної роботи
- •Хід виконання роботи
- •Контрольні запитання
- •Визначення чисел переносу
- •Теоретичні відомості
- •1.Метод Гітторфа
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •2. Метод рухомої межі
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •3. Метод, оснований на вимірюванні електрорушійної сили електрохімічних систем.
- •Прилади і засоби виміру, що використовуються при виконанні завдання
- •Хід виконання роботи
- •Контрольні запитання
Контрольні запитання
1. Що характеризує іонна сила розчину?
2. Розрахуйте іонну силу розчинів а) 0,2 М Na2SO4, б) 0,2 М Na2SO4 + 0,5 н Al2(SO4)3, в) 0,1 М FeSO4 + 0,05 н Fe2 (SO4)3 + 0,1 н H2SO4.
3. Які вимоги ставлять до металів окисно-відновних електродів?
4. Які окисно-відновні електроди відносять до простих, а які до складних?
5. Що таке “формальний” потенціал окисно-відновного електроду?
6. Наведіть приклади окисно-відновних електродів та напишіть рівняння реакцій, які на них перебігають.
7. Що таке рівноважний та стандартний потенціали, чим вони відрізняються?
8. Вираження складу розчину через концентрації та активності.
9. Які припущення були зроблені при виведенні рівняння першого наближення теорії Дебая і Гюккеля?
10. Правило Лютера та його використання на практиці.
Лабораторна робота № 4
Придатність закону ома до розчинів електролітів
Мета роботи: Перевірити придатність закону Ома до розчинів електролітів; вивчити залежність напруги на ванні при проходженні електричного струму від спаду напруги в електроліті та величини електродної поляризації
Теоретичні відомості
Залежно від природи струмопровідних частинок і їхньої електропровідності всі речовини умовно поділяють на п`ять груп:
1. Непровідні тіла (ізолятори) не проводять електричний струм. Питомий опір () цих речовин більший від 106 Ом.м.
2. Напівпровідники - речовини (деякі напівметали, інтерметаліди, солі...), в яких струм переноситься електронами і дірками. Їх питомий опір змінюється в широких межах 10-7...103 Ом.м.
3. Провідники 1-го роду - це тіла (метали, деякі їх оксиди...), в яких проходження струму забезпечується електронами. Питомий опір провідників 1-го роду лежить в інтервалі 10-8...10-5 Ом.м.
4. Провідники 2-го роду -це речовини, в яких струм переноситься іонами. До них належить багато твердих солей (101 106 Ом.м), іонні розплави (10-3 10-1 Ом.м) і розчини електролітів (10-2 104 Ом.м).
5. Змішані провідники - тіла, які поєднують електронну та іонну провідності, наприклад, розчини лужних і лужноземельних металів у рідкому аміаку, деякі тверді солі, розплави халькогенідів перехідних металів. Їх питомий опір залежить від складу провідника (від відносного внеску електронної та іонної складових).
Електрохімічна система має такі складові частини:
1. Електроліт, який являє собою провідник 2-го роду, тобто є іонним провідником електрики.
2. Електроди, які контактують з електролітом, являють собою електронопровідні тіла (провідники 1-го роду) і забезпечують обмін зарядами з учасниками електрохімічної реакції, а також передавання електронів у зовнішнє коло.
Саме на межі поділу двох різних провідних фаз відбувається електрохімічна реакція, тобто саме тут локалізується перетворення хімічної і електричної форм енергії. Електрохімічна система, в якій у результаті перетворення одних речовин в інші генерується електрична енергія, називається хімічним джерелом струму (ХДС) (Рис.1). Електрохімічна система, в якій за рахунок зовнішньої електричної енергії здійснюється перетворення одних речовин в інші, називається електролізером, або електролітичною ванною (Рис.2).
Анод (-) Zn = Zn2+
+ 2e Катод
(+) Cu2+
+ 2e = Cu
Рис.1 Схематичне зображення хімічного джерела струму (на прикладі елемента Даніеля -Якобі)
Анод (-) Ni = Ni2+
+ 2e Катод
(+) Ni2+ +
2e = Ni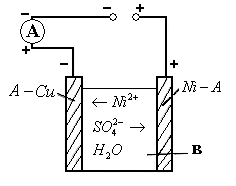
Рис.2 Схематичне зображення електролізера (на прикладі електроосадження нікелю на мідні зразки)
У рогзглянутих електрохімічних системах (Рис.1,2) А - провідники 1-го роду (електронопровідні тіла), В - провідники 2-го роду (іонні провідники).
Проходження електричного струму черех електрохімічну систему пов`язане не тільки з відповідними хімічними перетвореннями, а й зі зміною електрорушійної сили (ЕРС), електродних потенціалів порівняно з їх значеннями при відсутності струму. Так, при проходженні електричного струму (I) напруга на електролізері (Еел (I)) більша від оборотної ЕРС (Е):
Еел (I) Е,
а для хімічного джерела струму - менша від оборотної ЕРС (Е):
ЕХДС (I) Е.
Різниця між оборотною ЕРС і напругою на електролізері чи ХДС при проходженні електричного струму виникає як результат омічних втрат напруги (Uом=Еом), в основному, в електроліті та завдяки зміні електродних потенціалів із силою (або густиною) струму. При проходженнні струму потенціал кожного з двох електродів, що входить до електрохімічної системи, змінюється в напрямі, який збільшує напругу на електролізері і знижує її на ХДС. Суммарна зміна електродних потенціалів під струмом називається ЕРС поляризації (Епол).
Таким чином, для електролізера:
Еел (I) = Е + Еом + Епол, (1)
для хімічного джерела струму:
ЕХДС (I) = Е - Еом - Епол. (2)
Зупинимось на прикладі електрохімічної системи, яка працює в режимі електролізера (електролітичної ванни). Згідно рівняння (1) омічні втрати ЕРС можна визначити:
Еом = Еел (I) - Е - Епол. (3)
Рівняння (3) можна записати в іншому більш придатному для розрахунків вигляді:
Еом = Еел (I) - (Еа (I) - Ек (I) ), (4)
де Еел (I) = Uел - напруга на електролізері;
Еа (I), Ек (I) - потенціали анода та катода при заданій силі струму, який проходить через електролізер.
Як виходить з рівняння (4), омічні втрати ЕРС (омічні втрати напруги на електролізері) при проходженні електричного струму можна вирахувати, замірявши напругу на електролізері та електродні потенціали при заданій силі (чи густині) струму.
Які фактори впливають на омічні втрати ЕРС?
Відомо,що для провідника 1-го роду згідно закону Ома падіння напруги (Uом) прямо пропорційне силі струму (І), що проходить через нього:
Uом = IR, (5)
де R - опір провідника, який не залежить від напруги, а являється функцією питомого опору провідника, його довжини (L) та площі поперечного перерізу (S):
R = L/S, (6)
де - питомий опір провідника (Ом.м).
Враховуючи рівняння 5,6, можна записати:
Uом = IR = I L /S (7)
Сила струму дорівнює добутку густини струму і площі поперечного перерізу I = iS, а тому рівняння 7 можна записати:
Uом = iS L /S = i L (8)
Таким чином, падіння напруги в провіднику першого роду залежить від густини струму, який протікає, питомого опору та довжини провідника, опір провідника не залежить від напруги.
Опір електролітів - провідників 2-го роду, як і провідників 1-го роду, при звичайних умовах не залежить від напруги, яка прикладена зовні за винятком використання великих напруг (ефект Віна) чи змінного струму високої частоти (ефект Дебая-Фалькенгагена), а тому закон Ома застосовують і до електролітів. Слід відзначити, що для електролітів частіше використовують у рівнянні 8 замість питомого опору величину оборотну - питому електропровідність, а тому рівняння 8 матиме вигляд:
Eом = U = i L = i L / (9)
Таким чином, падіння напруги в електроліті прямо пропорційне густині струму, відстані між електродами та обернено пропорційне питомій електропровідності.
Залежність питомої електропровідності від температури пов`язана з впливом останньої на рухливості окремих іонів і приблизно виражається емпіричною формулою:
t = 18 [1 + (t - 18)] (10)
Величина температурного коефіцієнту для розчинів солей та лугів коливається в інтервалі 0,020...0,025, а для кислот - в інтервалі 0,010...0,016.
Таким чином, питома електропровідність електролітів зростає з підвищенням температури, в той час як питома електропровідність провідників 1-го роду (металів) знижується з ростом температури.
