
- •Тема 1. Периодическая система и строение атомов
- •Темы 2-3. Химическая связь. Строение вещества в конденсированном состоянии
- •Метод валентных связей
- •Теория гибридизации
- •Метод молекулярных орбиталей
- •Тема 4. Скорость химических реакций, основные понятия термодинамики
- •Обратимость химических реакций.
- •Смещение химического равновесия
- •Химическая термодинамика
- •Тема 5. Растворы
- •Способы выражения концентрации растворов
- •Коллигативные свойства растворов
- •Тема 6. Растворы электролитов
- •Сильные электролиты (уравнения диссоциации)
- •Слабые электролиты (уравнения диссоциации)
- •Теория сильных электролитов
- •Теория слабых электролитов
- •Ионные уравнения реакций
- •Тема 7. Равновесия в растворах, протолитическое равновесие, гидролиз солей Диссоциация воды. Водородный и гидроксильный показатели
- •Произведение растворимости
- •0,01 Моль 0,01 моль 0,01 моль
- •Гидролиз солей
- •Описание гидролиза как обратимого процесса
- •Тема 8. Окислительно-восстановительные реакции и электрохимия
- •Метод электронного баланса
- •Метод полуреакций (электронно-ионного баланса)
- •Электрохимические процессы
- •Электродные потенциалы
- •Гальванические элементы
- •Аккумуляторы
- •Электролиз
- •Тема 9. Химическая связь в комплексных соединениях
- •Координационная теория Вернера
- •Номенклатура комплексных соединений
- •Диссоциация комплексных соединений
- •Природа химической связи в комплексах
Электрохимические процессы
Электрохимическими процессами называются ОВР, осуществляемые в особых устройствах, позволяющих пространственно разделить стадии окисления и восстановления.
Полуреакции окисления и восстановления протекают на электродах, которые изготавливаются из материалов, хорошо проводящих электрический ток (различные металлы, графит). Электрод, на котором происходит окисление частиц называется анодом. Электрод, на котором происходит восстановление частиц называется катодом.
Если материал электрода принимает участие в окислительно-восстановительном взаимодействии, то такой электрод называется активным, если этого не происходит - инертным.
Электрохимические процессы подразделяются на:
1) самопроизвольные (идут в гальванических элементах и аккумуляторах);
2) несамопроизвольные (электролиз).
Электродные потенциалы
Если кусочек металла погрузить в водный раствор его соли, то металл относительно раствора приобретет некий потенциал (называемый электродным потенциалом). При этом в системе установится равновесие между гидратированными ионами металла Me+z в растворе и атомами металла в твердой фазе:
Me+z (aq)
+ ze- ![]() Me(тв)
Me(тв)
В данной системе кусок металла является электродом (активным электродом, т.к. частицы, из которых он состоит могут обратимо переходить в раствор в виде ионов).
Величина электродного потенциала зависит от многих факторов. В специальных таблицах приведены значения стандартных электродных потенциалов (E), измеренных при стандартных условиях (T = 298 K, p = 1,013.105 Па, концентрация ионов [Me+z] = 1 моль/л).
Если условия отличаются от стандартных, то электродный потенциал (E) электрода можно рассчитать по уравнению Нернста:
E = E
+
![]() ,
,
где: E - стандартный электродный потенциал,
T - температура,
R - универсальная газовая постоянная,
F - постоянная Фарадея (96 485 Кл/моль),
z - количество электронов, принимающих участие в элементарном окислительно-восстановительном акте на электроде.
Величина электродного потенциала определяет термодинамическую возможность и направление протекания ОВР на данном электроде в электрохимической системе.
Гальванические элементы
Гальванические элементы являются химическими источниками электрической энергии. При работе гальванических элементов энергия ОВР преобразуется в электроэнергию. Принцип действия гальванических элементов рассмотрим на примере элемента Даниэля-Якоби (см. рисунок), в котором протекает окислительно-восстановительная реакция Zn + Cu+2 = Zn+2 + Cu :
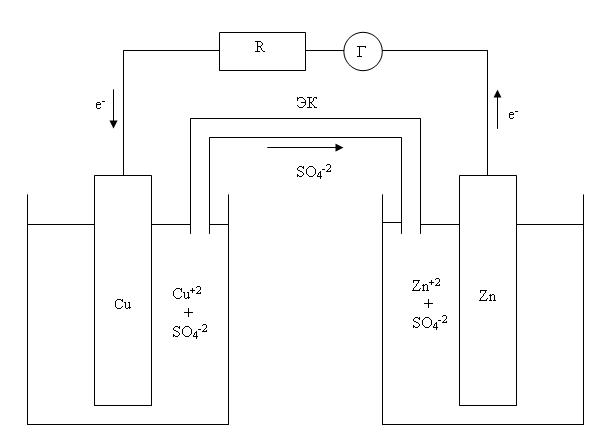
Этот гальванический элемент состоит из цинкового электрода, погруженного в раствор ZnSO4 и медного электрода, погруженного в раствор CuSO4. Растворы соединены между собой электролитическим ключом (ЭК)- устройством, позволяющим ионам SO4-2 переходить из одного раствора в другой. Оба раствора и электролитический ключ являются внутренней цепью гальванического элемента. Внешняя цепь в данном случае состоит из металлических проводов, резистора (R) и гальванометра (Г). Если внутренняя и внешняя цепи гальванического элемента замкнуты, то гальванометр регистрирует наличие во внешней цепи электрического тока. При этом на электродах самопроизвольно протекают процессы:
анод (-) Zn (тв) - 2e- = Zn+2 (aq)
катод (+) Cu+2 (aq) + 2e- = Cu (тв)
Катод имеет положительный заряд, а анод - отрицательный. При работе гальванического элемента в раствор ZnSO4 переходят избыточные ионы Zn+2, а в растворе CuSO4 появляются избыточные анионы SO4-2. Через электролитический ключ ионы SO4-2 переходят из раствора CuSO4 в раствор ZnSO4. В гальваническом элементе Даниэля-Якоби цинковая пластина - активный электрод, а медная - инертный.
ЭДС гальванического элемента (E) равна разности электродных потенциалов катода и анода: E = Eк - Eа .
ЭДС элемента Даниэля-Якоби при стандартных условиях (T = 298 K, p = 1,013.105 Па, [Zn+2] = [Cu+2 ] = 1 моль/л) равна разности стандартных электродных потенциалов цинка и меди:
E = E(Zn+2/Zn) - E(Cu+2 /Cu) = + 0,34 В - (- 0,76 В) = 1,1 В .
Зная величину ЭДС гальванического элемента легко расчитать изменение энергии Гиббса (G) для данного процесса:
G = - zFE ,
где F - постоянная Фарадея (96 485 Кл/моль), z - количество электронов, переходящих от восстановителя к окислителю.
Нетрудно убедиться,
что для гальванического элемента
Даниэля-Якоби при стандартных условиях
G
= -212,3 кДж/моль. Это означает, что процесс
Zn
+ Cu+2
![]() Zn+2
+ Cu протекает в прямом направлении
практически необратимо.
Zn+2
+ Cu протекает в прямом направлении
практически необратимо.
