
- •Тема 1. Периодическая система и строение атомов
- •Темы 2-3. Химическая связь. Строение вещества в конденсированном состоянии
- •Метод валентных связей
- •Теория гибридизации
- •Метод молекулярных орбиталей
- •Тема 4. Скорость химических реакций, основные понятия термодинамики
- •Обратимость химических реакций.
- •Смещение химического равновесия
- •Химическая термодинамика
- •Тема 5. Растворы
- •Способы выражения концентрации растворов
- •Коллигативные свойства растворов
- •Тема 6. Растворы электролитов
- •Сильные электролиты (уравнения диссоциации)
- •Слабые электролиты (уравнения диссоциации)
- •Теория сильных электролитов
- •Теория слабых электролитов
- •Ионные уравнения реакций
- •Тема 7. Равновесия в растворах, протолитическое равновесие, гидролиз солей Диссоциация воды. Водородный и гидроксильный показатели
- •Произведение растворимости
- •0,01 Моль 0,01 моль 0,01 моль
- •Гидролиз солей
- •Описание гидролиза как обратимого процесса
- •Тема 8. Окислительно-восстановительные реакции и электрохимия
- •Метод электронного баланса
- •Метод полуреакций (электронно-ионного баланса)
- •Электрохимические процессы
- •Электродные потенциалы
- •Гальванические элементы
- •Аккумуляторы
- •Электролиз
- •Тема 9. Химическая связь в комплексных соединениях
- •Координационная теория Вернера
- •Номенклатура комплексных соединений
- •Диссоциация комплексных соединений
- •Природа химической связи в комплексах
Тема 6. Растворы электролитов
Было установлено, что многие вещества, при растворении в полярных растворителях (например, в воде) распадаются на ионы. Такие вещества называются электролитами, а процесс распада на ионы называется электролитической диссоциацией (ЭД).
Электролитическая диссоциация является следствием взаимодействия вещества с молекулами растворителя. В ходе этого процесса образуются ионы, окруженные молекулами растворителя - так называемой сольватной оболочкой (если растворителем является вода, оболочка называется гидратной). Ион вместе с сольватной оболочкой называется сольватированным (в случае воды - гидратированным или акватированным).
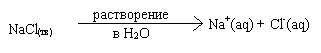
Индекс (aq) означает, что данный ион акватирован. Очень часто этот индекс опускается.
Основной количественной характеристикой процесса ЭД является степень электролитической диссоциации (точнее: истинная степень ЭД). Степень электролитической диссоциации () - это отношение числа молекул данного вещества, распавшихся на ионы (np) к общему числу молекул в данном растворе (n0):
=
![]() .
.
В соответствии со значениями все вещества по отношению к данному растворителю можно разделить на 3 типа:
= 0 неэлектролиты,
0 1 cлабые электролиты,
= 1 cильные электролиты.
Сильные электролиты (уравнения диссоциации)
По современным представлениям, диссоциация сильного электролита является необратимым процессом ( = 1). В растворе сильного электролита нет его молекул, а есть только ионы, на которые он продиссоциировал. К сильным электролитам относятся:
1. Все соли. Соль диссоциирует как сильный электролит на кислотные остатки и основные остатки:
Fe2(SO4)3
= 2 Fe+3
+ 3 SO![]() ,
,
NaHCO3
= Na+
+ HCO![]() ,
,
AlOHCl2 = AlOH+2 + 2 Cl- .
2. Некоторые основания (они называются сильными основаниями или щелочами):
NaOH = Na+ + OH- ,
Ba(OH)2 = Ba+2 + 2OH- .
3. Некоторые кислоты (они называются сильными кислотами):
HCl = H+ + Cl- ,
HMnO4
= H+
+ MnO![]() ,
,
H2SO4
= H+
+ HSO![]() .
.
Слабые электролиты (уравнения диссоциации)
В отличие от сильных электролитов, слабые электролиты подвергаются ЭД обратимо. В растворе слабого электролита кроме ионов всегда присутствуют недиссоциированные молекулы. Причем, если раствор не слишком сильно разбавлен, целых молекул слабого электролита в нем, как правило, значительно больше, чем ионов.
К слабым электролитам относятся:
1. Многие кислоты (они называются слабыми) и все гидроанионы:
H2CO3
![]() H+
+ HCO
H+
+ HCO![]() ,
,
HCO![]()
![]() H+
+ CO
H+
+ CO![]() ,
,
CH3COOH
![]() CH3COO-
+ H+
,
CH3COO-
+ H+
,
HSO![]()
![]() H+
+ SO
H+
+ SO![]() .
.
2. Многие основания (они называются слабыми) и все гидроксокатионы:
Fe(OH)2
![]() FeOH+
+ OH-
,
FeOH+
+ OH-
,
FeOH+
![]() Fe+
+ OH-
,
Fe+
+ OH-
,
NH4OH
![]() NH
NH![]() + OH-
.
+ OH-
.
3. Все амфотерные гидроксиды, их гидроанионы и гидроксокатионы:
Zn(OH)2
![]() ZnOH+
+ OH-
,
ZnOH+
+ OH-
,
ZnOH+
![]() Zn+2
+ OH-
,
Zn+2
+ OH-
,
H2ZnO2
![]() H+
+ HZnO
H+
+ HZnO![]() ,
,
HZnO![]()
![]() H+
+ ZnO
H+
+ ZnO![]() .
.
