
- •Тема 1. Периодическая система и строение атомов
- •Темы 2-3. Химическая связь. Строение вещества в конденсированном состоянии
- •Метод валентных связей
- •Теория гибридизации
- •Метод молекулярных орбиталей
- •Тема 4. Скорость химических реакций, основные понятия термодинамики
- •Обратимость химических реакций.
- •Смещение химического равновесия
- •Химическая термодинамика
- •Тема 5. Растворы
- •Способы выражения концентрации растворов
- •Коллигативные свойства растворов
- •Тема 6. Растворы электролитов
- •Сильные электролиты (уравнения диссоциации)
- •Слабые электролиты (уравнения диссоциации)
- •Теория сильных электролитов
- •Теория слабых электролитов
- •Ионные уравнения реакций
- •Тема 7. Равновесия в растворах, протолитическое равновесие, гидролиз солей Диссоциация воды. Водородный и гидроксильный показатели
- •Произведение растворимости
- •0,01 Моль 0,01 моль 0,01 моль
- •Гидролиз солей
- •Описание гидролиза как обратимого процесса
- •Тема 8. Окислительно-восстановительные реакции и электрохимия
- •Метод электронного баланса
- •Метод полуреакций (электронно-ионного баланса)
- •Электрохимические процессы
- •Электродные потенциалы
- •Гальванические элементы
- •Аккумуляторы
- •Электролиз
- •Тема 9. Химическая связь в комплексных соединениях
- •Координационная теория Вернера
- •Номенклатура комплексных соединений
- •Диссоциация комплексных соединений
- •Природа химической связи в комплексах
Тема 5. Растворы
Раствор - это гомогенная (однородная) система, состоящая из двух или более компонентов (химических веществ).
Один из компонентов считается растворителем, а остальные - растворенными веществами. Если вещества до смешивания находились в разных агрегатных состояниях, то растворителем считается тот компонент, агрегатное состояние которого имеет раствор. Например, при смешивании жидкой воды и твердого сахара получился жидкий раствор. В данном случае растворителем является вода, а сахар - растворенным веществом.
Если вещества в момент смешивания имели одинаковое агрегатное состояние, то растворителем считается тот компонент, которого больше по количеству вещества. Например, если смешать 180 г воды (10 моль) и 180 г этилового спирта (180 г / 40 г / моль = 3,9 моль), то растворителем является вода.
По агрегатному состоянию растворы можно разделить на газообразные, жидкие и твердые.
Примеры:
1) Газообразный раствор - воздух (N2 - растворитель; O2, CO2, H2O и т.д. - растворенные вещества).
2) Жидкий раствор - раствор сахара в воде.
3) Твердый раствор - сталь (Fe - растворитель; С и другие элементы - растворенные вещества).
Способы выражения концентрации растворов
Таких способов существует множество, но чаще всего используется 6 перечисленных ниже. Символом X будет обозначаться формула того вещества, концентрация которого определяется данным выражением (Х =NaCl, H2SO4, KOH и т.д.)
I. Массовая доля () - это отношение массы растворенного вещества к общей массе раствора:
(X) =
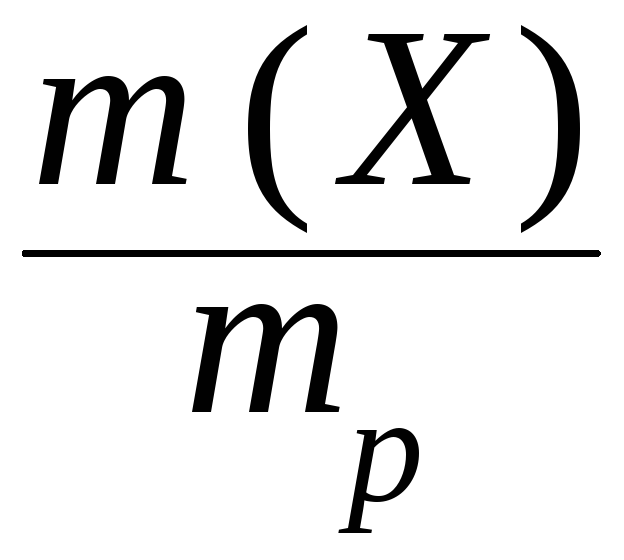 ;
;
Массовая доля - безразмерная величина. Сумма массовых долей всех веществ в растворе = 1. Массовая доля может быть выражена в процентах. В этом случае она находится по формуле:
(X) =
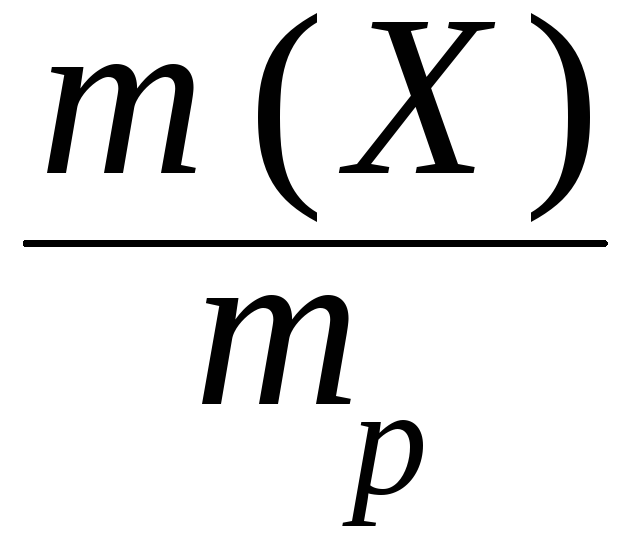
100 ,
100 ,
II. Мольная доля (х) - отношение количества вещества Х (моль) к общему числу молей всех веществ в растворе.
х(Х)
=
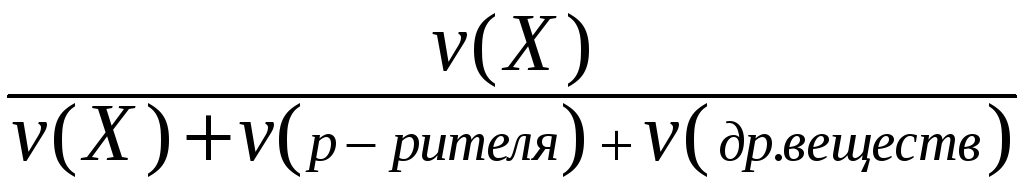 .
.
Массовая доля - безразмерная величина. Сумма мольных долей всех веществ в растворе = 1.
III. Массовая концентрация (Т) - отношение массы компонента Х к объему раствора.
Т(Х) =
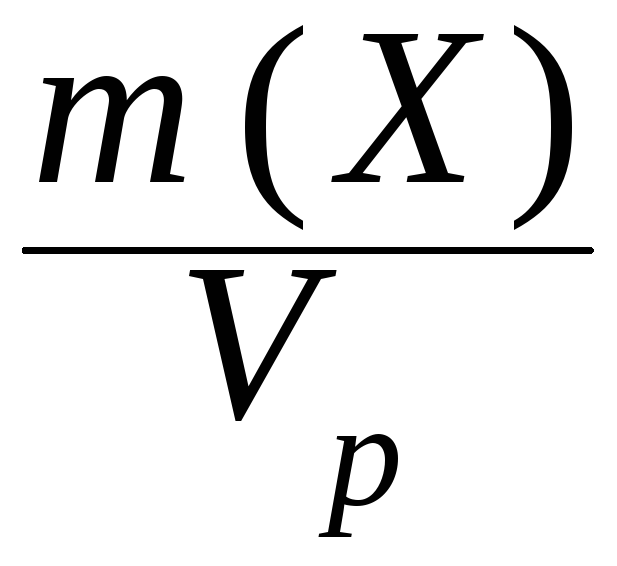 .
.
Обычно Т находят в единицах (г/дм3), в системе СИ она имеет единицу измерения (кг/м3). В аналитической химии эта величина выражается в единицах (г/см3) и называется титром вещества Х.
IV. Молярная концентрация (молярность) c(Х) или [X] - отношение количества вещества к объему раствора.
c(Х)
= [X] =
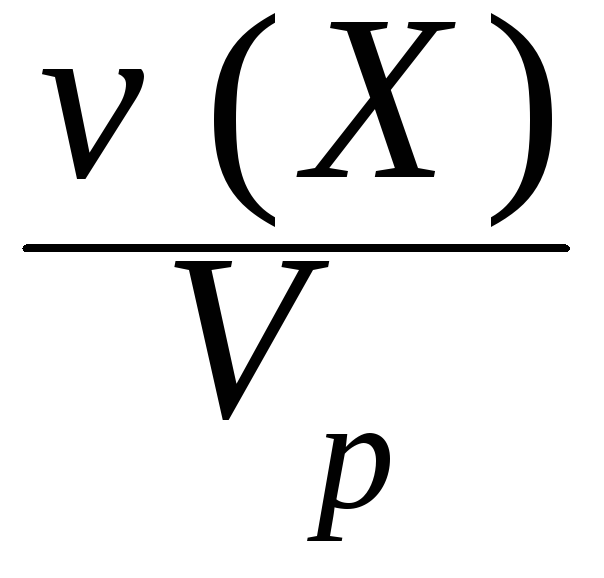 .
.
Обычно молярность выражают в (моль/дм3) и обозначают буквой (М). В системе СИ молярность имеет единицу измерения моль/м3.
V. Моляльность (b) - отношение количества вещества Х к массе растворителя в данной порции раствора.
b(X) =
 .
.
Моляльность может иметь только одну единицу измерения - моль/кг.
VI. Молярная концентрация эквивалента c(Э) - отношение количества вещества эквивалента к объему раствора:
c(Э)
= c(![]() X)
=
X)
=
 =
=
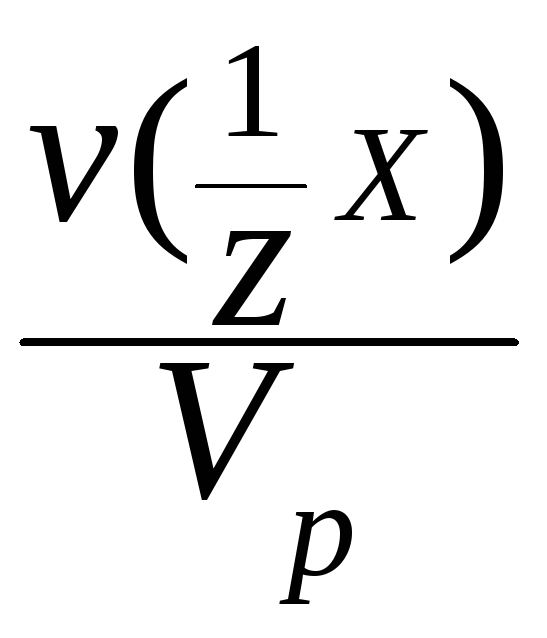 =
=
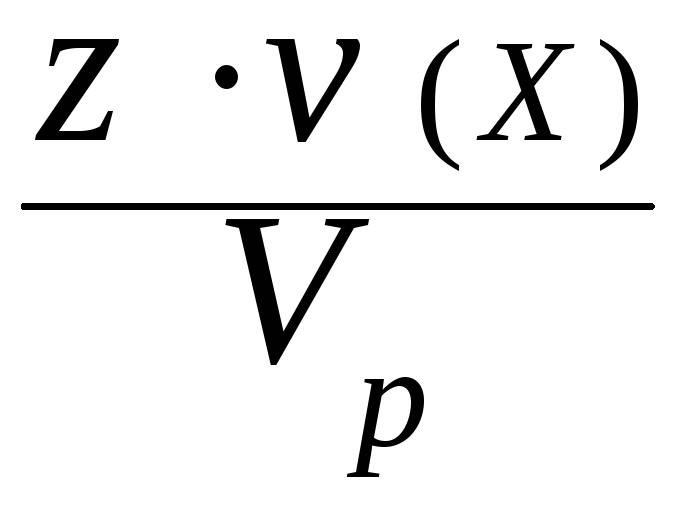 .
.
Ранее для обозначения этого понятия использовались синонимы: эквивалентная концентрация, нормальная концентрация, нормальность (все они считаются устаревшими).
Молярная концентрация эквивалента обычно выражается в единицах моль/дм3. В СИ она имеет единицу измерения моль/м3.
