
- •Тема 1. Периодическая система и строение атомов
- •Темы 2-3. Химическая связь. Строение вещества в конденсированном состоянии
- •Метод валентных связей
- •Теория гибридизации
- •Метод молекулярных орбиталей
- •Тема 4. Скорость химических реакций, основные понятия термодинамики
- •Обратимость химических реакций.
- •Смещение химического равновесия
- •Химическая термодинамика
- •Тема 5. Растворы
- •Способы выражения концентрации растворов
- •Коллигативные свойства растворов
- •Тема 6. Растворы электролитов
- •Сильные электролиты (уравнения диссоциации)
- •Слабые электролиты (уравнения диссоциации)
- •Теория сильных электролитов
- •Теория слабых электролитов
- •Ионные уравнения реакций
- •Тема 7. Равновесия в растворах, протолитическое равновесие, гидролиз солей Диссоциация воды. Водородный и гидроксильный показатели
- •Произведение растворимости
- •0,01 Моль 0,01 моль 0,01 моль
- •Гидролиз солей
- •Описание гидролиза как обратимого процесса
- •Тема 8. Окислительно-восстановительные реакции и электрохимия
- •Метод электронного баланса
- •Метод полуреакций (электронно-ионного баланса)
- •Электрохимические процессы
- •Электродные потенциалы
- •Гальванические элементы
- •Аккумуляторы
- •Электролиз
- •Тема 9. Химическая связь в комплексных соединениях
- •Координационная теория Вернера
- •Номенклатура комплексных соединений
- •Диссоциация комплексных соединений
- •Природа химической связи в комплексах
Теория слабых электролитов
Диссоциация любой
частицы, являющейся слабым электролитом
является обратимым процессом. Как и для
любого другого обратимого процесса
можно ввести понятие о константе
равновесия, которая в данном случае
получила название “константа диссоциации”
(Кd).
Например, угольная кислота является
слабым электролитом и диссоциирует в
две ступени (по второй ступени диссоциируют
уже не молекулы Н2СО3,
а гидрокарбонат-анионы НСО![]() ):
):
1 cтупень: Н2СО3
![]() Н+
+ НСО
Н+
+ НСО![]()
К![]() =
=
![]()
II
ступень: HCO![]()
![]() H+
+ CO
H+
+ CO![]()
K![]() = Kd
= Kd![]() =
=
![]()
Общее уравнение:
H2CO3
![]() 2H+
+ CO
2H+
+ CO![]()
K![]() (общ) =
(общ) =
![]()
Нетрудно доказать, что
К![]() (общ) = К
(общ) = К![]() K
K![]() или К
или К![]() (общ)
= К
(общ)
= К![]() K
K![]() K
K![]() K
K![]() ,
где n
- количество ступеней диссоциации
слабого электролита.
,
где n
- количество ступеней диссоциации
слабого электролита.
Используя принцип
Ле-Шателье можно полагать, что К
![]()
К
К
![]()
K
K![]() и т.д. И действительно, для всех слабых
электролитов найдено, что константы
диссоциации по (n - 1) - ой ступени на
несколько порядков больше, чем таковая
для n - ой ступени. Например, для угольной
кислоты К
и т.д. И действительно, для всех слабых
электролитов найдено, что константы
диссоциации по (n - 1) - ой ступени на
несколько порядков больше, чем таковая
для n - ой ступени. Например, для угольной
кислоты К![]() =
4,5
10-7,
K
=
4,5
10-7,
K![]() = 4,7
10-11.
= 4,7
10-11.
Величина константы
диссоциации зависит только от природы
элктролита и растворителя, а также от
температуры. Значения К![]() для различных веществ при определенной
температуре (как правило, 25 С)
приведены в специальных справочных
таблицах.
для различных веществ при определенной
температуре (как правило, 25 С)
приведены в специальных справочных
таблицах.
Константа диссоциации не зависит от концентрации электролита в растворе, а степень диссоциации () слабого электролита имеет явную зависимость от этого параметра: чем больше концентрация, тем меньше (). Функционально эта зависимость описывается законом разбавления Оствальда:
 = K
= K![]() ,
,
где с - общая концентрация частиц электролита в растворе (моль/ дм3);
K![]() - константа диссоциации при данной
температуре;
- константа диссоциации при данной
температуре;
- cтепень диссоциации.
В данном выражении независимой переменной является концентрация (С), а искомой величиной - . Для решения этого уравнения его нужно преобразовать и решать относительно как обычное квадратное уравнение:
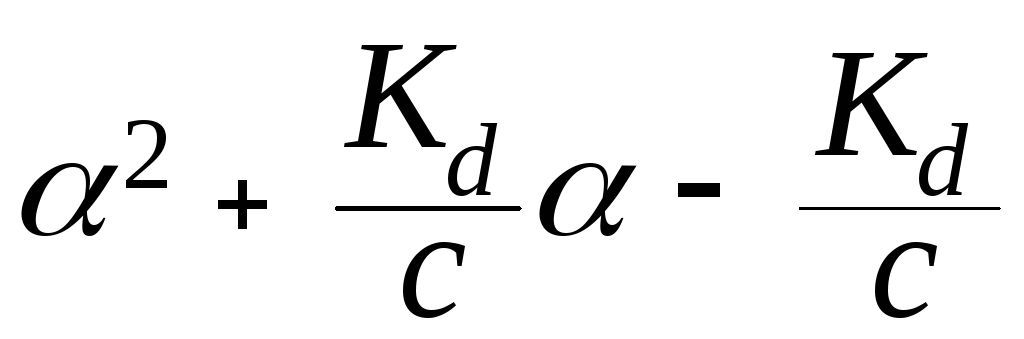 = 0.
= 0.
Положительным корнем этого уравнения является:
![]()
=
=
 .
.
При решении многих задач предполагается, что 1 ( 0):
![]()
![]() =
=
![]() .
.
Поэтому во многих случаях можно использовать упрощенную формулу:
![]() .
.
Она дает достаточно верный результат для значений 0,1 . Если же получается 0,1 , то переходят к расчету по квадратному уравнению.
Ионные уравнения реакций
В качестве примера рассмотрим взаимодействие соляной кислоты и гидроксида натрия в водном растворе:
HCl + NaOH = NaCl + H2O.
Это уравнение написано в молекулярном виде. Молекулярное уравнение данного процесса не отражает реальных явлений, имеющих место при протекании такого взаимодействия, так как в приведенном примере все вещества, кроме воды, являются сильными электролитами и в растворе присутствуют не в виде молекул, а только в виде ионов:
HCl = H+ + Cl-,
NaOH = Na+ + OH-,
NaCl = Na+ + Cl-.
Поэтому уравнение нейтрализации логичнее написать в ионном виде. При переходе от молекулярного к ионному (точнее: полному ионному) уравнению на ионы разбиваются только формулы сильных электролитов, хорошо растворимых в воде:
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O.
Полученное выражение можно сократить и получить сокращенное ионное уравнение:
H+ + OH- = H2O.
Сокращенное ионное уравнение показывает, что данное взаимодействие сводится к реакции между ионами водорода и гидроксид-анионами с образованием молекул слабого электролита (воды).
Аналогичным образом следует рассматривать и другие процессы, протекающие в растворах с участием электролитов.
Пример 1. CO2 + 2 NaOH = Na2CO3 + H2O
CO2
+ 2Na+
+ 2OH-
= 2Na+
+ CO![]() + 2H2O
+ 2H2O
CO2
+ 2OH-
= CO![]() + 2H2O
+ 2H2O
Пример 2. 2AgNO3 + Na2S = Ag2S + 2NaNO3
2Ag+
+ 2NO![]() + 2Na+
+ S-2
= Ag2S
+ 2Na+
+ 2NO
+ 2Na+
+ S-2
= Ag2S
+ 2Na+
+ 2NO![]()
