
- •Тема 1. Периодическая система и строение атомов
- •Темы 2-3. Химическая связь. Строение вещества в конденсированном состоянии
- •Метод валентных связей
- •Теория гибридизации
- •Метод молекулярных орбиталей
- •Тема 4. Скорость химических реакций, основные понятия термодинамики
- •Обратимость химических реакций.
- •Смещение химического равновесия
- •Химическая термодинамика
- •Тема 5. Растворы
- •Способы выражения концентрации растворов
- •Коллигативные свойства растворов
- •Тема 6. Растворы электролитов
- •Сильные электролиты (уравнения диссоциации)
- •Слабые электролиты (уравнения диссоциации)
- •Теория сильных электролитов
- •Теория слабых электролитов
- •Ионные уравнения реакций
- •Тема 7. Равновесия в растворах, протолитическое равновесие, гидролиз солей Диссоциация воды. Водородный и гидроксильный показатели
- •Произведение растворимости
- •0,01 Моль 0,01 моль 0,01 моль
- •Гидролиз солей
- •Описание гидролиза как обратимого процесса
- •Тема 8. Окислительно-восстановительные реакции и электрохимия
- •Метод электронного баланса
- •Метод полуреакций (электронно-ионного баланса)
- •Электрохимические процессы
- •Электродные потенциалы
- •Гальванические элементы
- •Аккумуляторы
- •Электролиз
- •Тема 9. Химическая связь в комплексных соединениях
- •Координационная теория Вернера
- •Номенклатура комплексных соединений
- •Диссоциация комплексных соединений
- •Природа химической связи в комплексах
Темы 2-3. Химическая связь. Строение вещества в конденсированном состоянии
Основным объектом изучения химии являются химические процессы (химические реакции). В ходе любой химической реакции происходит изменение химических связей между атомами (старые связи исчезают, новые - появляются). Поэтому понятие химической связи является, пожалуй, наиболее важным понятием химии.
Химическая связь - это взаимодействие атомов по законам квантовой механики, при котором:
1. Происходит перекрывание валентных орбиталей атомов.
2. Происходит обобществление валентных электронов взаимодействующих атомов.
3. Понижается общая энергия системы (под системой понимается: молекула, сложный ион, радикал, кристалл).
Деление химической связи на типы появилось до объяснения ее с позиций квантовой механики. Деление это условно. Различают 3 основных типа химических связей (ионная, ковалентная, металлическая) и 1 дополнительный тип (водородная). Следует учитывать, что в ряде веществ химическая связь не может быть отнесена к определенному типу. Например, в кристалле FeO связь ионно-ковалентная, в чистом железе - связь ковалентно-металлическая, а в соединении Fe3C - ионно-ковалентно-металлическая. Тем не менее, в первом приближении можно условно считать, что в FeO и Fe3C связь в основном ионная, а в Fe - металлическая.
Представления о типах химических связей появились в начале ХХ века, когда среди химиков было модно мнение о том, что атомы в ходе взаимодействия “стремятся” приобрести законченную электронную оболочку инертного (благородного) газа: He, Ne, Ar, Kr, Xe, Rn.
Ионная связь. Рассмотрим взаимодействие между двумя атомами, один из которых является типичным металлом (например, натрий), а другой - сильным неметаллом (например, хлор). Валентные электроны атомов изобразим точками:

Как видно из
приведенной схемы, натрий отдает хлору
свой единственный валентный электрон
и становится ионом Na+
с электронным строением , как у инертного
газа неона. В то же время хлор, принимая
один дополнительный электрон, становится
ионом Cl![]() ,
у которого строение электронных оболочек
аналогично аргону. Между ионами Na+
и Сl
,
у которого строение электронных оболочек
аналогично аргону. Между ионами Na+
и Сl![]() возникает электростатическое притяжение,
которое называется ионной связью.
Аналогичным образом можно объяснить
появление ионной связи в любой паре
атомов металл - неметалл.
возникает электростатическое притяжение,
которое называется ионной связью.
Аналогичным образом можно объяснить
появление ионной связи в любой паре
атомов металл - неметалл.
На основании теории ионной связи в химию было введено понятие о степени окисления, как заряда атома, появляющегося в результате образования ионной связи. Позднее, специальными физическими исследованиями, было показано, что реальные заряды на атомах не соответствуют тем зарядам, которые вытекают из теории ионной связи. Так, например, в кристаллическом хлориде натрия натрий имеет реальный заряд +0,85, а хлор -0,85 (вместо +1 и -1). Это означает, что связь в данном соединении является ионной только на 85 %, а на 15 % это ковалентная связь.
И вообще, для того, чтобы связь в веществе была “чисто” ионной, необходимо, чтобы энергия сродства к электрону неметалла была больше энергии ионизации металла. Ни для одной пары металл - неметалл это условие не выполняется. Поэтому можно говорить о том, что в соединениях, образованных достаточно сильными металлами и неметаллами химическая связь носит преимущественно ионный характер.
Ковалентная связь. Ковалентная связь возникает между атомами неметаллов. Это самый распространенный тип химического взаимодействия. Во всех органических и во многих неорганических веществах присутствует ковалентная связь.
В ходе взаимодействия двух атомов неметаллов каждый из них “стремится завершить” свою электронную оболочку посредством присоединения электронов. Это может произойти, если все или часть валентных электронов станут общими для этих двух атомов:
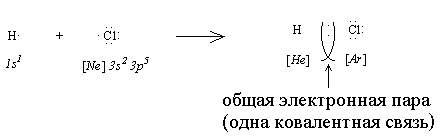
В результате такого взаимодействия образуется общая электронная пара, которая обеспечивает одну ковалентную связь. В рассмотренном примере взаимодействующие атомы отличаются по электроотрицательности (ОЭО (Н) = 2,1; ОЭО (Сl) = 3,5), поэтому общая электронная пара смещается в сторону более электроотрицательного хлора и на атомах появляются заряды (H +0,17 Cl -0,17). Такое явление называется поляризацией ковалентной связи, а сама связь называется ковалентной полярной.
Степень полярности
связи характеризует дипольный момент
связи. Диполем называется система из
двух зарядов, одинаковых по абсолютной
в
 еличине
и противоположных по знаку. Дипольный
момент (
) - это вектор, направленный от центра
отрицательного заряда к центру
положительного заряда. Длина этого
вектора находится по уравнению:
еличине
и противоположных по знаку. Дипольный
момент (
) - это вектор, направленный от центра
отрицательного заряда к центру
положительного заряда. Длина этого
вектора находится по уравнению:
= l ,
где l - расстояние между положительным и отрицательными зарядами (эта величина всегда меньше, чем длина связи); - заряд одного из атомов.
Абсолютное значение дипольного момента связи обычно выражают в единицах Дебая (1Д = 3 10-29 Кл м). Например, молекулу хлороводорода можно представить как диполь Н+0,17 Cl-0,17 со значением = 0,19 Д. Так как молекула состоит только из двух атомов, то для нее понятия дипольный момент связи и дипольный момент молекулы совпадают.
Для молекул, состоящих из 3-х и более атомов, дипольный момент молекулы равен векторной сумме дипольных моментов всех связей (по правилу параллелограмма). Так, в молекуле Н2О две связи Н-О с = 1,58 Д. Угол между этими связями (валентный угол) равен 10530. После сложения получаем (Н2О) = 1,84 Д.
Если взаимодействующие атомы имеют одинаковую электроотрицательность (H2; O2; NCl3; S8 и т.д.) или отличаются по электроотрицательности очень мало (CH4; PH3; NВr3 и т.д.), то связи между ними являются ковалентными неполярными. Дипольный момент таких связей равен нулю.
Ковалентная связь может образоваться по двум механизмам: обменному и донорно-акцепторному. В случае обменного механизма при образовании связи каждый из двух взаимодействующих атомов отдает на связь один электрон. Рассмотренный выше пример взаимодействия атомов водорода и хлора соответствует этому механизму. Обменный механизм является самым распространенным способом образования ковалентной связи.
Донорно-акцепторный механизм осуществляется не так часто, причем, между двумя атомами, как правило, не может появиться более одной связи, образованной этим способом:
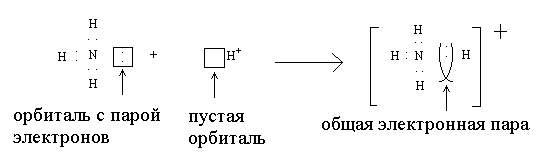
Атом, представляющий для связи орбиталь с двумя валентными электронами, называется донором (в приведенном примере это азот), а атом, дающий на связь только пустую орбиталь, называется акцептором (ион водорода).
Металлическая связь. Рассмотрим возможность взаимодействия между атомами типичных металлов (например, двумя атомами натрия) с точки зрения их “стремления к завершению” электронной оболочки:

Попарное взаимодействие в этой системе невозможно, поэтому связь в данном случае не может быть ковалентной или ионной. Для появления металлической связи все атомы натрия, находящиеся в кристалле металла должны отдать по одному валентному электрону и превратиться в ионы с “завершенной” электронной оболочкой благородного газа - неона. Ионы натрия образуют кристаллическую решетку, а их валентные электроны являются теперь общими для всех атомов в кристалле. Эти общие электроны обеспечивают одну металлическую связь, охватывающую весь кристалл. В пределах кристалла валентные электроны, обеспечивающие металлическую связь, могут перемещаться практически беспрепятственно, поэтому их называют свободными (точнее - квазисвободными) или - “электронным газом”.
Металлическая связь по своей природе является ненасыщенной, так как в образовании ее может принять участие любое число атомов металлов. Она ненаправлена и многоэлектронна, т.к. ее может обеспечивать любое достаточно большое число электронов. По этим свойствам металлическая связь является противоположностью ковалентного взаимодействия, которое направленно, насыщенно и строго двухэлектронно.
Металлическая связь в “чистом” виде существует только в кристаллах щелочных и щелочно-земельных металлов. В случае d- и f- металлов, кроме металлической связи между атомами, имеет место ковалентное взаимодействие за счет валентных d- и f- электронов, а также свободных d- и f- орбиталей.
Именно наличие металлической связи в веществе определяет его особые механические (пластичность, ковкость), электрические (огромная электропроводность с отрицательным температурным коэффициентом) и оптические (высокая отражательная способность в видимой части спектра) свойства.
Подобно ионной, металлическая связь может существовать только у веществ в конденсированном состоянии (твердом или жидком).
Водородная связь.
Водородная связь является дополнительным типом химического взаимодействия. Она появляется только при взаимодействии положительно поляризованного атома водорода и отрицательно поляризованного атома очень сильного неметалла (обычно это фтор или кислород). При этом атомы водорода и сильного неметалла не должны быть связаны другими связями друг с другом.
П римеры
систем с водородными связями (обозначены
точками):
римеры
систем с водородными связями (обозначены
точками):


В первых трех случаях водородная связь является межмолекулярной, в последнем (салициловый альдегид) - внутримолекулярной.
Присутствие водородной связи в веществах влияет на его физические и физико-химические свойства. Расчет показывает, что если бы между молекулами воды отсутствовало сильное водородное взаимодействие, то вода имела бы температуру плавления -100 С, а температуру кипения -80 С.
Хорошая растворимость многих веществ в воде так же часто определяется возникновением водородных связей между растворителем (водой) и растворяющимся веществом (различные кислоты, этиловый спирт, сахар и т.д.).
Огромную роль водородная связь играет в биологических процессах. Она определяет пространственную структуру макромолекул ДНК, РНК, белков, многие процессы в живых организмах протекают с участием водородных связей.
Следует отметить, что из всех типов химической связи, водородная является самой слабой. Так, водородная связь между молекулами воды на порядок слабее ковалентной связи кислород - водород в этих же молекулах.
