
- •Тема 1. Периодическая система и строение атомов
- •Темы 2-3. Химическая связь. Строение вещества в конденсированном состоянии
- •Метод валентных связей
- •Теория гибридизации
- •Метод молекулярных орбиталей
- •Тема 4. Скорость химических реакций, основные понятия термодинамики
- •Обратимость химических реакций.
- •Смещение химического равновесия
- •Химическая термодинамика
- •Тема 5. Растворы
- •Способы выражения концентрации растворов
- •Коллигативные свойства растворов
- •Тема 6. Растворы электролитов
- •Сильные электролиты (уравнения диссоциации)
- •Слабые электролиты (уравнения диссоциации)
- •Теория сильных электролитов
- •Теория слабых электролитов
- •Ионные уравнения реакций
- •Тема 7. Равновесия в растворах, протолитическое равновесие, гидролиз солей Диссоциация воды. Водородный и гидроксильный показатели
- •Произведение растворимости
- •0,01 Моль 0,01 моль 0,01 моль
- •Гидролиз солей
- •Описание гидролиза как обратимого процесса
- •Тема 8. Окислительно-восстановительные реакции и электрохимия
- •Метод электронного баланса
- •Метод полуреакций (электронно-ионного баланса)
- •Электрохимические процессы
- •Электродные потенциалы
- •Гальванические элементы
- •Аккумуляторы
- •Электролиз
- •Тема 9. Химическая связь в комплексных соединениях
- •Координационная теория Вернера
- •Номенклатура комплексных соединений
- •Диссоциация комплексных соединений
- •Природа химической связи в комплексах
Описание гидролиза как обратимого процесса
Гидролиз по катиону и гидролиз по аниону являются обратимыми процессами. Если при совместном гидролизе не происходит выделение газа или образование осадка, то это то же обратимый процесс.
Если гидролиз является обратимым процессом, то для него можно ввести понятие о константе равновесия:
CO![]() + H2O
+ H2O
![]() HCO
HCO![]() + OH-
,
+ OH-
,
Kp
=
![]() .
.
В разбавленных растворах солей концентрацию молекул воды можно считать практически постоянной (H2O) 55 моль / л и получить другую константу равновесия (константу гидролиза):
Kг
I = Kp
[H2O]
=
![]() ,
,
где Кг I - константа гидролиза карбонат-аниона (по первой ступени).
Величину константы гидролиза можно рассчитать, исходя из константы воды (К = 10-14) и константы диссоциации слабого электролита по одной из ступеней:
Kг
I =
 ,
,
где К = [H+]
[OH-]
= 10-14;
Kд II
=
![]() -константа диссоциации угольной кислоты
по второй ступени.
-константа диссоциации угольной кислоты
по второй ступени.
Глубину протекания гидролиза описывает степень гидролиза (h) - это отношение числа частиц, подвергшихся гидролизу к общему количеству гидролизующихся частиц в растворе.
Степень гидролиза (h) зависит от концентрации гидролизующихся частиц по уравнению:
Kг
1 =
 ,
,
где Кг1 - константа гидролиза по первой ступени;
h1 - cтепень гидролиза по первой ступени;
с1 - концентрация частиц, гидролизующихся по первой ступени (в нашем
примере с1
= [CO![]() ]).
]).
Так как степень гидролиза даже по первой ступени обычно заметно меньше, чем 0,1 , то данное выражение можно упростить:
h1
=
![]() .
.
Аналогичные соотношения имеют место и для второй ступени гидролиза:
HCO![]() + H2O
+ H2O
![]() H2CO3
+ OH-
,
H2CO3
+ OH-
,
Kг
II
=
 ,
,
где Кd I - константа диссоциации угольной кислоты по первой ступени.
h2
=
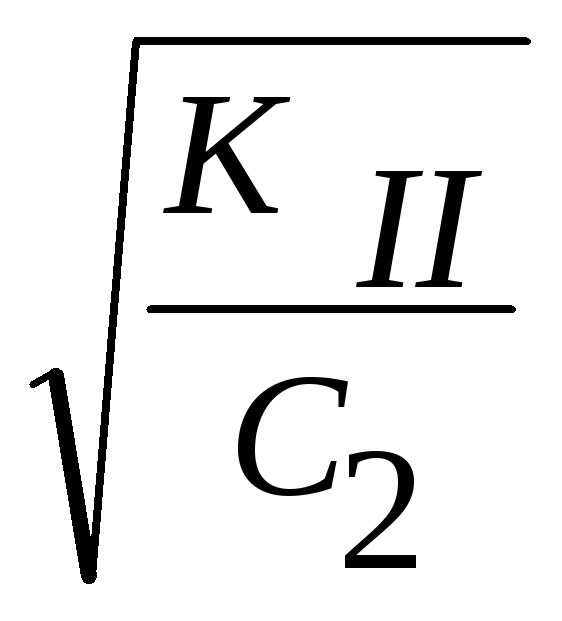 ,
где c2
= [HCO
,
где c2
= [HCO![]() ]
]
Тема 8. Окислительно-восстановительные реакции и электрохимия
Окислительно-восстановительными реакциями (ОВР) называются химические процессы, в ходе которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим частицам (атомам, молекулам, ионам).
Окислителем называется частица, принимающая электроны от другой частицы. Восстановителем называется частица, отдающая свои электроны другой частице.
Окисление - это процесс отдачи электронов.
Восстановление - это процесс присоединения электронов. Из этих определений следует, что в ходе ОВР окислитель восстанавливается, а восстановитель - окисляется.
В настоящее время наибольшее распространение получили 2 метода составления уравнений ОВР.
а) метод электронного баланса;
б) метод полуреакций (или ионно-электронного баланса).
Метод электронного баланса
Данный метод основан на представлении о степени окисления атома в веществе. Степень окисления - это условный заряд атома, найденный исходя из предположения, что все связи в веществе чисто ионные. Степень окисления обозначается арабской цифрой со знаком (+) или (-).
Ионной связи в чистом виде в природе не существует. Например, в кристаллическом хлориде натрия (NaCl), натрий имеет реальный заряд +0,8 , а хлор (-0,8) заряда электрона по модулю. Отсюда следует, что степени окисления натрия (Na+) и хлора (Cl-) являются понятием формальным.
Тем не менее, метод электронного баланса в настоящее время широко используется, так как он наиболее прост и универсален. Практически единственным ограничением этого метода является то, что он позволяет уравнивать только полные схемы реакций.
Правила нахождения степеней окисления
Для применения метода электронного баланса необходимо знать степени окисления всех атомов в формулах веществ (исходных и продуктов реакции). Степени окисления находятся с использованием следующих правил:
1. Cтепень окисления атома в простом веществе равна нулю:
H![]() ;
N
;
N![]() ;
Mg
;
Mg![]() ;
C
;
C![]() и т.д.
и т.д.
2. Сумма степеней окисления всех атомов в формульной единице вещества (молекуле) равна нулю.
K![]() Cr
Cr![]() O
O![]() 2
(+1) + 2
(+6) + 7
(-2) = 0
2
(+1) + 2
(+6) + 7
(-2) = 0
Чтобы воспользоваться этим правилом необходимо запомнить перечень химических элементов, атомы которых во всех (или почти во всех) их соединениях имеют одну и ту же степень окисления.
|
Степень окисления атома элемента в соединениях |
Исключения |
|
Li+, Na+, K+, Rb+, Cs+, Fr+ |
|
|
Be+2, Mg+2, Ca+2, Sr+2, Ba+2, Ra+2 |
|
|
Al+3, Ga+3, Zn+3 |
Al+, Ga+, Zn+ - очень редко |
|
Ag+, Zn+2, Cd+2 |
Ag+2 - очень редко |
|
F- |
|
|
H+ |
H- - в гидридах (NaH и т.п.) |
|
O-2 |
O- - в пероксидах (H2O2,, K2O2 и т.п.) O-1/2 - в надпероксидах (KO2 и т.п.) O-1/3 - в озонидах (KO3) O+, O+2 - во фторидах кислорода (O2F2, OF2) |
Возвратимся к
приведенному выше примеру: K![]() Cr
Cr![]() O
O![]() .
.
Cтепени окисления калия и кислорода найдены по таблице. Далее применяем правило электронейтральности молекулы: 2 (+1) + 2 x + 7 (-2) = 0. Отсюда: x = +6.
3. Степени окисления атомов в кислотных остатках такие же, как в соответствующих им кислотам. Это правило является следствием определения кислотного остатка: кислотный остаток - это часть молекулы кислоты, перешедшая в соль без изменений.
Пример: MnySxO![]() .
.
Вначале находим
х. Кислотный остаток (сульфат) соответствует
серной кислоте - H![]() S+6O
S+6O![]() .
.
Теперь, по правилу электронейтральности молекулы можно найти степень окисления марганца: y + 6 + 4 (-2) = 0; y = +2.
Алгоритм применения метода электронного баланса
1. Написать схему реакции. Схема реакции - это условное химическое выражение, в котором слева указаны исходные вещества, справа - известные продукты реакции. Между правой и левой частями схемы ставится знак “стрелка”. Схема может быть полной (известны все продукты) и неполной (известна только часть продуктов). Метод электронного баланса позволяет работать только с полными схемами. Единственным веществом, которое можно не указывать в схеме является вода.
Пример: Cu + HNO3 Cu(NO3)2 + NO + . . . .
(многоточие означает, что в правой и левой части окончательного уравнения может появиться вода).
2. Над каждым атомом в схеме поставить степени окисления:
Cu0
+ H+1N+5O![]()
Cu+2(N+5O
Cu+2(N+5O![]() )2
+ N+2O-2
+ . . . .
)2
+ N+2O-2
+ . . . .
3. Найти атомы, изменившие свои степени окисления. Составить для них уравнения электронных переходов:
Cu0
+ H+1N+5O![]()
Cu+2(N+5O
Cu+2(N+5O![]() )2
+ N+2O-2
+ . . . .
)2
+ N+2O-2
+ . . . .
Cu0
- 2![]() = Cu+2,
= Cu+2,
N+5
+ 3![]() = N+2
.
= N+2
.
4. Сделать электронный баланс (подобрать коэффициенты, на которые нужно умножить уравнения электронных переходов, чтобы число электронов, ушедших от восстановителей, было равно количеству электронов, принятых окислителем).
 Cu0
- 2
Cu0
- 2![]() = Cu+2
3
= Cu+2
3
N+5
+ 3![]() = N+2
2
= N+2
2
Из электронного баланса следует, что в левой части полученного уравнения на каждые 3 атома восстановителя (Cu+2) должно приходиться 2 атома окислителя (N+5). В правой части будущего уравнения на 3 атома Cu+2 должно приходиться 2 атома N+2.
5. В схеме реакции поставить первые коэффициенты в соответствии с электронным балансом (там, где это возможно !).
3Cu + HNO3 3Cu(NO3)2 + 2NO + . . . .
Обратите внимание: из четырех теоретически возможных коэффициентов указаны только три. Перед азотной кислотой коэффициент пока неизвестен, т.к. N+5 ведет себя сложным образом: с одной стороны принимает участие в ОВР (это учтено в электронном балансе), а с другой - переходит без изменений в нитрат меди (Сu(NO3)2) (это не учтено в электронном балансе, т.к. при этом степень окисления азота не меняется).
6. Уравнять по всем атомам, кроме водорода и кислорода. При этом произвольное изменение коэффициентов, полученных из электронного баланса недопустимо.
3Cu + 8 HNO3 3Cu(NO3)2 + 2NO + . . . .
7. Уравнять по водороду. Это делается только одним способом: добавлением соответствующего числа молекул воды в ту часть схемы, где водорода не хватает. В данном примере слева 8 атомов водорода, а справа - нуль. Молекула Н2О содержит 2 атома водорода:
3Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O.
8. Полученное выражение должно быть уравнением ОВР, если до того не было допущено ошибки. Необходимо проверить данное уравнение по кислороду. Если справа и слева количество атомов кислорода одинаково, вместо “стрелки” ставим знак “равно” (это уравнение). Если по кислороду не сошлось, то следует повторить уравнивание, начиная с пункта 1.
Окончательное уравнение:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
