
Лекции Шилко УГМА 2 том
.pdfПри более позднем начале заболевания преобладают возбудители, попавшие к ребенку в результате перекрестного инфицирования через руки персонала, оборудование, предметы ухода, т.е. госпитальные штаммы микробов. Среди госпитальных штаммов преобладают грамотрицательные бактерии – клебсиеллы, эшерихии, синегнойная палочка, ацинетобактеры, протеи. Однако в последние годы все чаще выявляются стафилококки: золотистый и эпидермальный коагулазаотрицательный. Также у детей с сепсисом часто выделяют микробномикробные, вирусно-микробные, грибково-бактериальные ассоциации.
Возбудители, вызывающие сепсис, обладают особыми свойствами:
1.Возбудителями сепсиса чаще являются госпитальные штаммы микробов, изменившиеся по своей биологической сути, с повышенной вирулентностью (т.е. высокой степенью инфективности, инвазивности и токсигенности) и устойчивостью к антибиотикам. Нередко на их поверхности обнаруживаются антигенные метки человека, которые затрудняют распознавание возбудителя. Антигенные метки человека позволяют возбудителю «уходить» от действия иммунологических реакций, т.е. мимикрировать.
2.Кровь больного сепсисом является не только транспортером бактерий, но и местом их размножения, т.е. кровью утрачивается способность уничтожать микробы. Этим септицемия и отличается от бактериемии.
3.Наличием суперантигенов, активирующих огромное количество Т-лимфоцитов, вызывая массивный синтез ими лимфокинов (в частности интерлейкина-2), лихорадку, острые расстройства пищеварения и шок. Такие суперантигены выявлены у стафилококков, некоторых стрептококков, менингококков и пневмококков.
4.Эндотоксины грамотрицательных микробов (липополисахариды, липопротеид А) способны стимулировать мононуклеарные фагоциты с соответствующим спектром цитокинов. Одновременно происходит активация В-лимфоцитов, тромбоцитов и эндотелиоцитов. В результате формируется синдром системного воспалительного ответа
(ССВО, SIRS – systemic inflammatory response syndrome). Следует от-
метить, что чувствительность новорожденных детей к эндотоксинам бактерий повышена из-за низкого уровня в крови белка, связывающего эндотоксины.
По данным литературы, на первом месте среди возбудителей, приводящих к летальному исходу от сепсиса, стоит Pseudomonas aerugenosa – 72,7%.
Патогенез. Как указывалось выше, в патогенезе развития сепсиса у новорожденных имеет большое значение взаимодействие двух
21
систем – микроорганизма (его вида, количества, фертильности, биохимической изменчивости) и макроорганизма с его особенностями иммунологической реактивности. Именно от взаимодействия этих двух систем и решается вопрос «быть или не быть» сепсису, а также зависит, по какому патогенетическому пути пойдет развитие патологического процесса.
Входными воротами инфекции у новорожденных детей могут быть следующие: пупочная ранка, поврежденные кожные покровы и слизистые оболочки (на месте инъекций, катетеризаций, интубаций, зондов), кишечник, легкие, мочевыводящие пути, глаза и очень редко
– среднее ухо.
Когда входные ворота инфекции не установлены, говорят о криптогенном сепсисе.
Источниками инфекции могут быть мать, персонал, больной ребенок.
Пути передачи инфекции, как уже указывалось выше, – это родовые пути матери, руки персонала, аппаратура, инструментарий, предметы ухода за детьми. Установлено, что госпитальные штаммы стафилококка легко приживаются на слизистой оболочке носа у медицинского персонала. При чихании, кашле и разговоре стафилококк выделяется в воздух помещений, оседает на предметах, с током воздуха переносится из одного помещения в другое. Более сложен механизм передачи грамотрицательных условно-патогенных бактерий. Эти микроорганизмы плохо переносят высушивание, но хорошо сохраняются и размножаются в условиях влажной среды. Поэтому через руки персонала они попадают в такие резервуары, как увлажнители клинических инкубаторов, кислорода, ингаляционные трубки, на раковины, мыльницы, посуду «молочных» комнат и в растворы для питья.
При врожденной септицемии очаг инфекции находится в плаценте или организме матери. Конкретными первичными очагами инфекции для плода могут служить плацентит или инфицированный амнион.
По современным представлениям, в основе патогенеза сепсиса лежит непрекращающееся размножение возбудителя в условиях неадекватной защиты, дисбаланса про- и противовоспалительных гуморальных и клеточных факторов. Многочисленные иммунологические исследования показали, что наиболее типичными проявлениями сепсиса являются незавершенность фагоцитоза и несостоятельность других «барьерных» механизмов. В борьбе с инфекцией нейтрофилы активно поглощают микроорганизмы, но не могут их полностью фагоцитировать. В начале действие микроорганизмов вызывает в организме локальную продукцию провоспалительных медиаторов эндогенно-
22
го происхождения в очаге воспаления и регионарных лимфоидных органах. Затем малое количество медиаторов выбрасывается в системный кровоток. При сепсисе уже на этом этапе наблюдается дисбаланс между провоспалительными (интерлейкины IL-1, IL-6, IL-8, фактор некроза опухоли – TNF и др.) и противовоспалительными (интерлейкины IL-4, IL-10, IL-13, растворимые рецепторы к TNF и др.) факторами. На фоне дисбаланса наступает генерализация воспалительной реакции. Цитокины попадают в системный кровоток и накапливаются в количестве, позволяющем проявить свои деструктивные эффекты.
Следующим патогенетическим звеном сепсиса и септического шока является нарушение функционального состояния эндотелия сосудов. Последний синтезирует большое количество первичных и вторичных медиаторов, активирующих другие клетки (нейтрофилы, моноциты, тромбоциты). Суммарные эффекты, оказываемые медиаторами, формируют системную воспалительную реакцию или синдром системного воспалительного ответа – ССВО (SIRS). Это результат активации системы провоспалительных цитонинов (ИЛ-1.ФНОа, ил-6, ил-8, интерферон и пр.), их избыточной продукции, приводящей к выбросу в циркуляцию огромного количества субстанций (медиаторов), характеризующихся особой силой и хаотичностью – «медиаторноцитониновая буря».
В свою очередь, ССВО (SIRS) индуцирует запуск синдрома компенсаторного противовоспалительного ответа (СПВО = CARS). Данный синдром опосредован продукцией противовоспалительных цитоканов (ИЛ-4,ИЛ-10, ИЛ=13, рецепторных антогонистов к ИЛ-1, ТФР). СПВО (CARS) направлены на снижение синтеза и моделяцию эффектов провоспалительных медиаторов, ослабление проявлений генерализованного воспаления и восстановление исходного гомеостаза. Однако чрезмерная выраженность и прогнозированное течение СПВО (CARS) вызывают иммунодепрессию и ареактивность.
Антогонизм между ССВО и СПВО проводит к развитию смешанного синдрома, основным проявлением которого является полиорганная недостаточность (СПОН = MODS) и апоптоз.
Собственно суть понятия септического процесса и сводится к взаимодействию ССВО и СПВО.
Превалирование ССВО (SIRS) – компонента проявляется в кардиоваскулярной компрометации (септический шок, коллапс, стимулированный апоптоз). Превалирование СПВО (CARS) ведет к супрессии иммунной системы и выражается в анэргии и повышенной чувствительности к инфекции.
23
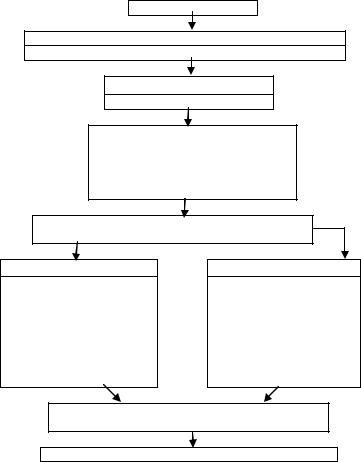
Системное поражение эндотелия приводит к активации всех протеолитических систем плазмы, в том числе и тромбиновой, что индуцирует диссеминированное внутрисосудистое свертывание (ДВС). Этот синдром является непременным звеном патогенеза септического процесса и проявляется как тромбогеморрагическими расстройствами, так и полиорганной недостаточностью. Схема патогенеза септического шока представлена на рисунке 1.
БАКТЕРИИ
Эндотоксины, Экзотоксины
Липополисахариды, энтеротоксины пептидогликаны и др.
Белки, переносящие токсины
ЛПС-связывающий белок
переносит ЛПС
К моноцитам
Макрофагам
Нейтрофилам
Эндотелиальным клеткам
TNF TNF Секреция (гиперпродукция) клетками цитокинов, медиаторов и рецепторных молекул
Провоспалительных
ТНФ (TNF) туморнекротизирующий фактор;
ИЛ-1,3,6,12;
Простагландины, Лейкотриены,
ФАТ (TNF)-фактор активации тромбоцитов NO, О2-производные
Противовоспалительных
ИА-4,10,13; антагонисты рецепторов ИАН и рецепторов TNF
СПОН Синдром полиорганной недостаточности
Иммунный паралич (анэргия), инфекция, апоптоз
Рис 1. Схема патогенеза сепсиса (и септического шока)
24
Клиническая картина. Клиницисты давно обратили внимание, что сепсис у детей протекает по-разному, т.е. является гетерогенным. Еще в 1956 г. М.С.Маслов писал, что «течение септических заболеваний разнообразно. Есть молниеносные формы, оканчивающиеся в короткое время смертью, есть подострые и хронические формы, длящиеся много недель. Иногда картина настолько бывает нехарактерной, что не представляется возможности установить точный диагноз».
Следует заметить, что специфических симптомов сепсиса нет. К наиболее ранним и частым симптомам сепсиса у новорожденного ребенка относятся утрата коммуникабельности, летаргия или гипервозбудимость. Наряду с местными симптомами гнойного очага на месте входных ворот, обращают на себя внимание признаки токсикоза. Наблюдаются снижение аппетита или анорексия, остановка или резкая убыль в массе, повышение температуры тела, неустойчивый стул, вздутие живота, одышка, тахикардия, приглушение тонов сердца, периоральный цианоз, акроцианоз, быстрая охлаждаемость при осмотре, бледность с сероватым или желтушным оттенком.
Впоследствии формируется так называемый «септический хабитус» больного: анорексия, срыгивания, часто с желчью, рвота, неустойчивый стул, повышенная или пониженная температура тела. Ребенок беспокоен, быстро истощается, вялый, подстанывает, отсутствует спонтанная двигательная активность. Черты лица заострены, выражение лица «сердитое» или амимичное. Кожный покров серобледный, часто с желтизной, геморрагиями, гнойничками. Тургор мягких тканей снижен. Живот вздут, передняя брюшная стенка отечна, с расширенной венозной сетью, печень и селезенка увеличены.
У новорожденных детей велика вероятность развития септического шока. В этом случае вначале появляется возбуждение, беспокойство, одышка и тахикардия, вздутие живота. За короткое время нарастает сердечно-сосудистая недостаточность – усиливаются одышка и тахикардия, расширяются границы сердечной тупости, наблюдается приглушение тонов сердца, появляется систолический шум, цианоз, пастозность или отеки мягких тканей. Одновременно нарастает вялость, заторможенность ребенка, периодически могут быть беспокойство и судороги. Характерны серость и мраморность кожи. Развивается ДВС-синдром: геморрагии на коже, кишечные и легочные кровотечения, кровоточивость на месте инъекций, почечная и надпочечниковая недостаточность. При септическом шоке летальный исход может наступить в течение суток. Летальность очень высока – до 80% и более.
При одновременном поражении у новорожденного ребенка не менее двух систем органов следует говорить о полиорганной недоста-
25
точности (ПОН). Критериями органной недостаточности служат клинические и лабораторные признаки респираторной, почечной, печеночной, сердечно-сосудистой, гемокоагуляционной, желудочнокишечной, неврологической, эндокринной и иммунной недостаточности. Несмотря на активную антибактериальную и другую комплексную терапию, симптомы токсикоза и полиорганной недостаточности у больных сепсисом сохраняются или даже нарастают.
Диагностика сепсиса базируется на данных анамнеза, клиники и дополнительных исследований. Важно понять, что диагноз бактериального сепсиса у новорожденных детей, прежде всего клинический. Для постановки диагноза у больного следует выявить перечисленные выше анте- и интранатальные факторы высокого риска развития сепсиса. В плане клинических и лабораторных данных важно определить наличие критериев синдрома системного воспалительного ответа (ССВО):
1.Расстройства температурного гомеостаза у ребенка (гипертермия >38ºС или гипотермия <36ºС).
2.Одышка или тахипноэ более 60 в 1 мин.
3.Тахикардия (более 160 сокращений в 1 мин) или брадикардия (менее 110 ударов в мин).
4.Утрата коммуникабельности, синдром угнетения и/или судороги, а также анорексия.
5.Олигурия на фоне адекватной инфузионной терапии. Лабораторные признаки ССВО инфекционного генеза:
1.Внезапно развившийся тяжелый метаболический лактат-
ацидоз.
2.Лейкоцитоз или лейкопения с нейтрофиллезом или нейтро-
пения.
3.Сдвиг нейтрофилов до палочкоядерных и более молодых
форм.
4.Токсическая зернистость нейтрофилов.
5.Тромбоцитопения.
6.Прогрессирующая анемия.
7.Внезапно возникшее укорочение или удлинение частичного тромбопластинового времени (АЧТВ) или протромбинового времени
(ПТВ).
8.Повышение уровня С-реактивного протеина и других острофазовых белков.
9.Гипергликемия более 6,5 ммоль/л на фоне адекватной инфузионной терапии.
10.Гиперкалиемия более 7 ммоль/л.
26
11. Бактериемия.
Бактериологическое обследование при подозрении на сепсис делают повторно не менее 3 раз. Посевы забирают из любого материала, который может быть получен у больного: крови, мочи, гноя, слизи из зева, стула, желудочного содержимого, наружного слухового прохода, цереброспинальной жидкости. Диагноз сепсиса можно считать бактериологически подтвержденным, если из материала, взятого из трех разных мест, высевается один и тот же микроб или ассоциация микробов. Для сепсиса характерны повторные высевы резистентных ко многим антибиотикам микробов из многих биологических сред организма. Септической считается бактериемия, превышающая 10³ колоний в 1 мл. Тем не менее, даже при патологоанатомически подтвержденном сепсисе частота высева микроба из крови не превышает 60%.
Следует еще раз заметить, что абсолютного симптома или лабораторного признака сепсиса нет. В настоящее время сепсис диагностируется у детей по наличию следующих факторов: А) факторов высокого риска, Б) клиническими признаками ССВО, В) сочетанием с любым из четырех лабораторных признаков.
В комплекс обследований входит динамическое наблюдение за показателями общего анализа крови (быстро прогрессирует анемия, лейкоцитоз или лейкопения с нейтрофиллезом и палочкоядерным сдвигом влево, токсическая зернистость нейтрофилов, тромбоцитопения, значительное увеличение СОЭ), при выраженной тромбоцитопении проводится исследование гемостаза. Изменения в гемокоагулограмме отражают степень повреждения эндотелия и нарушений микроциркуляции. Исследуется общий анализ мочи. Определяется общий белок и фракции, параметры КОС, электролитов. Показатели мочевины и креатинина позволяют оценить функцию почек; билирубина, ферментов – функцию печени.
Необходимо иммунологическое обследование для оценки резервных возможностей организма ребенка. Результаты исследований последних лет свидетельствуют о том, что высокой диагностической информативностью в плане постановки диагноза сепсиса обладают сывороточные концентрации С-реактивного протеина, прокальцийтонина, интерлейкина-8 и преальбумина. Повышение данных показателей расценивается как наличие системного воспаления и является основанием для своевременного назначения ребенку антибактериальной терапии. Нормализация показателей системного воспаления дает основание к прекращению курса антибиотиков.
Классификация сепсиса. Отечественная традиционная классификация неонатального сепсиса является рабочей. Согласно данной
27
классификации в диагнозе должны быть отражены следующие данные: время инфицирования (интранатальное, постнатальное); этиология; входные ворота инфекции; форма (септицемия, септикопиемия); ведущие септические очаги; течение (молниеносное, острое, подострое); период болезни (начальный, разгара, восстановительный, реабилитации); осложнения (ДВС-синдром, тромбоэндокардит, гипотрофия, анемия, гипербилирубинемия, непроходимость кишечника, почечная, печеночная, надпочечниковая недостаточность и др.).
Классификация сепсиса у новорожденных детей, принятая в отечественной медицине, несколько расходится с общепризнанной международной классификацией сепсиса. В международной классификации выделены такие понятия как SIRS (Cиндром системной воспалительной реакции) и бактеремия, которые могут существовать у больного самостоятельно и далеко не всегда связаны с сепсисом. Локальный (местный) очаг инфекции также часто существует самостоятельно. Более того, возможно течение локальной инфекции с кратковременной бактериемией (например, пневмония с бактериемией), но этого недостаточно для постановки диагноза сепсис. При сепсисе у больного наряду с клинико-лабораторными признаками инфекции обязательно присутствует SIRS. В настоящее время определение сепсиса не привязывают к наличию гнойно-воспалительных очагов. Особенно это касается новорожденных детей, у которых часто при отсутствии прижизненного выявления локальных очагов воспаления на аутопсии обнаруживается яркая картина сепсиса.
Одним из наиболее острых дискуссионных вопросов, связанных с классификацией сепсиса у новорожденных детей, является вопрос о выделении понятий «сепсис – синдром», «тяжелый сепсис» и «септический шок».
«Сепсис – синдром системной воспалительной реакции на инвазию микроорганизмов» подразумевает наличие очага инфекции плюс два или более признака SIRS.
Диагноз «тяжелый сепсис» включает в себя сепсис плюс один из следующих критериев: нарушение сознания при отсутствии заболеваний ЦНС, концентрация лактата в артериальной крови более 1,6 ммоль/л или в венозной более 2,2 ммоль/л, выделение мочи менее 1 мл/кг/час в течение 2 ч.
Понятие «септический шок» включает в себя наличие сепсиса плюс артериальной гипотензии (АД при двух различных измерениях остается ниже возрастной нормы более чем на 1/3) на фоне назначения коллоидных и кристаллоидных растворов, а также инотропных и вазопрессорных препаратов.
28
Накопленный и описанный в последние годы клинический материал, новые данные о механизмах развития сепсиса вновь потребовали уточнения и корректировки ранее принятых критериев сепсиса у новорожденных детей. Именно поэтому в последние годы продолжается широкое и активное обсуждение вопросов классификации, диагностики и лечения неонатального сепсиса.
Основные принципы лечения сепсиса у новорожденных и детей раннего возраста. Прежде всего следует сказать, что лечение неонатального сепсиса требует больших экономических затрат, поскольку прогноз жизни и здоровья у ребенка с сепсисом во многом зависит от использования современных высокозатратных технологий выхаживания, сбалансированного энтерального и парентерального питания, качественной респираторной поддержки, мощной антибактериальной терапии и адекватной иммунокоррекции. Поскольку принципы выхаживания, вскармливания и оказания помощи при дыхательных нарушениях недоношенным детям изложены в соответствующей лекции, остановимся на особенностях детоксикационной, антибактериальной, а также иммунной терапии.
Современные методы детоксикации направлены на нейтрализацию и блокаду бактериальных токсинов, эндотоксинов и продуктов каскадной реакции системного воспаления. Кроме инфузионной терапии используются такие методы борьбы с токсикозом, как плазмоферез, гемосорбция. На высоте токсикоза больным назначают ингибиторы протеолитических ферментов (контрикал, гордокс, трасилол). При ДВС-синдроме – дезагреганты, свежезамороженную плазму.
При назначении антибактериальной терапии учитывается наиболее вероятная этиология сепсиса, а также результаты микробиологического мониторинга отделения, в котором находится больной. При сепсисе используется, как правило, деэскалационная терапия, поскольку патологический процесс у новорожденных развивается стремительно и не оставляет времени для микробиологической диагностики. Деэскалационная терапия предполагает выбор для стартового применения наиболее мощного и эффективного антибиотика с последующим переходом на антибиотик узкого спектра действия в зависимости от вида и чувствительности выделенного возбудителя. Последующий переход на терапию суженного спектра осуществляется через 48-72 ч по данным микробиологического исследования. Используется максимальная возрастная дозировка комбинации их, включающая в себя не менее двух антибиотиков. Назначаются разные пути введения: внутримышечно, внутривенно, местно, с помощью электрофоре-
29
за. Каждые 7-10 дней антибиотики меняются (при отсутствии эффекта – через 2 дня).
При появлении признаков тяжелой бактериальной инфекции в ранние сроки (1-3 сутки жизни) препаратами выбора являются ампициллин плюс аминогликозиды. В качестве альтернативных используются цефалоспорины 3-го поколения плюс аминогликозиды, а также ингибиторзащищенные карбоксипенициллины плюс аминогликозиды. При более позднем начале сепсиса эмпирически назначаются антибиотики, к которым, как правило, чувствительна госпитальная флора: цефалоспорины 3-го и 4-го поколений с антисенегнойным действием плюс аминогликозиды. При отсутствии клинического эффекта от применения и после получения результатов микробиологического исследования производится смена на карбапенемы, гликопротеиды, рифампицин, метронидазол.
Как указывалось выше, доказана ведущая роль особенностей иммунологической реактивности в клиническом течении и исходе сепсиса. Поэтому вторым важнейшим направлением терапии является иммунокоррекция. Из иммунокоррегирующих препаратов преимущество отдается стандартным (поливалентным) иммуноглобуллинам для внутривенного введения. Стандартные (поливалентные) иммуноглобулины содержат функционально активные антитела класса IgG. Основными биологическими функциями IgG являются своевременное распознавание чужеродной информации в виде антигена, специфическое взаимодействие с ним и последующая его элиминация. В Российской Федерации зарегистрированы и разрешены к применению такие препараты, как Интраглобин (Германия), иммуноглобулин нормальный человеческий (Россия), Октагам, Сандоглобуллин (Швейцария), Эндоглобуллин, Иммуноглобулин (Австрия), Вигам-ликвид, Вигам-С (Великобритания), Веноглобулин (Франция). Более эффективен при тяжелых бактериальных инфекциях и сепсисе у новорожденных и детей раннего возраста иммуноглобулин для внутривенного введения, обогащенный антителами класса IgM (Пентаглобин). Пентамерная структура антител класса IgM способствует их более сильному связыванию с бактериальными антигенами. Иммунные комплексы в виде IgM+бактерии значительно легче распознаются фагоцитами и быстрее элиминируются. При этом фагоцитоз, индуцированный IgM в 1000 раз активнее, чем опосредованный через IgG.
В настоящее время проведены клинические испытания и получена информация о высокой терапевтической эффективности препарата ронколейкин в комплексном лечении неонатального сепсиса. Рон-
30
