
- •Помогаев а.И.
- •Оглавление
- •1. Способы получения
- •1.1.5. Гидрогалогенирование сопряженных диенов
- •1.1.6. Замещение гидроксильной группы в спиртах на галоген
- •1.2. Способы получения винил- и арилгалогенидов
- •1.3. Способы получения дигалогенопроизводных
- •2. Химические свойства
- •2.1. Реакции нуклеофильного замещения (sn) в алкилгалогенидах
- •2.1.1. Механизм мономолекулярного нуклеофильного замещения (sn1)
- •2.1.2. Механизм бимолекулярного нуклеофильного замещения (sn2)
- •2.2. Особенности нуклеофильного замещения галогена в арилгалогенидах
- •2.2.1. Нуклеофильное замещение в неактивированных арилгалогенидах
- •2.2.2. Нуклеофильное замещение в активированных арилгалогенидах
- •2.3. Реакция дегидрогалогенирования
- •2.4. Восстановление галогенопроизводных
- •2.5. Реакции галогенопроизводных с металлами
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Гидратация алкенов
- •1.2. Гидролиз галогенопроизводных
- •1.3. Восстановление карбонильных соединений
- •1.4. Получение спиртов реакцией Гриньяра
- •1.5. Получение диолов и триолов
- •2. Химические свойства
- •2.1. Кислотно-основные свойства
- •2.2. Реакции спиртов с разрывом связи о-н
- •2.2.1. Алкилирование спиртов
- •2.2.2. Ацилирование спиртов
- •2.3. Реакции спиртов с разрывом связи с-о
- •2.3.1. Замещение гидроксильной группы на галоген
- •2.3.2. Образование простых эфиров (межмолекулярная дегидратация)
- •2.3.3. Внутримолекулярная дегидратация спиртов до алкенов
- •2.4. Окисление и дегидрирование спиртов
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Щелочной гидролиз арилгалогенидов
- •1.2. Щелочное плавление солей ароматических сульфокислот
- •1.3. «Кумольный» метод получения фенола
- •2. Химические свойства
- •2.1. Кислотно-основные свойства фенолов
- •2.2. Фенолы как нуклеофилы
- •2.2.1. Алкилирование и ацилирование фенолов по атому кислорода
- •2.2.2. Реакции электрофильного замещения
- •3. Задачи и упражнения
- •Альдегиды и кетоны
- •1. Способы получения
- •1.1. Окисление алкенов
- •1.1.1. Озонолиз алкенов
- •1.1.2. Окисление алкенов в присутствии хлорида палладия
- •1.2. Гидратация алкинов
- •1.3. Получение ароматических альдегидов и кетонов ацилированием аренов
- •1.4. Гидролиз геминальных дигалогенидов
- •1.6.3. Синтез кетонов из нитрилов карбоновых кислот реакцией Гриньяра
- •2. Химические свойства
- •2.1. Кислотно-основные свойства и кето-енольная таутомерия
- •2.2. Реакции нуклеофильного присоединения
- •2.2.1. Реакции с о-нуклеофилами
- •2.2.2. Реакции с s-нуклеофилами
- •2.2.3. Реакции с n-нуклеофилами
- •2.2.4. Реакции с с-нуклеофилами
- •2.3. Реакции енолизующихся альдегидов и кетонов с галогенами
- •2.4. Окисление и восстановление альдегидов и кетонов
- •2.4.1. Окисление альдегидов и кетонов
- •2.4.2. Восстановление альдегидов и кетонов
- •2.4.3. Реакция Канниццаро
- •3. Задачи и упражнения
- •Помогаев Александр Ильич
- •Часть 3
2.1.2. Механизм бимолекулярного нуклеофильного замещения (sn2)
Этот механизм представляет собой процесс нуклеофильного замещения, при котором разрыв связи углерод-галоген и образование связи с нуклеофилом происходят одновременно, а не последовательно, как в случае мономолекулярного замещения. Скорость реакции при этом должна зависеть от концентраций обоих партнеров (и субстрата, и нуклеофильного реагента), поэтому этот синхронный процесс замещения называют бимолекулярным. В момент образования и разрыва связи субстрат и реагент должны пройти так называемое переходное состояние, когда старая связь еще не разорвалась, но уже разрыхляется, т.е. ее электронная плотность уже значительно смещается в сторону атома галогена, а новая связь еще не образовалась, но уже происходит взаимодействие оголяющейся орбитали атома углерода и орбитали с неподеленной парой электронов нуклеофила. Из всех возможных ориентаций субстрата и реагента в переходном состоянии наиболее вероятным является та, которая обладает минимумом энергии. Это реализуется при линейном расположении трех атомов: нуклеофильного центра реагента, атома углерода, при котором происходит замещение, и уходящего атома галогена. В качестве примера приведем механизм взаимодействия метилиодида и аммиака:
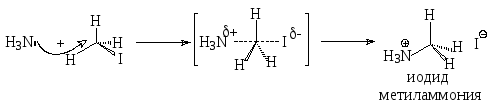
переходное состояние
Если бимолекулярное нуклеофильное замещение происходит при асимметрическом атоме углерода, то в результате реакции происходит обращение конфигурации. Например, при взаимодействии (S)-2-хлорбутана с ацетатом натрия образуется (R)-втор-бутилацетат.
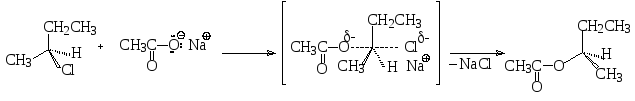
переходное состояние
По механизму SN2 реагируют, прежде всего, галогенопроизводные, не образующие стабильных карбокатионов, т.е. первичные и вторичные. Чем менее разветвлен углеродный скелет вблизи реакционного центра, тем легче замещение протекает по этому механизму.
Для протекания реакций по механизму SN2 подходящими растворителями являются диполярные апротонные растворители, такие как ацетон, нитрометан, диметилформамид, диметилсульфоксид и т.п.
2.2. Особенности нуклеофильного замещения галогена в арилгалогенидах
Строение арилгалогенидов, в которых р-π-сопряжение упрочняет связь углерод-галоген, предполагает низкую реакционную способность этих галогенопроизводных в реакциях нуклеофильного замещения. Наличие электроноакцепторных заместителей, которые уменьшают нуклеофильность ароматического ядра, способствует увеличению реакционной способности, т.е. активирует арилгалогениды к реакциям нуклеофильного замещения.
2.2.1. Нуклеофильное замещение в неактивированных арилгалогенидах
Неактивированные арилгалогениды реагируют с нуклеофилами в очень жестких условиях. Так, при нагревании до 200 ОС под давлением с избытком разбавленного едкого натра хлорбензол превращается в фенолят натрия. Установлено, что механизм этой реакции включает стадии отщепления хлороводорода с образованием дегидробензола (так называемого бензина) и последующего присоединения к бензину воды. Поскольку фенолы проявляют существенные кислотные свойства (см. ниже), то образующийся при этом фенол реагирует со щелочью с образованием фенолята.
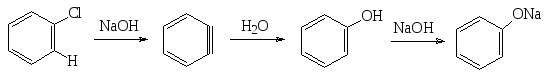
бензин фенол фенолят натрия
Подобным же образом происходит взаимодействие хлорбензола и с амидом натрия. При этом в результате нуклеофильного замещения атома хлора на аминогруппу образуется анилин.
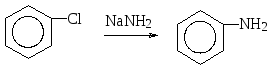
анилин
