
- •Помогаев а.И.
- •Оглавление
- •1. Способы получения
- •1.1.5. Гидрогалогенирование сопряженных диенов
- •1.1.6. Замещение гидроксильной группы в спиртах на галоген
- •1.2. Способы получения винил- и арилгалогенидов
- •1.3. Способы получения дигалогенопроизводных
- •2. Химические свойства
- •2.1. Реакции нуклеофильного замещения (sn) в алкилгалогенидах
- •2.1.1. Механизм мономолекулярного нуклеофильного замещения (sn1)
- •2.1.2. Механизм бимолекулярного нуклеофильного замещения (sn2)
- •2.2. Особенности нуклеофильного замещения галогена в арилгалогенидах
- •2.2.1. Нуклеофильное замещение в неактивированных арилгалогенидах
- •2.2.2. Нуклеофильное замещение в активированных арилгалогенидах
- •2.3. Реакция дегидрогалогенирования
- •2.4. Восстановление галогенопроизводных
- •2.5. Реакции галогенопроизводных с металлами
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Гидратация алкенов
- •1.2. Гидролиз галогенопроизводных
- •1.3. Восстановление карбонильных соединений
- •1.4. Получение спиртов реакцией Гриньяра
- •1.5. Получение диолов и триолов
- •2. Химические свойства
- •2.1. Кислотно-основные свойства
- •2.2. Реакции спиртов с разрывом связи о-н
- •2.2.1. Алкилирование спиртов
- •2.2.2. Ацилирование спиртов
- •2.3. Реакции спиртов с разрывом связи с-о
- •2.3.1. Замещение гидроксильной группы на галоген
- •2.3.2. Образование простых эфиров (межмолекулярная дегидратация)
- •2.3.3. Внутримолекулярная дегидратация спиртов до алкенов
- •2.4. Окисление и дегидрирование спиртов
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Щелочной гидролиз арилгалогенидов
- •1.2. Щелочное плавление солей ароматических сульфокислот
- •1.3. «Кумольный» метод получения фенола
- •2. Химические свойства
- •2.1. Кислотно-основные свойства фенолов
- •2.2. Фенолы как нуклеофилы
- •2.2.1. Алкилирование и ацилирование фенолов по атому кислорода
- •2.2.2. Реакции электрофильного замещения
- •3. Задачи и упражнения
- •Альдегиды и кетоны
- •1. Способы получения
- •1.1. Окисление алкенов
- •1.1.1. Озонолиз алкенов
- •1.1.2. Окисление алкенов в присутствии хлорида палладия
- •1.2. Гидратация алкинов
- •1.3. Получение ароматических альдегидов и кетонов ацилированием аренов
- •1.4. Гидролиз геминальных дигалогенидов
- •1.6.3. Синтез кетонов из нитрилов карбоновых кислот реакцией Гриньяра
- •2. Химические свойства
- •2.1. Кислотно-основные свойства и кето-енольная таутомерия
- •2.2. Реакции нуклеофильного присоединения
- •2.2.1. Реакции с о-нуклеофилами
- •2.2.2. Реакции с s-нуклеофилами
- •2.2.3. Реакции с n-нуклеофилами
- •2.2.4. Реакции с с-нуклеофилами
- •2.3. Реакции енолизующихся альдегидов и кетонов с галогенами
- •2.4. Окисление и восстановление альдегидов и кетонов
- •2.4.1. Окисление альдегидов и кетонов
- •2.4.2. Восстановление альдегидов и кетонов
- •2.4.3. Реакция Канниццаро
- •3. Задачи и упражнения
- •Помогаев Александр Ильич
- •Часть 3
2.2.2. Реакции с s-нуклеофилами
Атом серы в аналогах спиртов – меркаптанах (тиолах) – является более сильным нуклеофилом, поэтому меркаптаны легче присоединяются к альдегидам и кетонам. При этом образуются продукты, аналогичные полуацеталям и ацеталям, например, при взаимодействии бензальдегида с двумя эквивалентами метантиола (метилмеркаптана) в кислой среде образуется диметилтиоацеталь бензальдегида.

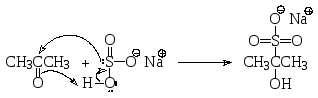
Альдегиды и кетоны легко реагируют с гидросульфитом натрия, образуя так называемые бисульфитные производные, которые представляют собой хорошо кристаллизующиеся соединения и поэтому могут быть использованы для выделения и очистки альдегидов и кетонов.

бисульфитное производное ацетона
(2-гидрокси-2-пропансульфонат натрия)
Механизм реакции – нуклеофильное присоединение бисульфит-аниона:
2.2.3. Реакции с n-нуклеофилами
Многие N-нуклеофилы, с которыми вступают в реакции альдегиды и кетоны, содержат аминогруппу, и их строение может быть отражено общей формулой NН2-Y. Механизм, по которому происходит присоединение таких нуклеофилов, выглядит в общем виде следующим образом.

Нуклеофильное присоединение приводит к аддукту, представляющему собой биполярный ион, в котором бывший нуклеофильный атом азота, отдавший пару электронов на образование новой связи, заряжен положительно, а принявший при гетеролитическом разрыве π-связи пару электронов бывший электрофильный атом углерода карбонильной группы заряжен отрицательно. После внутримолекулярного переноса протона (в результате кислотно-основного взаимодействия) образуется неустойчивый геминальный аминоспирт, дегидратация которого и дает конечный продукт реакции. В таблице приведены нуклеофильные реагенты и продукты реакции, а также их названия.
В качестве иллюстрации к этой таблице рассмотрим некоторые примеры. Так, при взаимодействии пропаналя с аммиаком образуется имин пропаналя.
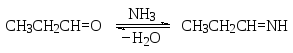
Бензальдегид с анилином очень легко образуют основание Шиффа – так называемый бензилиденанилин (или бензальанилин).
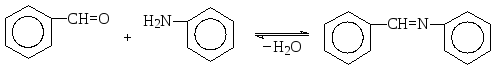
ТАБЛИЦА
Некоторые Ν-нуклеофилы и продукты их взаимодействия с альдегидами и кетонами
|
Нуклеофил |
Продукт | ||
|
Формула |
Название |
Формула |
Название |
|
|
аммиак |
|
имин |
|
|
алкиламин (первичный амин) |
|
N-алкилимин (азометин, основание Шиффа) |
|
|
гидроксиламин |
|
оксим |
|
|
гидразин |
|
гидразон |
При взаимодействии с гидроксиламином ацетон превращается в ацетоноксим, а реакция ацетофенона с гидразином приводит к образованию гидразона ацетофенона:

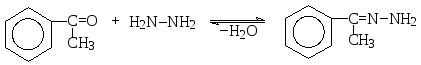
Широкое использование для идентификации альдегидов и кетонов нашли 2,4-динитрофенилгидразоны, которые получают взаимодействием альдегидов и кетонов с 2,4-динитрофенилгидразином.
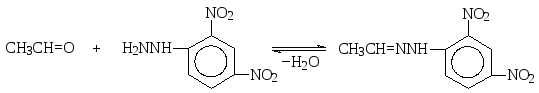
2.2.4. Реакции с с-нуклеофилами
В качестве С-нуклеофилов в реакциях с альдегидами и кетонами выступают соединения, являющиеся С-Н-кислотами, т.е. соединения, способные в присутствии основания дать заметные концентрации сопряженного основания, которое и является С-нуклеофилом. Поэтому практически все реакции альдегидов и кетонов с С-нуклеофилами происходят в присутствии основного катализатора.
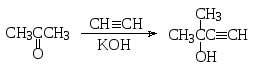
а) Этинилирование альдегидов и кетонов. Ацетилен и другие алкины, имеющие концевую тройную связь, проявляют С-Н-кислотные свойства, поэтому в присутствии оснований они могут реагировать с альдегидами и кетонами. Так, по реакции Реппе ацетилен присоединяется к формальдегиду в присутствии ацетиленида меди (основный катализатор) с образованием 2-пропин-1-ола и далее 2-бутин-1,4-диола:

 Известная
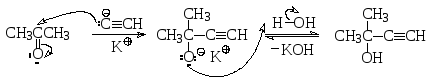
реакция Фаворского, лежащая в основе
синтеза изопрена, является нуклеофильным
присоединением ацетилена к ацетону.
Известная
реакция Фаворского, лежащая в основе
синтеза изопрена, является нуклеофильным
присоединением ацетилена к ацетону.
М еханизм
этой реакции включает генерирование
С-нуклеофильой частицы в результате
кислотно-основного взаимодействия
ацетилена как кислоты с гидроксидом
калия, последующее присоединение
ацетиленид-аниона к карбонильной группе
и протонирование образовавшегося
алкоксид-аниона (гидролиз).
еханизм
этой реакции включает генерирование
С-нуклеофильой частицы в результате
кислотно-основного взаимодействия
ацетилена как кислоты с гидроксидом
калия, последующее присоединение
ацетиленид-аниона к карбонильной группе
и протонирование образовавшегося
алкоксид-аниона (гидролиз).
б) Взаимодействие с синильной кислотой. Циановодород присоединяется по карбонильной группе альдегидов и кетонов в присутствии цианидов металлов как катализаторов. Механизм этой реакции аналогичен взаимодействию кетонов с ацетиленом. Продуктами присоединения являются так называемые циангидрины. Бензальдегид реагирует с синильной кислотой с образованием циангидрида бензальдегида (или 2-гидрокси-2-фенилэтаннитрила):

в) Реакция Гриньяра. Реакция альдегидов и кетонов с магнийорганическими соединениями также относится к нуклеофильному присоединению (см. Способы получения спиртов).

г) Альдольно-кротоновая конденсация. В альдольно-кротоновую конденсацию вступают альдегиды и кетоны, имеющие в α-положении к карбонильной группе атом водорода. Так, например, в присутствии едкого натра в качестве катализатора уксусный альдегид превращается в соединение, которое получило название альдол (альдегидоспирт). Последний при дегидратации в кислой среде образует кротоновый альдегид (2-бутеналь).
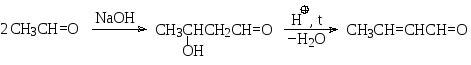
Механизм этой реакции также включает стадию генерирования С-нуклеофила из молекулы уксусного альдегида, имеющего в α-положении атом водорода и обладающего поэтому С-Н-кислотными свойствами. Образовавшийся карбанион, как нуклеофил, присоединяется к карбонильному атому углерода, а последующее протонирование алкоксид-аниона приводит к продукту альдольной конденсации.

Бутаналь в щелочной среде также образует продукт альдольной конденсации:
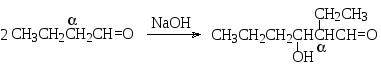
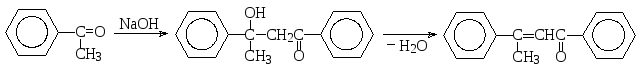
Следующий пример иллюстрирует альдольно-кротоновую конденсацию ароматического кетона (ацетофенона), альдол которого самопроизвольно дегидратируется до ненасыщенного кетона.
Таким образом, в основе альдольной конденсации лежит взаимодействие карбонильной группы одной молекулы альдегида или кетона (карбонильная компонента) с С-нуклеофилом, образующимся под действием основания из второй молекулы альдегида или кетона (метиленовая или С-Н-кислотная компонента).
Все рассмотренные примеры альдольно-кротоновой конденсации представляют собой самоконденсацию альдегида или кетона. Возможно протекание альдольно-кротоновой конденсации и между молекулами двух различных соединений. Однако направленной такая перекрестная конденсация может быть только в некоторых случаях.
Один из участников реакции не является енолизующимся альдегидом или кетоном, т.е. в этой компоненте отсутствует атом водорода в α-положении. Это соединение, таким образом, может выполнять только роль карбонильной компоненты. Например, взаимодействие пропаналя с формальдегидом в щелочной среде протекает как направленная альдольно-кротоновая конденсация, поскольку в молекуле формальдегида нет атома водорода в α-положении и этот альдегид может выступать только как карбонильная компонента, а пропаналь – как метиленовая (С-Н-кислотная).
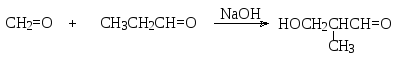
В реакциях альдольной конденсации с участием формальдегида происходит гидроксиметилирование (т.е. замещение атома водорода на группу НОСН2) метиленовой компоненты по α-положению. При наличии нескольких атомов водорода в этом положении и избытке формальдегида может произойти замещение всех этих атомов на гидроксиметильную группу, например:
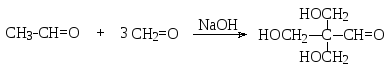
Кроме формальдегида, карбонильной компонентой в перекрестной альдольно-кротоновой конденсации выступает и бензальдегид. Особенностью этого альдегида является то, что даже в щелочной среде в качестве продукта реакции сразу образуется продукт кротоновой конденсации, т.е. самопроизвольно происходит дегидратация альдола. Так, например, при взаимодействии бензальдегида с ацетоном в соотношении 2:1 в присутствии едкого натра образуется 1,5-дифенил-1,4-пентадиен-3-он.
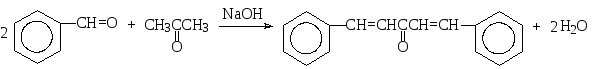
Если обе компоненты имеют атомы водорода в α-положении, но вещества различаются по реакционной способности в реакциях нуклеофильного присоединения, то более реакционноспособное соединение будет выступать в роли карбонильной компоненты. Поэтому, если в перекрестной альдольно-кротоновой конденсации принимают участие альдегид и кетон, то альдегид будет реагировать как карбонильная компонента, а кетон – как метиленовая, например:
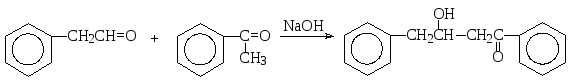
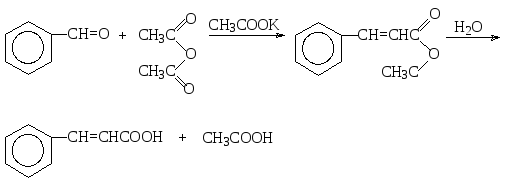
д) Реакция Перкина. При взаимодействии бензальдегида и других ароматических альдегидов с ангидридом уксусной кислоты в присутствии ацетата калия в качестве катализатора происходит реакция, аналогичная альдольно-кротоновой конденсации, где в качестве С-Н-кислотной компоненты фигурирует уксусный ангидрид. При этом после гидролиза смешанного ангидрида образуются коричная и уксусная кислоты.

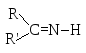 NН3
NН3 R"NН2
R"NН2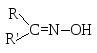 NН2ОН
NН2ОН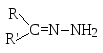 NН2NН2
NН2NН2