
- •Помогаев а.И.
- •Оглавление
- •1. Способы получения
- •1.1.5. Гидрогалогенирование сопряженных диенов
- •1.1.6. Замещение гидроксильной группы в спиртах на галоген
- •1.2. Способы получения винил- и арилгалогенидов
- •1.3. Способы получения дигалогенопроизводных
- •2. Химические свойства
- •2.1. Реакции нуклеофильного замещения (sn) в алкилгалогенидах
- •2.1.1. Механизм мономолекулярного нуклеофильного замещения (sn1)
- •2.1.2. Механизм бимолекулярного нуклеофильного замещения (sn2)
- •2.2. Особенности нуклеофильного замещения галогена в арилгалогенидах
- •2.2.1. Нуклеофильное замещение в неактивированных арилгалогенидах
- •2.2.2. Нуклеофильное замещение в активированных арилгалогенидах
- •2.3. Реакция дегидрогалогенирования
- •2.4. Восстановление галогенопроизводных
- •2.5. Реакции галогенопроизводных с металлами
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Гидратация алкенов
- •1.2. Гидролиз галогенопроизводных
- •1.3. Восстановление карбонильных соединений
- •1.4. Получение спиртов реакцией Гриньяра
- •1.5. Получение диолов и триолов
- •2. Химические свойства
- •2.1. Кислотно-основные свойства
- •2.2. Реакции спиртов с разрывом связи о-н
- •2.2.1. Алкилирование спиртов
- •2.2.2. Ацилирование спиртов
- •2.3. Реакции спиртов с разрывом связи с-о
- •2.3.1. Замещение гидроксильной группы на галоген
- •2.3.2. Образование простых эфиров (межмолекулярная дегидратация)
- •2.3.3. Внутримолекулярная дегидратация спиртов до алкенов
- •2.4. Окисление и дегидрирование спиртов
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Щелочной гидролиз арилгалогенидов
- •1.2. Щелочное плавление солей ароматических сульфокислот
- •1.3. «Кумольный» метод получения фенола
- •2. Химические свойства
- •2.1. Кислотно-основные свойства фенолов
- •2.2. Фенолы как нуклеофилы
- •2.2.1. Алкилирование и ацилирование фенолов по атому кислорода
- •2.2.2. Реакции электрофильного замещения
- •3. Задачи и упражнения
- •Альдегиды и кетоны
- •1. Способы получения
- •1.1. Окисление алкенов
- •1.1.1. Озонолиз алкенов
- •1.1.2. Окисление алкенов в присутствии хлорида палладия
- •1.2. Гидратация алкинов
- •1.3. Получение ароматических альдегидов и кетонов ацилированием аренов
- •1.4. Гидролиз геминальных дигалогенидов
- •1.6.3. Синтез кетонов из нитрилов карбоновых кислот реакцией Гриньяра
- •2. Химические свойства
- •2.1. Кислотно-основные свойства и кето-енольная таутомерия
- •2.2. Реакции нуклеофильного присоединения
- •2.2.1. Реакции с о-нуклеофилами
- •2.2.2. Реакции с s-нуклеофилами
- •2.2.3. Реакции с n-нуклеофилами
- •2.2.4. Реакции с с-нуклеофилами
- •2.3. Реакции енолизующихся альдегидов и кетонов с галогенами
- •2.4. Окисление и восстановление альдегидов и кетонов
- •2.4.1. Окисление альдегидов и кетонов
- •2.4.2. Восстановление альдегидов и кетонов
- •2.4.3. Реакция Канниццаро
- •3. Задачи и упражнения
- •Помогаев Александр Ильич
- •Часть 3
2.3. Реакции спиртов с разрывом связи с-о
Реакции спиртов с разрывом связи С-О – это реакции замещения гидроксильной группы и реакция дегидратации. Несмотря на высокую полярность связи С-О, спирты являются очень слабыми С-электрофилами, поскольку гидроксид-анион, который должен образоваться при гетеролизе связи С-О, представляет собой сильное основание, и поэтому гидроксильная группа является плохо уходящей группой. Для облегчения разрыва связи С-О гидроксильная группа должна быть превращена в более легко уходящую группу, например, в оксониевую, которая образуется при протонировании спиртов сильными кислотами (см. основные свойства спиртов). При этом связь С-О разрывается гетеролитически с образованием слабо основной воды. Следовательно, заместить гидроксильную группу в молекуле спирта на нуклеофил можно только в сильнокислой среде, так же как и вызвать дегидратацию с образованием алкена.
2.3.1. Замещение гидроксильной группы на галоген
Замещение гидроксильной группы на атом галогена может быть осуществлено нуклеофильным замещением в кислой среде, например, взаимодействием с галогеноводородами или их растворами.
![]()
Реакционная способность спиртов в указанной реакции увеличивается в ряду: первичные ‹ вторичные ‹ третичные. Это обусловлено тем, что в этом ряду возрастает устойчивость образующихся при гетеролизе связи С-О карбокатионов. Третичные спирты образуют наиболее устойчивые крабокатионы, т.е. для них разрыв связи С-О в протонированной форме спирта протекает особенно легко.

Замещение гидроксильной группы в молекуле спирта на хлор происходит также при взаимодействии спиртов с такими реагентами, как тионилхлорид, пентахлорид фосфора и другие (см. способы получения галогенопроизводных). Замещение гидроксила на иод осуществляют обычно нагреванием спирта со смесью кристаллического иода и красного фосфора. Все эти превращения представляют собой способы получения галогенопроизводных и были описаны в соответствующей главе.
2.3.2. Образование простых эфиров (межмолекулярная дегидратация)
При нагревании первичных или вторичных спиртов с каталитическим количеством сильной кислоты (например, конц. серной кислоты) происходит образование симметричных простых эфиров в результате нуклеофильного замещения спиртового гидроксила на алкокси-группу по механизму SN2.
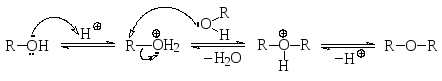
Таким образом, в данной реакции одна молекула спирта выступает как электрофильная частица (в виде катиона алкилоксония после протонирования), а другая – как нуклеофильная частица. Эта реакция, как и всегда при нуклеофильном замещении, конкурирует с элиминированием (внутримолекулярной дегидратацией, см. ниже). Как правило, простые эфиры получают при более низкой температуре. При повышении же температуры возрастает роль элиминирования. Так, диэтиловый эфир получаю при нагревании этилового спирта с концентрированной серной кислотой при температуре 140О С, в то время как при 170О С в основном получается этилен.
2.3.3. Внутримолекулярная дегидратация спиртов до алкенов
Эта реакция является обратной по отношению к гидратации алкенов. При действии на спирт каталитического количества сильной кислоты (например, конц. серной кислоты) при достаточно высокой температуре происходит отщепление воды с образованием алкена. Дегидратация, как и дегидрогалогенирование галогенопроизводных, является региоселективной реакцией, поскольку из двух возможных структурных изомеров алкена преимущественно образуется наиболее термодинамически устойчивый алкен в результате отщепления атома водорода от наиболее гидрогенизированного соседнего атома углерода (правило Зайцева). Так, при дегидратации 2-бутанола главным продуктом оказывается 2-бутен (наряду с 1-бутеном).
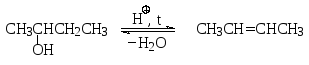
Дегидратация протекает по механизму мономолекулярного элиминирования (Е1):

Поскольку реакция идет через карбокатионный интермедиат, то по реакционной способности в этой реакции спирты можно расположить в ряд, соответствующий ряду увеличения стабильности карбокатионов: третичные › вторичные › первичные. Так, для дегидратации такого первичного спирта, как этиловый, применяют нагревание до 170 ОС, в то время как 2-пентанол (вторичный спирт) дегидратируется при 90 ОС.
