
- •Помогаев а.И.
- •Оглавление
- •1. Способы получения
- •1.1.5. Гидрогалогенирование сопряженных диенов
- •1.1.6. Замещение гидроксильной группы в спиртах на галоген
- •1.2. Способы получения винил- и арилгалогенидов
- •1.3. Способы получения дигалогенопроизводных
- •2. Химические свойства
- •2.1. Реакции нуклеофильного замещения (sn) в алкилгалогенидах
- •2.1.1. Механизм мономолекулярного нуклеофильного замещения (sn1)
- •2.1.2. Механизм бимолекулярного нуклеофильного замещения (sn2)
- •2.2. Особенности нуклеофильного замещения галогена в арилгалогенидах
- •2.2.1. Нуклеофильное замещение в неактивированных арилгалогенидах
- •2.2.2. Нуклеофильное замещение в активированных арилгалогенидах
- •2.3. Реакция дегидрогалогенирования
- •2.4. Восстановление галогенопроизводных
- •2.5. Реакции галогенопроизводных с металлами
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Гидратация алкенов
- •1.2. Гидролиз галогенопроизводных
- •1.3. Восстановление карбонильных соединений
- •1.4. Получение спиртов реакцией Гриньяра
- •1.5. Получение диолов и триолов
- •2. Химические свойства
- •2.1. Кислотно-основные свойства
- •2.2. Реакции спиртов с разрывом связи о-н
- •2.2.1. Алкилирование спиртов
- •2.2.2. Ацилирование спиртов
- •2.3. Реакции спиртов с разрывом связи с-о
- •2.3.1. Замещение гидроксильной группы на галоген
- •2.3.2. Образование простых эфиров (межмолекулярная дегидратация)
- •2.3.3. Внутримолекулярная дегидратация спиртов до алкенов
- •2.4. Окисление и дегидрирование спиртов
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Щелочной гидролиз арилгалогенидов
- •1.2. Щелочное плавление солей ароматических сульфокислот
- •1.3. «Кумольный» метод получения фенола
- •2. Химические свойства
- •2.1. Кислотно-основные свойства фенолов
- •2.2. Фенолы как нуклеофилы
- •2.2.1. Алкилирование и ацилирование фенолов по атому кислорода
- •2.2.2. Реакции электрофильного замещения
- •3. Задачи и упражнения
- •Альдегиды и кетоны
- •1. Способы получения
- •1.1. Окисление алкенов
- •1.1.1. Озонолиз алкенов
- •1.1.2. Окисление алкенов в присутствии хлорида палладия
- •1.2. Гидратация алкинов
- •1.3. Получение ароматических альдегидов и кетонов ацилированием аренов
- •1.4. Гидролиз геминальных дигалогенидов
- •1.6.3. Синтез кетонов из нитрилов карбоновых кислот реакцией Гриньяра
- •2. Химические свойства
- •2.1. Кислотно-основные свойства и кето-енольная таутомерия
- •2.2. Реакции нуклеофильного присоединения
- •2.2.1. Реакции с о-нуклеофилами
- •2.2.2. Реакции с s-нуклеофилами
- •2.2.3. Реакции с n-нуклеофилами
- •2.2.4. Реакции с с-нуклеофилами
- •2.3. Реакции енолизующихся альдегидов и кетонов с галогенами
- •2.4. Окисление и восстановление альдегидов и кетонов
- •2.4.1. Окисление альдегидов и кетонов
- •2.4.2. Восстановление альдегидов и кетонов
- •2.4.3. Реакция Канниццаро
- •3. Задачи и упражнения
- •Помогаев Александр Ильич
- •Часть 3
1.2. Способы получения винил- и арилгалогенидов
Винилгалогениды получают электрофильным присоединением галогеноводородов к алкинам, причем, как и в случае присоединения к алкенам, реакция протекает региоселективно в соответствии с правилом Марковникова, например:

Одним из важнейших способов введения атомов хлора и брома в ароматические соединения является электрофильное галогенирование, причем в зависимости от природы заместителя галогенирование происходит либо в орто- и пара-положения, либо в мета-положение, например:


1.3. Способы получения дигалогенопроизводных
Вицинальные дигалогениды получают присоединением галогенов к алкенам.

В обычных условиях реакция протекает стереоселективно как анти-присоединение двух атомов галогена к двойной связи, так что при возникновении в результате реакции асимметрических атомов углерода образуются определенные пространственные изомеры. Так, взаимодействие брома с циклопентеном приводит к образованию транс-1,2-дибромциклопентана.

Геминальные дигалогениды могут быть получены присоединением галогеноводородов к винилгалогенидам, например:

Кроме того, гем-дигалогениды образуются при присоединении 2 эквивалентов галогеноводородов к алкинам.

2. Химические свойства
 Для
галогенопроизводных, имеющих полярную
связь углерод-галоген, характерны
реакции с гетеролитическим разрывом
этой связи, при этом атом галогена уходит
как галогенид-анион, т.е.уносит
с собой оба электрона связи.
В зависимости от строения галогенопроизводного
этот разрыв связи может протекать легче
или труднее. Для алкилгалогенидов, в
которых атом галогена связан с
sp3-гибридизированным
атомом углерода, этот процесс происходит
значительно легче, чем для винил- или
арилгалогенидов, у которых атом галогена
связан с sp2-гибридизированным
атомом углерода не только σ-связью, но
и укрепляющим эту связь p-π-взаимодействием.
Для
галогенопроизводных, имеющих полярную
связь углерод-галоген, характерны
реакции с гетеролитическим разрывом
этой связи, при этом атом галогена уходит
как галогенид-анион, т.е.уносит
с собой оба электрона связи.
В зависимости от строения галогенопроизводного
этот разрыв связи может протекать легче
или труднее. Для алкилгалогенидов, в
которых атом галогена связан с
sp3-гибридизированным
атомом углерода, этот процесс происходит
значительно легче, чем для винил- или
арилгалогенидов, у которых атом галогена
связан с sp2-гибридизированным
атомом углерода не только σ-связью, но
и укрепляющим эту связь p-π-взаимодействием.

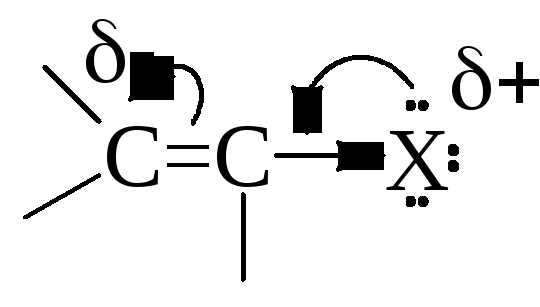
На место уходящего атома галогена может присоединиться частица, которая образует с остающимся без двух электронов связи атомом углерода новую σ-связь за счет своей пары электронов. Произойдет замещение атома галогена на нуклеофил, т.е. нуклеофильное замещение (SN). Кроме того, уход атома галогена в виде аниона может сопровождаться отрывом протона от соседнего атома углерода, если такой протон имеется. В этом случае происходит отщепление, или элиминирование (Е) галогеноводорода с образованием двойной связи. Обе реакции – и нуклеофильное замещение, и элиминирование – происходят параллельно, т.е. являются конкурирующими, поскольку одна и та же частица может в первом случае выступать как нуклеофил, а во втором случае – как основание, присоединяющее отщепляющийся протон.
 нуклеофильное
нуклеофильное
замещение (SN)

элиминирование (Е)
