
- •Помогаев а.И.
- •Оглавление
- •1. Способы получения
- •1.1.5. Гидрогалогенирование сопряженных диенов
- •1.1.6. Замещение гидроксильной группы в спиртах на галоген
- •1.2. Способы получения винил- и арилгалогенидов
- •1.3. Способы получения дигалогенопроизводных
- •2. Химические свойства
- •2.1. Реакции нуклеофильного замещения (sn) в алкилгалогенидах
- •2.1.1. Механизм мономолекулярного нуклеофильного замещения (sn1)
- •2.1.2. Механизм бимолекулярного нуклеофильного замещения (sn2)
- •2.2. Особенности нуклеофильного замещения галогена в арилгалогенидах
- •2.2.1. Нуклеофильное замещение в неактивированных арилгалогенидах
- •2.2.2. Нуклеофильное замещение в активированных арилгалогенидах
- •2.3. Реакция дегидрогалогенирования
- •2.4. Восстановление галогенопроизводных
- •2.5. Реакции галогенопроизводных с металлами
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Гидратация алкенов
- •1.2. Гидролиз галогенопроизводных
- •1.3. Восстановление карбонильных соединений
- •1.4. Получение спиртов реакцией Гриньяра
- •1.5. Получение диолов и триолов
- •2. Химические свойства
- •2.1. Кислотно-основные свойства
- •2.2. Реакции спиртов с разрывом связи о-н
- •2.2.1. Алкилирование спиртов
- •2.2.2. Ацилирование спиртов
- •2.3. Реакции спиртов с разрывом связи с-о
- •2.3.1. Замещение гидроксильной группы на галоген
- •2.3.2. Образование простых эфиров (межмолекулярная дегидратация)
- •2.3.3. Внутримолекулярная дегидратация спиртов до алкенов
- •2.4. Окисление и дегидрирование спиртов
- •3. Задачи и упражнения
- •1. Способы получения
- •1.1. Щелочной гидролиз арилгалогенидов
- •1.2. Щелочное плавление солей ароматических сульфокислот
- •1.3. «Кумольный» метод получения фенола
- •2. Химические свойства
- •2.1. Кислотно-основные свойства фенолов
- •2.2. Фенолы как нуклеофилы
- •2.2.1. Алкилирование и ацилирование фенолов по атому кислорода
- •2.2.2. Реакции электрофильного замещения
- •3. Задачи и упражнения
- •Альдегиды и кетоны
- •1. Способы получения
- •1.1. Окисление алкенов
- •1.1.1. Озонолиз алкенов
- •1.1.2. Окисление алкенов в присутствии хлорида палладия
- •1.2. Гидратация алкинов
- •1.3. Получение ароматических альдегидов и кетонов ацилированием аренов
- •1.4. Гидролиз геминальных дигалогенидов
- •1.6.3. Синтез кетонов из нитрилов карбоновых кислот реакцией Гриньяра
- •2. Химические свойства
- •2.1. Кислотно-основные свойства и кето-енольная таутомерия
- •2.2. Реакции нуклеофильного присоединения
- •2.2.1. Реакции с о-нуклеофилами
- •2.2.2. Реакции с s-нуклеофилами
- •2.2.3. Реакции с n-нуклеофилами
- •2.2.4. Реакции с с-нуклеофилами
- •2.3. Реакции енолизующихся альдегидов и кетонов с галогенами
- •2.4. Окисление и восстановление альдегидов и кетонов
- •2.4.1. Окисление альдегидов и кетонов
- •2.4.2. Восстановление альдегидов и кетонов
- •2.4.3. Реакция Канниццаро
- •3. Задачи и упражнения
- •Помогаев Александр Ильич
- •Часть 3
2.2. Фенолы как нуклеофилы
В молекуле фенола присутствуют два нуклеофильных центра: атом кислорода гидроксильной группы, способный проявить в процессе химической реакции свойства донора электронов, поскольку имеет неподеленные пары электронов, и ароматическое кольцо, по которому могут протекать реакции электрофильного замещения.
2.2.1. Алкилирование и ацилирование фенолов по атому кислорода
Как О-нуклеофилы фенолы, подобно спиртам, могут вступать в реакции с такими электрофильными реагентами, как алкилгалогениды (алкилирующие агенты) и производные карбоновых кислот – ацилгалогениды и ангидриды карбоновых кислот (ацилирующие агенты).
Алкилирование фенолов до простых эфиров чаще всего осуществляют по методу Вильямсона, т.е. в реакцию с алкилгалогенидом вводят не сам фенол, а фенолят, О-нуклеофильные свойства которого благодаря отрицательному заряду на атоме кислорода выше, чем у фенола. Так, анизол (метилфениловый эфир) может быть получен либо реакцией фенолята натрия с метилиодидом, либо взаимодействием фенола с метилиодидом в щелочной среде.
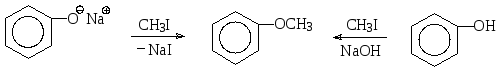
метилфениловый эфир
(анизол)
Ацилирование фенолов до сложных эфиров происходит при действии на них галогеноангидридов карбоновых кислот или ангидридов карбоновых кислот. В первом случае реакция чаще всего катализируется основаниями, а во втором случае – кислотами. Например, фенилацетат можно получить взаимодействием фенола с ацетилхлоридом в присутствии едкого натра (или другого основания) или реакцией фенола с уксусным ангидридом в присутствии серной кислоты.

фениловый эфир уксусной кислоты
(фенилацетат)
В отличие от спиртов фенолы не ацилируются карбоновыми кислотами, т.е. в реакцию этерификации фенолы не вступают. Это обусловлено как низкой нуклеофильностью фенолов, так и низкой электрофильностью карбоновых кислот.
2.2.2. Реакции электрофильного замещения
Как ароматические соединения, фенолы вступают в реакции электрофильного замещения. Гидроксильная группа является одним из самых сильных активирующих заместителей (+М-эффект значительно больше –I-эффекта), поэтому реакционная способность фенолов в этих реакциях очень высока. Замещение происходит в пара- и орто-положения, поскольку гидроксильная группа, как все активирующие заместители, является ориентантом первого рода.
 Высокая
реакционная способность фенолов в
реакциях ароматического электрофильного
замещения позволяет осуществлять для
них известные реакции в значительно
более мягких условиях, чем для бензола.
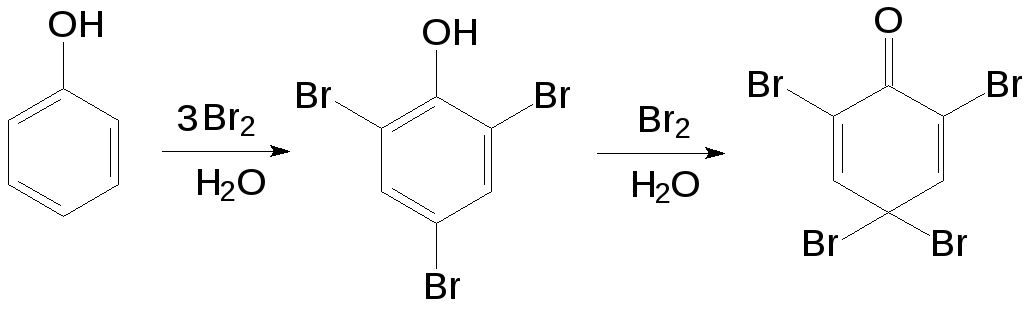
Так, бензол не обесцвечивает бромную
воду, поскольку для его бромирования
необходим катализатор, например,
трибромид алюминия. Если же бромную
воду добавить к фенолу, наступает почти
мгновенное обесцвечивание, потому что
фенол реагирует с бромом, причем так
активно, что бромирование не ограничивается
образованием продукта монозамещения,
а идет дальше во все «активные» положения,
и образуется 2,4,6-трибромфенол, который
при дальнейшем взаимодействии с бромом
может превратиться в
2,4,4,6-тетрабром-2,5-циклогексадиенон.
Высокая
реакционная способность фенолов в
реакциях ароматического электрофильного
замещения позволяет осуществлять для
них известные реакции в значительно
более мягких условиях, чем для бензола.
Так, бензол не обесцвечивает бромную
воду, поскольку для его бромирования
необходим катализатор, например,
трибромид алюминия. Если же бромную
воду добавить к фенолу, наступает почти
мгновенное обесцвечивание, потому что
фенол реагирует с бромом, причем так
активно, что бромирование не ограничивается
образованием продукта монозамещения,
а идет дальше во все «активные» положения,
и образуется 2,4,6-трибромфенол, который
при дальнейшем взаимодействии с бромом
может превратиться в
2,4,4,6-тетрабром-2,5-циклогексадиенон.
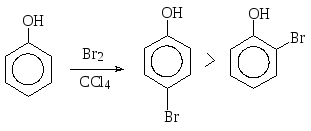
Взаимодействием фенола с бромом в неполярном растворителе, например, в тетрахлорметане, можно осуществить монобромирование, причем в основном образуется пара-бромфенол.
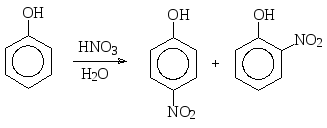
Нитрование фенола разбавленной азотной кислотой при комнатной температуре приводит к смеси продуктов монозамещения – орто- и пара-нитрофенолов.
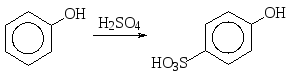
Сульфирование фенола концентрированной серной кислотой при 100О С происходит с образованием главным образом пара-фенолсульфокислоты.
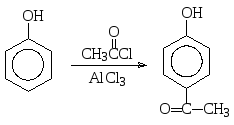
Ацилирование фенолов по атому углерода ароматического кольца осуществляется, как и для других ароматических соединений, по Фриделю-Крафтсу. Например, взаимодействие фенола с ацетилхлоридом (хлорангидридом уксусной кислоты) в присутствии трихлорида алюминия приводит к продукту замещения на ацетильную группу в пара-положение:
Кроме обычных для всех ароматических соединений реакций электрофильного замещения, фенолы вступают также в некоторые другие реакции SE, характерные только для очень активированных производных бензола. Рассмотрим только два примера таких реакций.
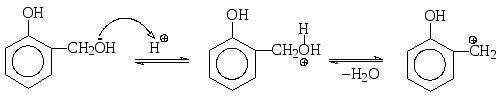
Взаимодействие фенолов с альдегидами и кетонами происходит в кислой среде с образованием продукта электрофильного замещения, причем электрофил генерируется из потенциально электрофильного карбонильного соединения в результате протонирования. Так, при взаимодействии фенола с формальдегидом в качестве первичного продукта замещения образуются орто- и пара-гидроксибензиловые спирты:
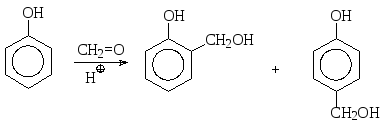
салициловый спирт
Электрофильная частица в этой реакции образуется в результате следующего кислотно-основного взаимодействия:
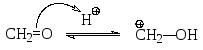
Далее реакция протекает по обычному механизму электрофильного замещения через π- и σ-комплексы. На этом, однако, реакция не заканчивается. Как орто-, так и пара-гидроксибензиловые спирты в кислой среде также могут давать электрофильные частицы -соответствующие бензильные катионы, с которыми следующая молекула фенола реагирует опять по механизму электрофильного замещения (алкилирования) в орто- или пара-положения с образованием дигидроксидифенилметанов I - III.

I II
II III
Образовавшиеся дигидроксидифенилметаны (I - III) могут реагировать далее с формальдегидом и фенолом с образованием линейных и двухмерных полимеров. Эти реакции лежат в основе производства фенолформальдегидных полимерных материалов.
По аналогичному механизму происходит реакция в кислой среде между фенолом и ацетоном в соотношении 2:1 с образованием так называемого бисфенола А – промежуточного продукта в производстве эпоксидных смол.

2,2-ди(пара-гидроксифенил)пропан
(бисфенол А)
Из других реакций электрофильного замещения фенолов следует остановиться на реакции карбоксилирования – взаимодействии фенолятов с диоксидом углерода, при котором в молекулу фенолов вводится карбоксильная группа. Так, из фенолята натрия получают салициловую кислоту (орто-гидроксибензойную), ацетилированием которой уксусным ангидридом в кислой среде получают ацетилсалициловую кислоту (аспирин):
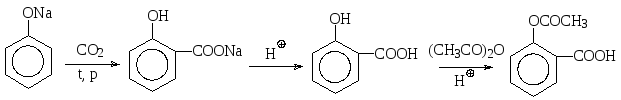
салициловая кислота «аспирин»
