
- •Альдегиды
- •Фармакологические свойства
- •Химические свойства
- •I. Реакции окисления.
- •II. Реакции нуклеофильного присоединения.
- •Получение
- •Описание
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Хлоралгидрат
- •Получение
- •Описание
- •Растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Хранение
- •Применение
- •Углеводы: моносахариды и полисахариды. Общие понятия о группе.
- •Анализ химической структуры моносахаридов.
- •Изомерия моносахаридов.
- •Характеристика химической активности углеводов.
- •Превращения под действием кислот и щелочей.
- •Глюкоза (декстроза) Glucosum
- •Описание
- •Подлинность
- •Чистота
- •Количественное определение По фс сахара в порошке количественно не определяют
- •Хранение
- •Применение
- •Особенности приготовления и контроля качества в условиях аптек
- •Характеристика химической активности
- •Применение
- •Сахароза Sacharum (мнн)
- •Описание
- •Химические свойства.
- •Подлинность
- •Описание
- •Подлинность
- •Применение
Чистота
прозрачность и цветность раствора
избыточная кислотность или щелочность (раствор должен давать щелочную реакцию на лакмус, но не окрашивать фенофталеин), рН = 7,8-8,2 у раствора для инъекций.
допустимые примеси хлоридов, сульфатов, тяжелых металлов.
недопустимы примеси солей аммония и параформа, что возможно при нарушении условий хранения. При добавлении реактива Несслера к раствору вещества и нагревании на водяной бане не должно быть желтого окрашивания, помутнения раствора и серо-черного осадка.
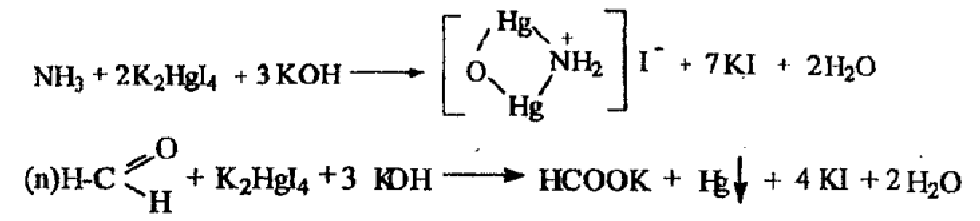
NH3 + 2K2[HgI4] + 3KOH→[NH2(HgI)2]I↓ + 7KI + 2H2O


+

 IHg
IHg
N
 H3
+ 2K2HgI4
+ 3KOH NH2
I-
+ 7KI + 2H2O
H3
+ 2K2HgI4
+ 3KOH NH2
I-
+ 7KI + 2H2O
 I Hg
I Hg
HO-CH2-(OCH2)n-OH
 O
O
( n)H
– C +K2HgI4
+ 3KOH → HCOOK + Hg↓ + 4KI + 2H2O
n)H
– C +K2HgI4
+ 3KOH → HCOOK + Hg↓ + 4KI + 2H2O
H
не допускается примесь органических веществ.
Количественное определение
ГФ Х Метод нейтрализации, обратное ацидиметрическое титрование.
Метод основан на реакции кислотного гидролиза. Навеску вещества нагревают с избытком титрованного раствора кислоты серной, при этом метанамин разлагается до аммония сульфата и формальдегида.
Разложение проходит количественно, поэтому после охлаждения раствора остаток кислоты серной титруют как четырехкислотное основание по индикатору – метиловому красному стандартным раствором натрия гидроксида до желтого окрашивания. Проводят контрольный опыт.
t oC
(CH2)6N4 + 2H2SO4 + 6H2O → 6HCOH + 2(NH4)2SO4
H2SO4 + 2NaOH → Na2SO4 + H2O
Кстех = ½; fэкв = ½· ½ = ¼; М.э = ¼ · М.м
Ацидиметрия прямая в водной среде. Титруют стандартным раствором кислоты хлороводородной в присутствии смешанного индикатора (метиленовый синий и метиловый оранжевый) как однокислотное основание от зеленого до фиолетового окрашивания.
(CH2)6N4 + HCl → (CH2)6N4· HCl fэкв = 1
Кислотно – основное титрование в неводной среде (Британская фармакопея, 2001 г. В среде метанола). Метанамин титруется как однокислотное основание раствором кислоты хлорной. Точку эквивалентности определяют потенциометрически.
(CH2)6N4 + HClO4 → (CH2)6N4 ∙ HClO4
аргентометрическое титрование (вариант Фольгарда) основано на способности образовывать комплексные соединения
2(CH2)6N4 +3AgNO3 (избыток) → 2(CH2)6N4· 3AgNO3↓
AgNO3(остаок) +NH4SCN →AgSCN↓ +NH4NO3
NH4SCN +NH4Fe(SO4)2· 12H2O → Fe(SCN)3 +(NH4)2SO4 + 12H2O
красное окр.
fэкв = ⅔
по реакциям образования комплексных соединений:
йодометрическое титрование титрант–йод (CH2)6N4 ∙ 2I2↓
йодхлорметрическое титрант–йодмонохлорид (CH2)6N4 ∙ 2ICl↓
Хранение
хранят в хорошо укупоренной таре при температуре не выше 20 оС, т.к. он возгоняется. Растворы нельзя стерилизовать, поскольку в растворах легко гидролизуется.
Растворы устойчивы в щелочной среде, но легко разлагаются в присутствии кислотных реагентов. Растворы ГМТА имеют слабощелочную реакцию, при нагревании их происходит разложение вещества до формальдегида и аммиака.
