
- •Анализ производных нитрофенилалкиламинов, гидроксифенилалифатичеких аминокислот и арилгидроксипропаноламинов
- •Изомерия
- •Хлорамфеникол Chloramphenicol (мнн) Левомицетин Leavomycetinum (лн)
- •Физико-химические свойства
- •Подлинность
- •Реакции подлинности
- •Чистота
- •Количественное определение
- •Сфм в уф- области Формулы расчета концентрации Сх при использовании рсо (раствора стандартного образца)
- •1 2 3
- •1 2 3
- •Хлорамфеникола стеарат – Левомицетина стеарат
- •Подлинность
- •Химические свойства
- •2. Удельное вращение [αD20]:
- •3. Температура плавления.
- •2. Реакции на аминокислотный фрагмент
- •Чистота
- •1.Фс – кислотно-основное титрование (ацидиметрия) в среде неводного (протогенного) растворителя.
- •Метаболизм
- •Производные арилгидроксипропаноламинов
- •Подлинность
- •Чистота
- •Количественное определение
Анализ производных нитрофенилалкиламинов, гидроксифенилалифатичеких аминокислот и арилгидроксипропаноламинов
ПРОИЗВОДНЫЕ НИТРОФЕНИЛАЛКИЛАМИНа
Группу составляют левомицетин и его эфиры – левомицетина стеарат и левомицетина сукцинат.
История создания: Левомицетин (хлорамфеникол) относится к группе антибиотиков широкого спектра действия. Он действует против Гр(+) и Гр(-) бактерий, а также против риккетсий. Впервые выделен в 1947 году из культуральной жидкости актиномицета Streptomyces venezuelae и уже через 2 года синтезирован в США. В нашей стране группой ученых под руководством академика М.М. Шемякина получен вначале рацемат (синтомицин), затем левовращающий изомер – левомицетин, полностью идентичный американскому препарату хлорамфеникол.
По химической структуре он относится к производным п-замещенного нитробензола.
Анализ химической структуры: (ошибки в циф.обозначениях)
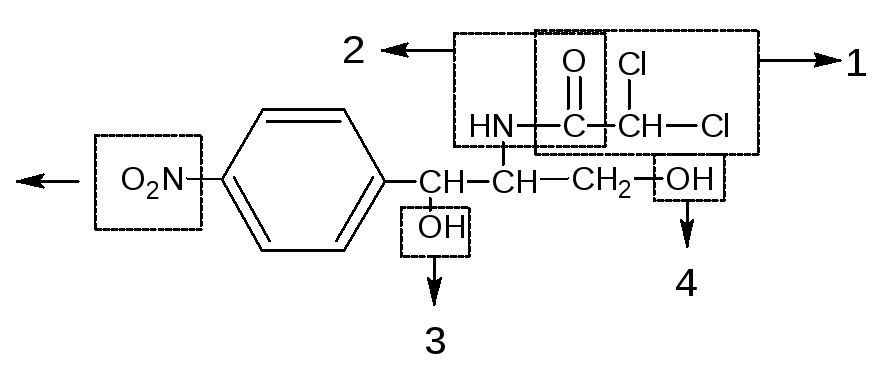
остаток дихлоруксусной кислоты
остаток пропандиола-1,3
Нитрофенильный остаток (п-нитробензол).
Функциональные группы
1. ковалентно связанный хлор
2.Амидная группа
3. Вторичный спиртовой гидроксил
4. Первичный спиртовой гидроксил
5. Ароматическая нитро-группа
Изомерия
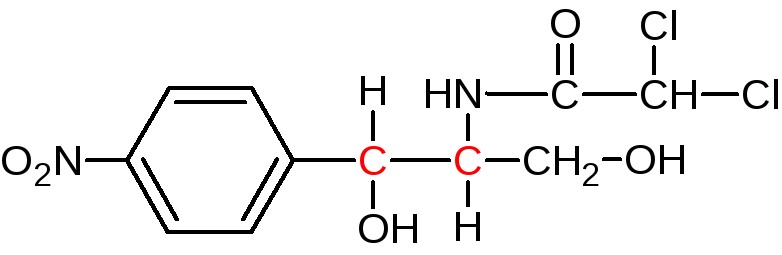
Левомицетин имеет рядом два ассиметрических атома углерода, следовательно, возможно существование четырех оптически деятельных изомеров и двух рацематов. Или в виде двух пар пространственных антиподов:
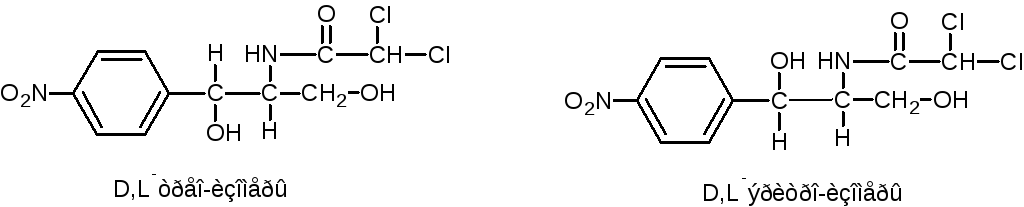
D(-),L(+)-эритро-изомеры (со строением цис-) и
D(-),L(+)-трео-изомеры (со строением транс-).
Они отличаются между собой пространственным расположением гидроксила и водорода у первого углерода боковой цепи (трео- по разные стороны, эритро- по одной стороне углеродной цепи):
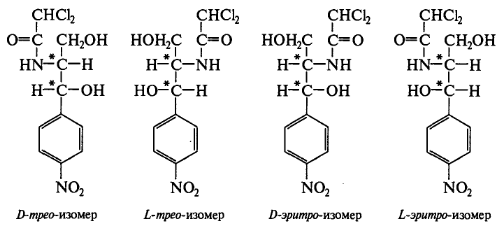
По характеру конфиryрации асимметрического атома углерода в положении С1 оптически активные соединения относят к Д- и L-ряду. Оптическая активность зависит от конфиrypации всех асимметрических атомов углерода, поэтому как в Д-ряду, так и в L-ряду могут быть и левовращающие (-) и правовращающие (+) изомеры. Знак вращения (+) или (-) указывается в скобках после обозначения конфиryрации.
Эритро-изомеры очень токсичны и не применяются в медицине. Природный левомицетин, применяющийся в медицине, - это D(-)-трео-изомер. L(+) трео-изомер физиологически не активен, поэтому трео-рацемат обладает 50% активности левомицетина и называется синтомицином.
Хлорамфеникол Chloramphenicol (мнн) Левомицетин Leavomycetinum (лн)

D(-)-трео-1-(п-нитрофенил)-2-дихлорацетиламинопропандиол-1,3
Описание: белый или белый со слабым желтовато-зеленым оттенком кристаллический порошок без запаха горького вкуса.
Растворимость: мало растворим в воде, легко растворим в спирте, растворим в этилацетате, нерастворим в хлороформе.
Физико-химические свойства
1. Поглощают свет в УФ-области спектра как ароматические соединения и за счёт группировок с двойными (кратными) связями (карбонильная и нитрогруппа).
2. Являются оптически активными веществами. У хлорамфеникола направление оптического вращения зависит от вида растворителя:
5% раствор хлорамфеникола в этаноле вращает плоскость поляризации вправо (+); 5% раствор в этилацетате - влево (-) ФС.
Химические свойства обусловлены функциональными группами:
1. ароматическая нитрогруппа;
2. амидная группа;
3. спиртовые гидроксилы первичный и вторичный;
4. ковалентно связанный хлор;
