- •Общие методы анализа органических лекаствнных средств. Функциональный анализ.
- •3. Прочие
- •Лекарственные вещества, содержащие спиртовой гидроксил.
- •Лекарственные вещества, содержащие карбонильную (альдегидную и кетонную) группу
- •2.1 Конденсации
- •2.2 Замещения
- •2.3 Присоединения
- •2.1 Реакции конденсации с фенолами
- •2.3 Реакции присоединения.
- •3.Реакции полимеризации.
- •3.4 Реакции конденсации с альдегидами или ангидридами кислот
- •Лекарственные вещества, содержащие сложно – эфирную группу
- •Лекарственные вещества, содержащие первичную ароматическую аминогруппу
- •2 Стадия
- •Лекарственные вещества, содержащие ароматическую нитро-группу
- •Лекарственные вещества, содержащие непредельную связь
- •Лекарственные вещества, содержащие амидную группу
- •Лекарственные вещества, содержащие вторичную и третичную аминогруппы
- •Лекарственные вещества, содержащие имидную и сульфамидную группы
- •2. Реакция вытеснения кислотной формы
- •Лекарственные вещества, в структуре которых присутствуют ковалентно связанные галогены
Общие методы анализа органических лекаствнных средств. Функциональный анализ.
Препараты могут иметь разнообразную химическую структуру - от алифатических соединений, до сложнейших полициклических. Разнообразие и сложность химической структуры и определяет необходимость применения для их анализа целого комплекса физических, химических, физико-химических и биологических методов анализа:
Проводят элементарный анализ, получая из сложных органических соединений путем минерализации простые неорганические вещества, которые исследуют аналитическими реакциями. Цель этого анализа – доказать присутствие определенных элементов в составе структуры органического соединения.
Определяют физические и физико-химические константы (плотность, вязкость, температуру плавления, показатель преломления, хроматографические показатели и т.д.)
Особую значимость для анализа органических соединений, какими является большинство наиболее эффективных ЛС, имеет функциональный анализ, т.е. обнаружение химическими реакциями той или иной функциональной группы вещества. Т.к. биологическая активность веществ во многом обуславливается наличием функциональных групп, следовательно, функциональный анализ приобретает большую значимость.
Функциональные группы (ФГ) – это реакционно-способный атом или группа атомов, связанные с углеводородным радикалом, обуславливающие химические свойства вещества, его фармакологическую активность, а также принадлежность к определенному классу органических соединений.
Классификация ФГ основана на названии входящих в них элементов. Она до некоторой степени условна, т. к. многие ФГ являются смешанными (содержат несколько элементов).
Кислородсодержащие ФГ:
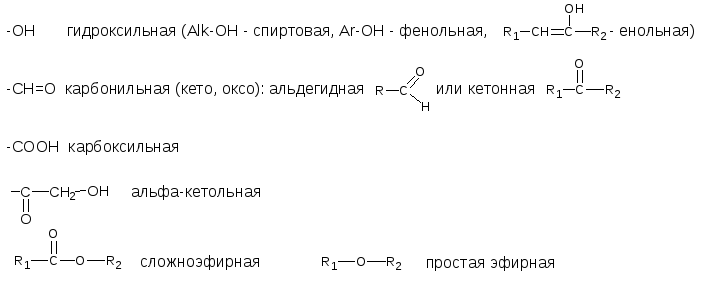
Азотсодержащие ФГ:

3. Прочие
R-Hal ковалентно связанный галоген (Cl, Br, J, F).
R – S – R1 ковалентно связанная сера
R – SH сульфгидрильная (меркаптогруппа) и т.д.
Реакции на ФГ, за редким исключением, носят универсальный характер, следовательно, знание свойств ФГ дает возможность предсказать способы испытаний любого органического вещества.
ЛВ являются, как правило, полифункциональными соединениями, что позволяет надежно идентифицировать это соединение, используя комплекс реакций. В то же время, наличие нескольких ФГ в одном веществе оказывает влияние на эффект некоторых общих реакций и на свойства их продуктов. Это повышает избирательность реакций, позволяет обнаруживать одним реактивом в смесях близкие по строению ЛВ.
Если реакция протекает количественно и стехиометрично, они могут быть использованы для количественного определения.
Лекарственные вещества, содержащие спиртовой гидроксил.
Спиртовой гидроксил – гидроксильная группа, связанная с алифатическим или алициклическим углеродным радикалом.
Его содержат ЛВ из группы спиртов (этиловый спирт, глицерин), карбоновых кислот и их солей (кальция лактат, кальция глюконат), терпены (ментол, терпингидрат) и др. (эфедрина гидрохлорид, левомицетин, прегнин, метилтестостерон).
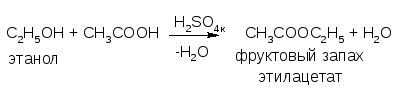
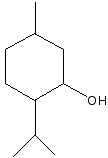
Реакция этерификации. Идет в присутствии водопритягивающих средств (Н2SО4 к.) с карбоновыми кислотами и их ангидридами. Основана на способности спиртов образовывать сложные эфиры.
Для низкомолекулярных спиртов (например, этилового) продукт обнаруживается по фруктовому запаху,
Для высокомолекулярных – по температуре плавления.
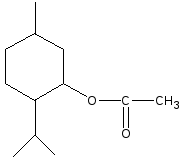
кип. 2 ч
пиридин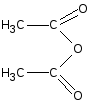
+
+ CH3COOH
ментол уксусный ангидрид белый кристаллический
осадок, Т°пл
Реакция окисления. Основана на свойстве спиртов окисляться до альдегидов (первичные – до альдегидов, иногда до кислот; вторичные – до кетонов; третичные – в жестких условиях до разрушения молекулы);
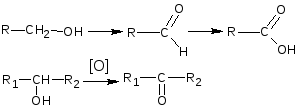
спирты проявляют слабые восстановительные свойства. Окисляются только сильными окислителями. В качестве реагентов используют сильные окислители: калия перманганат, калия бихромат, хлорная кислота, гексацианоферрат (III) калия и др. Наибольшую аналитическую ценность имеет калия перманганат, который восстанавливаясь, меняет степень окисления от (+7) до (+2) и обесцвечивается, т.е. делает реакцию наиболее эффектной.
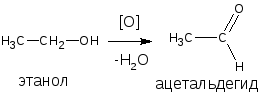
ацетальдегид имеет запах
свежих яблок
Окислению могут сопутствовать побочные химические реакции. Например:
- в случае эфедрина (фармакопейная реакция) – гидраминное разложение по схеме:
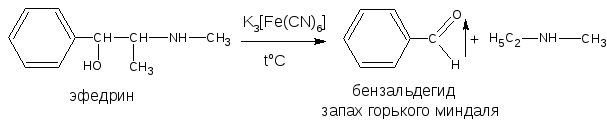
- в случае молочной кислоты (фармакопейная реакция на кальция лактат) – декарбоксилирование:

Примеры
Из реакций окисления первичных спиртов наибольший интерес представляет реакция «йодоформной» пробы:
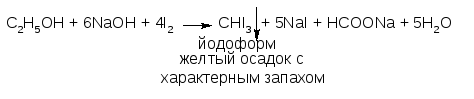
Йодоформ – желтый осадок с резким, характерным запахом.
Реакция идет по стадиям:
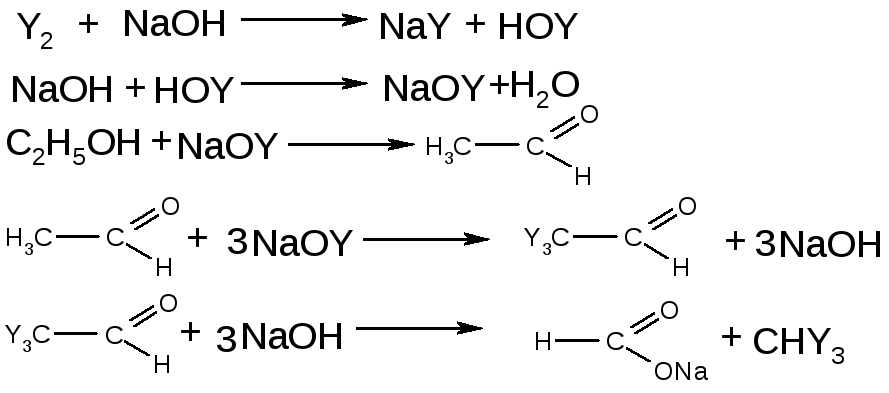
Эта реакция позволяет отличить этиловый спирт от метилового. Реакция характерна не только для этанола, но и для веществ, содержащих:
этокси-группу (-ОС2Н5),
альдегидную (-СОН ) ,
ацето-группу (-CОСН3),
гидроксикислоты.
Вторичные спирты окисляются до кетонов. Ментол окисляясь до ментона активирует метиленовую группу в положении 6, которую затем идентифицируют реакцией конденсации с ванилином.

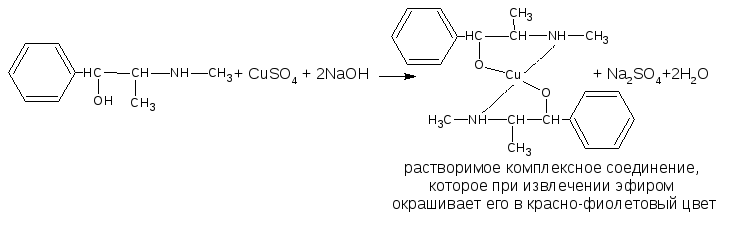
Реакция комплексообразования. Основана на свойстве спиртов образовывать окрашенные комплексные соединения с сульфатом меди (II) в щелочной среде. Избыток щелочи вызывает образование осадка гидроксида меди, маскирующий эффект реакции.
Спирты – это очень слабые кислоты, солей со щелочами они не образуют.
На силу кислотных свойств влияют характер заместителя в радикале и число гидроксильных групп в соединении: с увеличением их числа сила кислотных свойств возрастает:
Многоатомные спирты вследствие этого способны образовывать а)внутрикомплексные (хелатные) или б) комплексные соединения с солями меди или кобальта в сильнощелочной среде. Пример – реакция глицерина:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
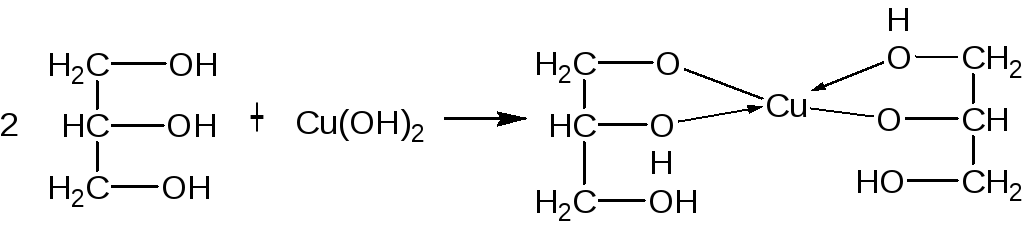
синий цвет
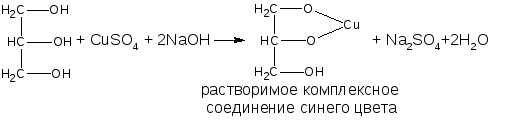
Одноатомные спирты вступают в реакцию комплексообразования, если кроме спиртового гидроксила в соединении содержатся другие электронодонорные группы, способные образовывать координационные связи с металлом (например, эфедрин, левомицетин)
эфедрин