- •Лекция №12. -Аминокислоты. Пептиды. Белки
- •I. -Аминокислоты
- •1. Номенклатура аминокислот и их классификация и по строению радикалов
- •Химические свойства
- •3. Окислительное дезаминирование in vitro или реакция Ван-Слайка
- •5. Качественная реакция на --аминокислоты – образование окрашенного сине-фиолетового соединения с нингидрином
- •6. Биохимические реакции -аминокислот
- •II. Белки и пептиды Строение белков и полипептидов.
- •Свойства белков
Лекция №12. -Аминокислоты. Пептиды. Белки
Белки – сложные биополимеры, мономерами которых являются -аминокислоты. В составе белков в организме человека встречаются только 20-аминокислот. Индивидуальность белков определяется порядком чередования аминокислот в белке. Белки это важнейший класс биологических соединений. Они играют ключевую роль в клетке, присутствуют в виде главных компонентов в любых формах живой материи, поэтому по-прежнему неопровержимо определение Ф.Энгельса, что «жизнь есть способ существования белковых тел». Белки чрезвычайно разнообразны по структуре и выполняют многочисленные биологические функции. Так в одном организме Escherichia сolli содержится более 3000 различных белков.
Название белки получили от яичного белка, который с незапамятных времен использовался в пищу.
Молекулярная масса белков варьирует от 5000 до 1млн и более. Белками являются ферменты, гормоны, антибиотики, токсины. Белки выполняют разнообразные функции: каталитические (ферменты), двигательные (актин, миозин) транспортные (гемоглобин, миоглобин, цитохромы), защитные (иммуноглобулины, антигены, фибриноген), рецепторные (родопсин), регуляторные (гистоны, репрессоры,) запасающие (казеин, овальбумин) Энергетическую функцию выполняют запасающие белки или иные в условиях длительного голодания или интенсивной длительной работы мышц.
Сравнительно небольшие молекулы с массой до 5000 называют пептидами, к ни относят некоторые гормоны (вазопрессин, адренокортикотропный гормон), глюкагон, нейропептиды мозга (эндорфин), пептиды сна, памяти, и т.п., алкалоиды (эрготамин) антибиотики (грамицидин)
I. -Аминокислоты
-Аминокислоты – гетерофункциональные соединения, молекулы которых содержат карбоксильную и аминогруппу у одного и того же атома углерода. В большинстве АК, этот атом углерода - хиральный центр. В АК, которые являются мономерами белков, он имеет относительную - L конфигурацию. Конфигурация определяется по первому хиральному атому (-углерод).
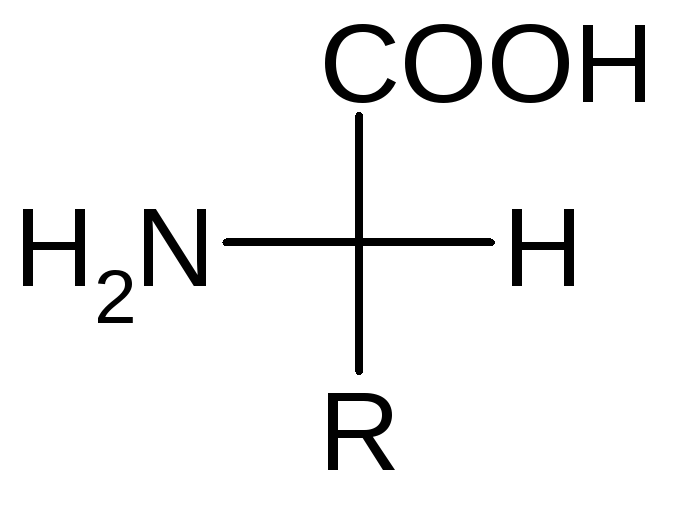
Все -АК имеют общий фрагмент или “стандартный блок” и отличаются радикалом у -углеродного атома. Отсутствует радикал только у глицина, у него вместо радикала атом водорода.
 NH2
– СН – СООН
NH2
– СН – СООН
R
1. Номенклатура аминокислот и их классификация и по строению радикалов
Названия для АК применяют преимущественно тривиальные (глицин от слова сладкий –glykos, серин от слова serieum – шелковистый, получен из фибрина шелка), для записи используют их трехбуквенное обозначение. В составе полипептидной цепочки остаток АК, не имеющий карбоксильной группы в стандартном блоке называется с изменением окончания –ИН на –ИЛ. Например, глицил вместо глицин и т.д.
По строению углеродного скелета радикалов АК делятся на алифатические, ароматические и гетероциклические. В составе радикалов могут быть функциональные группы, придающие им специфические свойства: карбоксильная, амино-, тиольная, амидная, гидроксильная, гуанидиновая. Сами АК все в воде растворимы, но в составе белка свойства радикала оказывают влияние на растворимость белка в воде, поэтому АК с гидрофобными неполярными радикалами формируют нерастворимые белки (коллаген), АК с гидрофильными полярными радикалами формируют растворимые в воде белки (альбумины). Гидрофобные радикалы это углеводородные структуры, которые способны «склеиваться» друг с другом образуя гидрофобные связи, но не образуют водородные связи с водой и поэтому не растворяются в ней. К ним относятся радикалы с неполярными связями (углеводородные радикалы). Гидрофильные радикалы имеют полярные связи и образуют диполь-дипольные или водородные связи водой. Гидрофобные и гидрофильные радикалы АК определяют пространственное строение белка, в который они входят.
Среди полярных радикалов также выделяют с зарядом (положительно и отрицательно заряженные), они лучше растворяются в воде и незаряженные, они растворяются в воде хуже.
Таблица. Строение аминокислот – мономеров белка
|
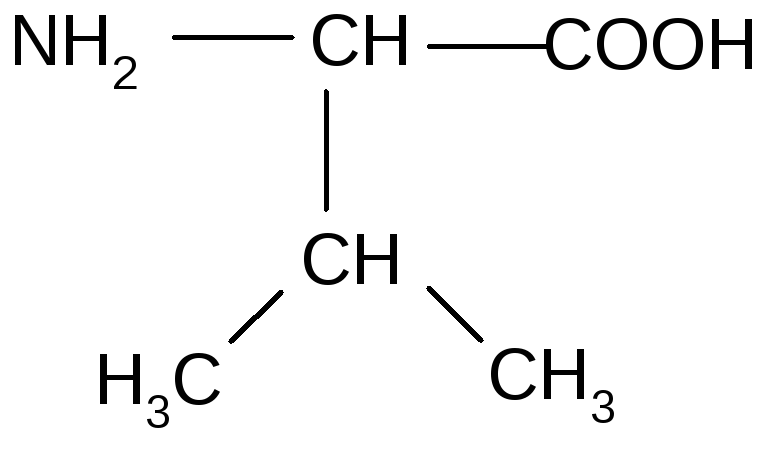
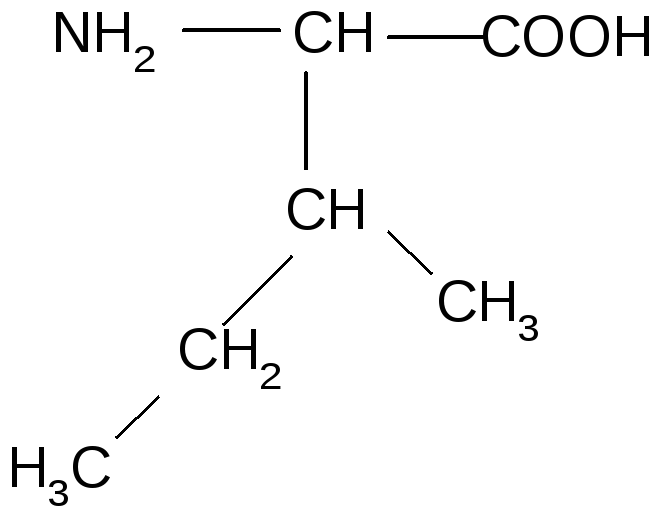
1.АК с алифатическими углеводородными радикалами (гидрофобные)
| ||
|
1 |
Глицин |
|
|
2 |
Аланин |
|
|
3 |
Валин |
|
|
4 |
Лейцин |
|
|
5 |
Изолейцин |
|
|
2. АК с ароматическими углеводородными радикалами (гидрофобные)
| ||
|
6 |
Фенилаланин |
|
|
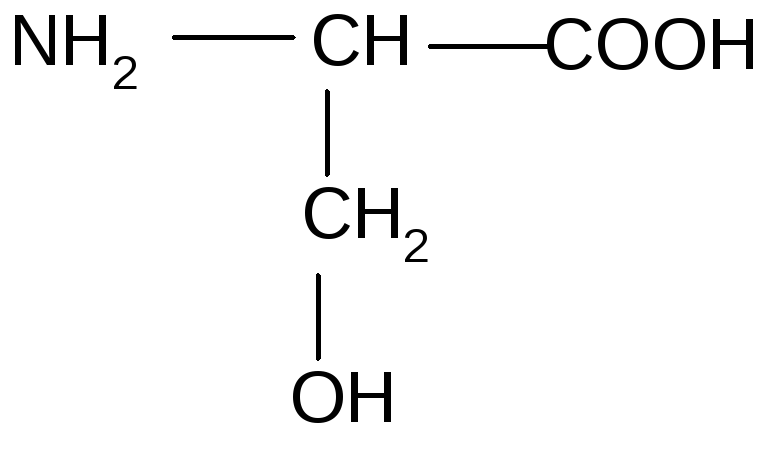
3. АК с гидроксильными группами (гидрофильные) | ||
|
7 |
Серин |
|
|
8 |
Треонин |
|
|
9 |
Тирозин |
|
|
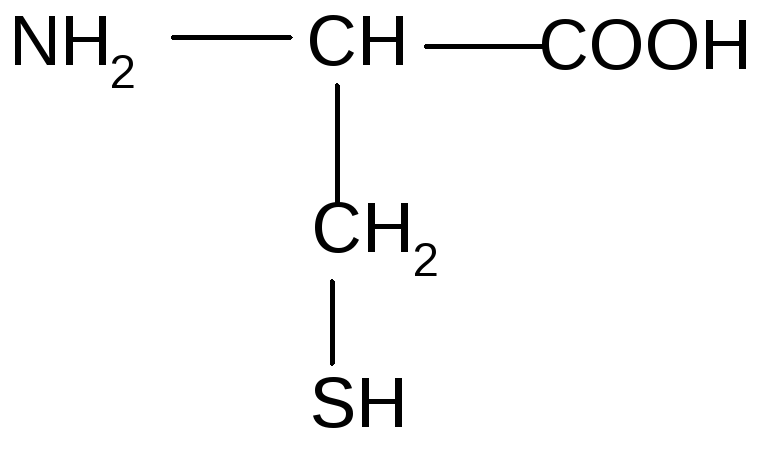
4. АК с серосодержашими радикалами (гидрофильные) | ||
|
10 |
Цистеин |
|
|
11 |
Метионин |
|
|
5. АК с карбоксильной группой в радикале (гидрофильные отрицательно заряженные)
| ||
|
12 |
Аспарагиновая кислота |
|
|
13 |
Глутаминовая кислота |
|
|
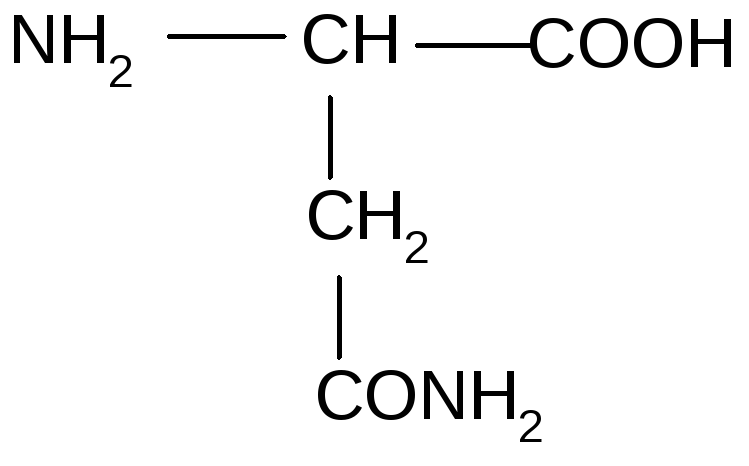
6. АК, содержащие амидные группы (гидрофильные)
| ||
|
14 |
Аспарагин |
|
|
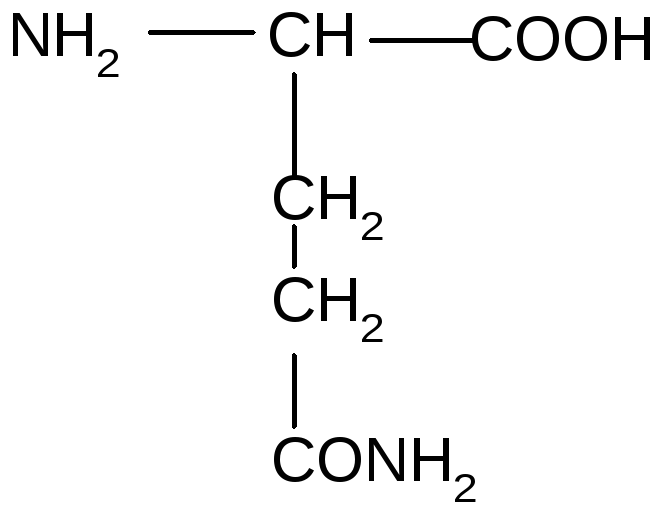
15 |
Глутамин |
|
|
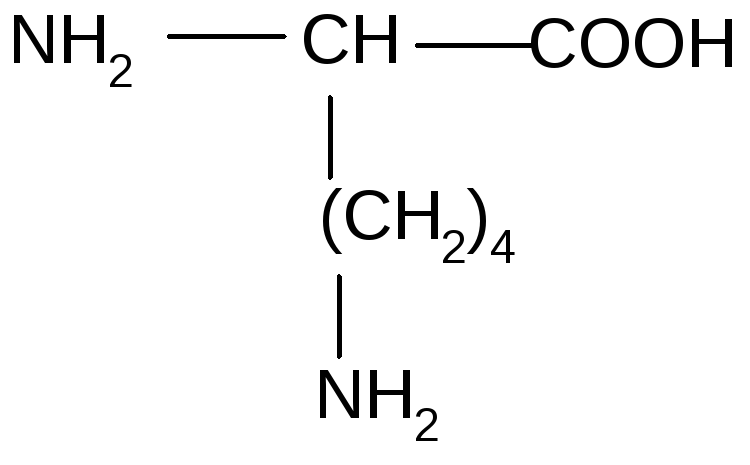
7. АК, содержащие аминогруппу в радикале (гидрофильные, положительно заряженные)
| ||
|
16 |
Лизин |
|
|
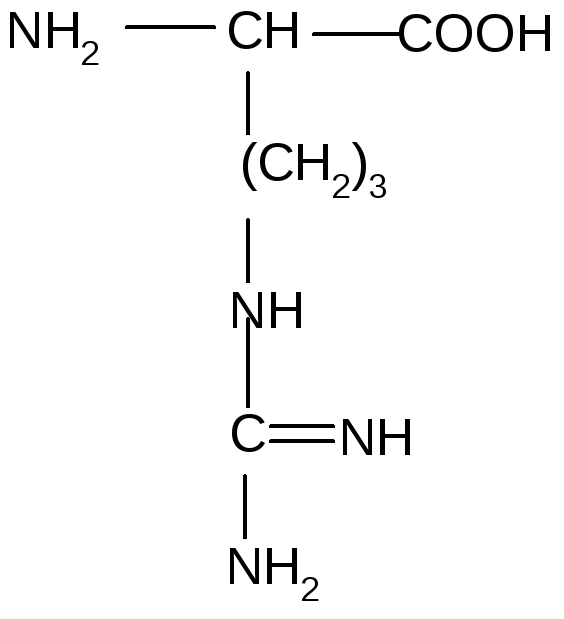
8. АК, содержащие гуанидиновую группу (гидрофильные, положительно заряженные | ||
|
17 |
Аргинин |
|
|
9. АК с гетероциклическими радикалами
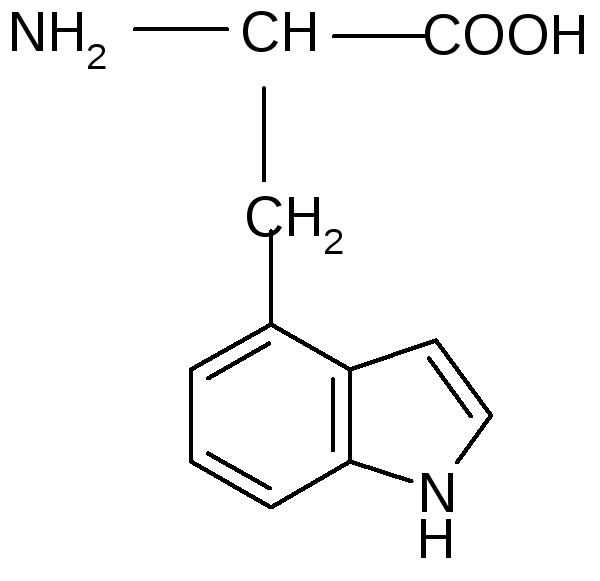
| ||
|
18 |
Триптофан (гидрофобный) |
|
|
19 |
Гистидин (гидрофильный, + заряженный) |
|
|
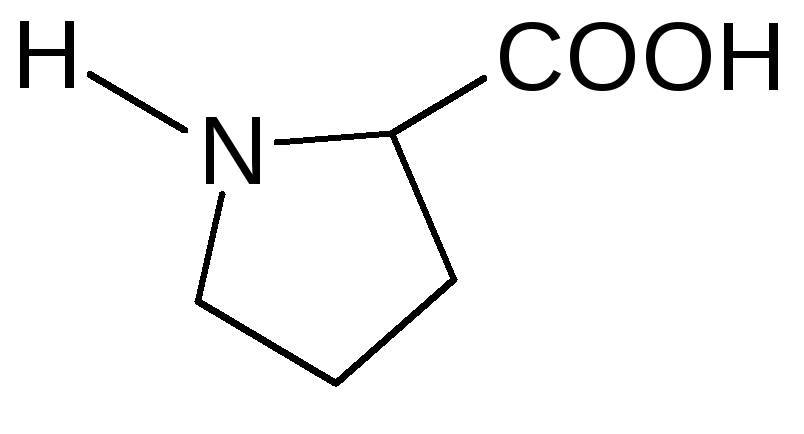
20 |
Пролин (гидрофобный) |
|