
- •Связь химической структуры спиртов и фармакологического действия:
- •Физические свойства
- •Химические свойства
- •Получение
- •Описание
- •Подлинность
- •Чистота
- •Специфические примеси
- •Количественное определение
- •Определение спирта в препаратах
- •Хранение
- •Применение
- •Получение
- •Описание
- •Подлинность
- •Чистота
- •Количественное определение
- •Нефармакопейные методы
- •Получение
- •Описание
- •Чистота
- •Подлинность
- •Хранение
- •Применение
- •Препараты сложных эфиров
- •Подлинность
- •Чистота
- •Хроматограмма исследуемого раствора нитроглицерина
- •Применение
СПИРТЫ
Спирты – это производные углеводов, в которых один или несколько атомов водорода заменены на гидроксильные группы. В зависимости от числа гидроксильных групп спирты подразделяются на одно-, двух-, трехатомные и др., а в зависимости от характера углеводородного радикала – на алифатические, ациклические и ароматические; первичные, вторичные и третичные спирты.
К лекарственным веществам группы алифатических спиртов относятся спирт этиловый и глицерол (глицерин).
В ряду спиртов существуют некоторые закономерности и взаимосвязи.
Связь химической структуры спиртов и фармакологического действия:
введение спиртового гидроксила в молекулу любого фармакологически-активного соединения ослабляет его токсичность и усиливает (в случае низкомолекулярных соединений) наркотический характер;
увеличение числа гидроксильных групп снижает токсичность спиртов. Например: метанол – глицерин – манит.
На физиологическую активность спиртов оказывает влияние следующие факторы:
длина углеродной цепи: очень токсичен метиловый спирт, у спиртов, содержащих более 6 атомов углерода, токсичность снижается и практически отсутствует у спиртов с цепочкой углеродов из 16 атомов, но дальнейшее увеличение цепи ведет к снижению активности и токсичности, что связано с изменением растворимости, а, следовательно, и всасываемости. 16 С содержащий спирт инертен;
разветвление цепи ведет к усилению физиологической активности (наркотической);
введение в молекулу спирта галогена или образование непредельных связей повышает наркотическую активность.
Физические свойства
Связь химической структуры спиртов и физическими свойствами:
Низкомолекулярные одноатомные спирты, например, этиловый, - это очень легко растворимые в воде легкокипящие жидкости. Удлинение углеродной цепи приводит к уменьшению растворимости. Этанол и глицерин смешиваются с водой в любых соотношениях.
С увеличением числа гидроксильных групп повышаются относительная плотность и температура кипения спиртов: низкомолекулярные одноатомные – подвижные жидкости, 3х-атомный спирт глицерин – вязкая жидкость, 6-атомные спирты (манит) – твердые вещества. Спиртам присущи очень высокие по сравнению с алканами температуры кипения.
Это объясняется особенностями строения спиртов. Атом кислорода в молекуле спирта обладает большой электроотрицательностью и оттягивает на себя электронную плотность связанных с ним атомов, в частности атомов водорода. Связь О – Н в молекуле спирта сильно поляризована, поэтому между двумя молекулами возникает водородная связь. Молекулы, связанные водородными связями, образуют ассоциаты.
Для разрыва водородных связей при переходе молекулы из газообразного состояния требуется дополнительная энергия. Этим и объясняются высокие температуры кипения спиртов. Наибольшую склонность к образованию водородных связей проявляют первичные спирты.
спиртовой гидроксил сообщает молекуле сладкий вкус. Это свойство не проявляется у одноатомных спиртов (метиловый, этиловый), но уже 3х-атомный спирт глицерин имеет ясно выраженный сладкий вкус, а 6-атомный спирт манит близок к сахарам, а сами сахара – это многоатомные альдегидо- или кетоспирты.
Химические свойства
(см лекции по функциональному анализу)
Спирты имеют нейтральную реакцию в растворах
Спирты проявляют слабые кислотные свойства. Одноатомные взаимодействуют с активными металлами (Na, Ca и др.) c образованием алкоголятов:
2C2H5OH + 2Na → 2C2H5ONa + H2↑
В присутствии следов влаги алкоголяты разлагаются до исходных спиртов. Они являются более слабыми кислотами, чем вода, поэтому не вступают в реакцию со щелочами.
Благодаря кислотным свойствам многоатомные спирты образуют комплексы с солями тяжелых металлов.
При взаимодействии с органическими кислотами спирты образуют сложные эфиры. Реакция протекает в присутствии концентрированной серной кислоты
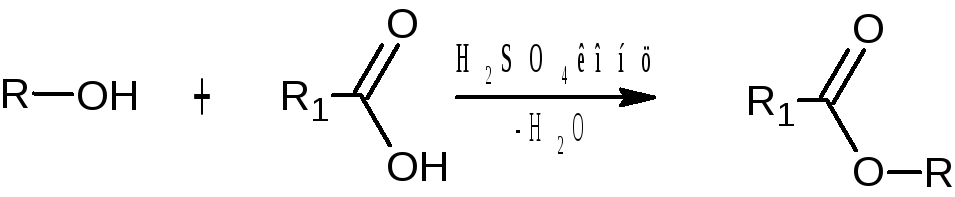
При взаимодействии с минеральными кислотами спирты образуют простые эфиры.2R – CH2 – OH → R – CH2 – O – CH2 – R
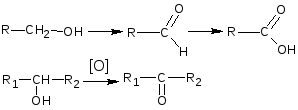
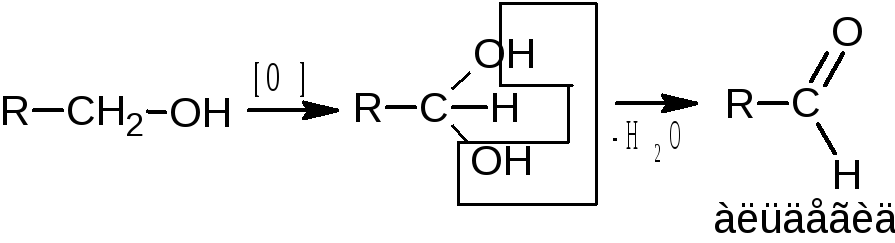
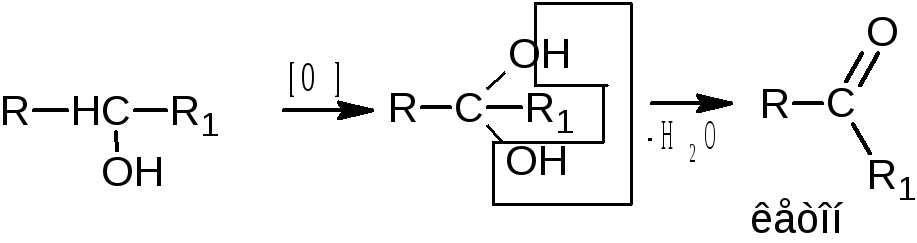
Спирты проявляют слабые восстановительные свойства. Окисление спиртов проводят сильными окислителями – смесью калия дихромата или калия перманганата с серной кислотой.
Первичные спирты окисляются до альдегидов, которые в свою очередь, могут окисляться до карбоновых кислот. Вторичные спирты окисляются до кетонов. Третичные спирты окисляются в жестких условиях с разрывом углеродной цепи.
Имеются: ФС на спирт этиловый 95% и ФС на спирт этиловый 90%, 70%, 40%
C2H5OH Спирт этиловый Этанол
Spiritus aethylicus 95%(ЛН) Ethanol (МНН)
Spiritus aethylicus 90%, 70%, 40%
