
- •Альдегиды
- •Фармакологические свойства
- •Химические свойства
- •I. Реакции окисления.
- •II. Реакции нуклеофильного присоединения.
- •Получение
- •Описание
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Хлоралгидрат
- •Получение
- •Описание
- •Растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Хранение
- •Применение
- •Углеводы: моносахариды и полисахариды. Общие понятия о группе.
- •Анализ химической структуры моносахаридов.
- •Изомерия моносахаридов.
- •Характеристика химической активности углеводов.
- •Превращения под действием кислот и щелочей.
- •Глюкоза (декстроза) Glucosum
- •Описание
- •Подлинность
- •Чистота
- •Количественное определение По фс сахара в порошке количественно не определяют
- •Хранение
- •Применение
- •Особенности приготовления и контроля качества в условиях аптек
- •Характеристика химической активности
- •Применение
- •Сахароза Sacharum (мнн)
- •Описание
- •Химические свойства.
- •Подлинность
- •Описание
- •Подлинность
- •Применение
Получение
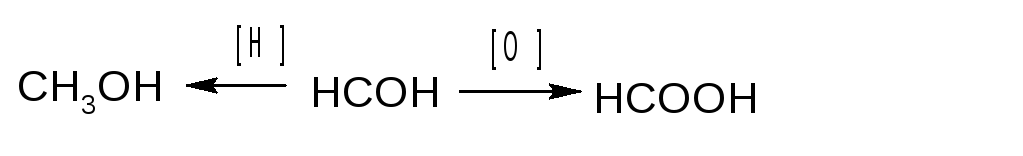
Формальдегид получают каталитическим окислением метилового спирта кислородом воздуха. Смесь паров метилового спирта и воздуха пропускают через нагретые до 500-600 оС трубки, наполненные катализатором (медь, серебро, кокс).

 Сu°
O
Сu°
O
2CH3OH + O2 → 2H – C + 2H2O
 H
H
![]()
После охлаждения формальдегид (бесцветный газ с резким запахом) растворяют в воде до получения 36,5-37,5%-ного водного раствора – формалина.
Впервые получен в 1868г. при пропускании воздуха, насыщенного парами метилового спирта, над раскаленной платиновой спиралью.
Описание
Раствор формальдегида – бесцветная прозрачная жидкость со своеобразным острым запахом. Смешивается с водой и спиртом.
Подлинность
ФС Реакция «серебряного зеркала».
ФС Реакция окислительной конденсации с кислотой салициловой в среде концентрированной H2SO4 в результате которой получается ауриновый краситель пара-хиноидной структуры красного цвета (см. химические свойства).
ФС Плотность раствора (1,078-1,093) для доказательства подлинности и чистоты.
Чистота
Специфическая примесь – муравьиная кислота, которая может образоваться:
а) при получении формальдегида, если процесс окисления пошел дальше;
б) в результате реакции дисмутации – в процессе хранения может происходить самоокисление-самовосстановление формальдегида. Продукт восстановления – метанол, окисления – муравьиная кислота. Раствор стабилизируют добавлением метанола.
Предельно допустимое содержание муравьиной кислоты определяют алкаметрическим методом – не более 0,2% (титруют 0,1н гидроксидом натрия по ф/фт до розового окрашивания).
НСООН + NaОН → НСООNa + Н2О
Стабилизируют прибавлением метилового спирта, не более 1,0% (предотвращает реакции полимеризации и дисмутации).
Количественное определение
ФС. Йодометрический метод обратного титрования. Основан на окислении альдегидной группы до карбоксильной раствором йода в щелочной среде.
К анализируемому раствору в щелочной среде добавляют избыток стандартного раствора йода. Формальдегид окисляется йодом до кислоты:
I2 + HCOH ↔ HCOOH + HI
В щелочной среде йод образует гипойодит (окисляет ЛВ) и йодид:
I2 + 2NaOH → NaI + NaIO + H2O
HCOH + NaIO + NaOH → HCOONa + NaI + H2O
Суммарно: HCOH + I2 + 3NaOH → HCOONa + 2NaI + 2H2O
Затем добавляют избыток разведенной серной кислоты и восстанавливают непрореагировавший натрия гипойодит и йодид до йода:
NaIO + NaI + H2SO4 → I2 + Na2SO4 + H2O
Выделившийся в эквивалентном количестве йод титруют тиосульфатом натрия по крахмалу:
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Кстех = 1/1 fэкв = 1· 1/2 = ½ М.э = 1/2М Т = М.э · Ст-та/1000
|
С% = |
(VI2 – VNa2S2O3) · K· T |
· 100 |
|
Vпр |
Нефармакопейные методы
Алкалиметрия в присутствии пергидроля – окисление пероксидом водорода (обратное титрование). Избыток 1 М раствора гидроксида натрия титруют 1 М раствором хлороводородной кислоты, индикатор – фенолфталеин, до исчезновения розовой окраски. Параллельно проводят контрольный опыт.
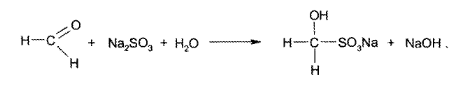
Гидросульфитный метод (вариант косвенного титрования)
В ЛС «Формидон» (4% спирто-водный раствор). К раствору препарата добавляют избыток натрия сульфита. Выделившееся эквивалентное количество гидроксида натрия титруют 0,1 М раствором хлороводородной кислоты, индикатор – фенолфталеин, до исчезновения розовой окраски. Параллельно проводят контрольный опыт.
Используя другой окислитель, например, реактив Несслера, можно провести также обратное (косвенное) йодометрическое титрование:
HCOH + K2[HgI4] + 3KOH → HCOOK + Hg↓ + 4KI + 2H2O
Hg + I2 → HgI2
HgI2 + 2KI → K2[HgI4]
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Спектрофотометрия.
Рефрактометрия. В условиях аптеки определяют растворы формальдегида.
